活性氧生成在卡铂诱导HN-3人喉鳞癌细胞凋亡中的作用△
毛雯静 张焕康 沈波 何培杰
·基础研究·
活性氧生成在卡铂诱导HN-3人喉鳞癌细胞凋亡中的作用△
毛雯静 张焕康 沈波*何培杰
目的观察卡铂(carboplatin)对HN-3人喉鳞癌细胞体外增殖的抑制作用、凋亡诱导,探讨活性氧生成在其中的作用。方法用卡铂以不同孵育浓度、不同孵育时间处理HN-3细胞,四甲基偶氮唑盐(MTT)法测定细胞活力,2′,7′二氯氢化荧光素已二脂(H2DCFDA)染色测定活性氧生成,Hoechst/PI双重染色检测细胞凋亡/坏死情况,蛋白印迹法(Western blotting)测定多聚ADP-核糖聚合酶(PARP)表达。结果卡铂对体外培养的HN-3细胞有增殖抑制作用,呈剂量依赖性和时间依赖性;卡铂诱导HN-3细胞活性氧生成及凋亡呈时间与剂量依赖性;卡铂诱导氧化压力下PARP表达上调。结论卡铂可抑制人喉鳞癌HN-3细胞增殖,诱导HN-3细胞凋亡,其机制可能与卡铂诱导HN-3细胞活性氧生成及氧化压力下PARP表达上调有关。(中国眼耳鼻喉科杂志,2015,15:384-387)
喉鳞癌;卡铂; 活性氧;凋亡;多聚ADP-核糖聚合酶
目前喉癌的治疗提倡以手术为主,辅以放化疗的综合治疗。近年来,诱导化疗、同步放化疗、序贯化疗、增效化疗等的提出与应用,在一定程度上提高了喉癌患者的生存率与治疗后的生存质量。卡铂是第2代铂类化合物, 其抗癌活性与顺铂相似, 但毒性明显低于顺铂[1]。本实验以体外培养的HN-3细胞为对象, 观察卡铂对HN-3细胞增殖和凋亡的影响,探讨卡铂在喉癌治疗中的作用机制。
1 材料与方法
1.1 细胞培养方法 AMC-HN-3细胞(韩国Asan Medical Center赠送)由1例先前未经任何治疗的63岁男性喉鳞癌患者标本分离纯化而来[2],培养在含有10% 胎牛血清混合100 U/mL青霉素、100 μg/mL链霉素的RPMI1640培养基(Hyclone 公司,美国)。恒温箱培养条件为饱和湿度,5% CO2,95%空气,37 ℃。0.25%胰酶-0.01%乙二胺四乙酸(EDTA) 消化传代细胞。
1.2 四甲基偶氮唑盐实验 细胞增殖活力由四甲基偶氮唑盐(methyl thiazolyl tetrazolium,MTT)实验进行评价。按规定的时间处理标本后,50 μL MTT 液体 (2 mg/mL) 加入96孔板培养孔孵育2 h后,将MTT液更换为100 μL 二巯基琥珀酸(DMSO)。经20 s振荡后,测量540 nm波长吸光度,细胞活力百分比按下述公式进行计算:细胞活力(%)=治疗组平均吸光度/对照组平均吸光度×100%。
1.3 激光共聚焦显微镜 活性氧(reactive oxygen series, ROS)生成通过2′,7′二氯氢化荧光素已二脂(H2DCFDA) (D399,Molecular Probes 公司,美国)染色进行评价。简要步骤包括:标本经卡铂处理达到要求的时间点后,以2 μmmol/L H2DCFDA在37 ℃下孵育细胞30 min;之后以磷酸盐缓冲液轻柔冲洗细胞,激光共聚焦显微镜采集荧光图片。细胞核形态通过Hoechst (33342) /PI (Sigma公司,美国)双重染色进行评价。简要步骤[3]为:经卡铂处理完毕的标本以2 μg/mL Hoechst (33342)孵育30 min,培养液更换后再以2 μg/mL PI孵育10 min。激光共聚焦显微镜观察标本,拍照。1.4 蛋白印迹实验 光动力疗法治疗24 h后,抽提细胞总蛋白,-20 ℃保存。调整各组总蛋白浓度使每孔上样量一致(100 μg), 10%聚丙烯酰胺凝胶垂直电泳分离后将蛋白转到硝酸纤维素膜。经过脱脂奶粉封闭和洗膜后,分别加入目的抗体,4 ℃过夜。然后按照1∶2 000稀释浓度加入兔抗过氧化物酶偶联的二抗室温标记1 h, 最后进行显影、水洗、定影后观察结果[GAPDH 购于英国Abcam公司,多聚ADP-核糖聚合酶(poly ADP-ribose polymerase,PARP)购于美国SantaCruz 公司]。
1.5 统计学处理 数据以均数±标准差(SD)表示,应用SPSS11.0软件处理数据,组间率的比较采用方差分析检验。以P<0.05为差异有统计学意义。
2 结果
2.1 卡铂对HN-3细胞增殖的影响 随着卡铂浓度的增加,标本540 nm波长吸光度下降(图1A),细胞活力相应下降,增殖活力降低。0.04~2.50 mg/mL 卡铂孵育下,HN-3细胞活力与对照组比较,差异均有统计学意义(P值均<0.001)(图1B)。以0.08 mg/mL 卡铂孵育HN-3细胞,孵育1 h细胞活力无明显变化(P=0.136),孵育3 h后随着时间的延长,细胞增殖活力逐渐下降。0.08 mg/mL 卡铂孵育3~48 h,HN-3细胞活力与对照组比较,差异均有统计学意义(P值均<0.001)(图2)。
2.2 卡铂诱导HN-3细胞ROS生成 荧光标记染料H2DCFDA本身不发荧光,经过ROS氧化可转换成有绿色荧光的DCFDA[4]。因此,H2DCFDA染色可间接体现ROS生成的强弱。经过24 h孵育,随着卡铂浓度的增加(从0.08 mg/mL至0.63 mg/mL),DCFDA荧光逐渐增强,提示HN-3细胞生成的ROS逐渐增多(图3)。0.08 mg/mL卡铂孵育HN-3细胞3、6、12、24、36、48 h,DCFDA荧光逐渐增强,表明随着孵育时间延长,HN-3细胞生成的ROS逐渐增多(图4)。

图1. 不同浓度卡铂对HN-3细胞增殖的影响 **示0.04~2.50 mg/mL卡铂与对照组比较,P<0.01。本实验重复3次

图2. 0.08 mg/ml卡铂在不同孵育时间对HN-3增殖的影响 **示0.08 mg/mL卡铂孵育1~48 h,与对照组比较,P<0.01。本实验重复3次

图3. 不同剂量卡铂诱导HN-3细胞ROS生成与细胞凋亡(×100)
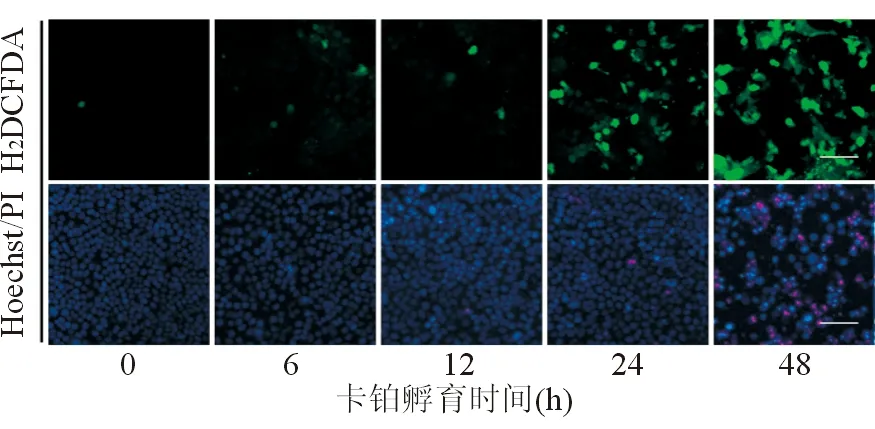
图4. 0.08 mg/mL卡铂孵育HN-3 细胞不同时间后ROS生成及凋亡诱导(×100)
2.3 卡铂诱导HN-3细胞凋亡 Hoechst 33342是一种嗜核酸荧光染料。正常细胞经Hoechst染色表现为蓝色类圆形细胞核,而凋亡细胞则表现为皱缩、浓染、有时碎裂的亮蓝色细胞核。荧光染料PI不能透过完整的细胞膜,因此正常细胞和早期凋亡细胞不会染色。对于晚期凋亡细胞和坏死细胞,PI可将细胞核染成紫红色。晚期凋亡细胞表现为紫色、亮蓝双染的浓缩、碎裂细胞核;坏死细胞则表现为紫色、蓝色双染的类圆形细胞核。
与ROS生成规律一致,Hoechst33342/PI双重染色显示,经过24 h孵育,0.08~0.63 mg/mL卡铂处理的HN-3细胞随着卡铂浓度的增加,凋亡细胞的比例逐渐增加,凋亡细胞表现为Hoechst33342/PI核皱缩、浓染、碎裂(图3)。0.08 mg/ml卡铂孵育HN-3细胞3、6、12、24、36、48 h,HN-3细胞凋亡比例逐渐增多,呈时间依赖性(图4)。
研究表明,PARP裂解在凋亡诱导过程中发挥正调节作用。蛋白印迹实验显示,随着卡铂孵育时间的延长,PARP裂解量逐渐增加,呈现出凋亡诱导的时间依赖性特点(图5)。图6显示,0.08 mg/mL较0.04 mg/mL卡铂孵育HN-3细胞诱导PARP表达量明显增加。以抗氧化剂谷胱甘肽(glutathione,GSH)共同孵育HN-3细胞,PARP裂解量显著减少,显示出ROS生成在卡铂诱导PARP表达中的重要作用。

图5. 在不同时间点0.08 mg/mL卡铂孵育HN-3 细胞PARP表达

图6. 抗氧化剂谷胱甘肽(GSH)对卡铂诱导HN-3细胞PARP表达的影响
3 讨论
卡铂是一种类烷化剂的抗肿瘤药物, 其作用的分子机制为引起DNA 链间及链内交联, 破坏DNA 而抑制肿瘤的生长[5]。本研究结果显示,卡铂能够显著抑制HN-3细胞增殖活性,诱导其凋亡,呈剂量与时间依赖性。随着卡铂孵育时间延长,以及孵育浓度的增加,HN-3细胞生成的ROS也逐渐增多。因此我们提出,卡铂诱导的ROS生成可能在其诱导HN-3细胞凋亡及增殖抑制上发挥重要作用。
由超氧离子、过氧化氢和羟自由基组成的ROS是细胞代谢的副产品,主要来源是线粒体和质膜。在生理情况下,少量的ROS 作为信号分子参与细胞信号转导,调控细胞活动;在病理情况下,过量、持续的ROS 产生造成细胞严重的氧化应激,导致损伤性后果。ROS 水平对细胞生死有着复杂的影响,由此对肿瘤、糖尿病、神经退行性病变等氧化应激相关疾病的发生和进程带来复杂的影响,其中机制尚未完全阐明[6]。
研究发现,几乎所有的肿瘤细胞均有一个共同点,即细胞内抗氧化酶活性较正常细胞低,对ROS的清除效率低。因此提高肿瘤细胞内的ROS含量,无疑有利于对肿瘤细胞的损伤和抑制[7]。本研究结果显示,卡铂处理后能增加喉癌HN-3细胞内ROS的生成释放,呈剂量与时间依赖性特点。我们以GSH与卡铂同时孵育HN-3细胞,应用抗氧化剂抑制ROS生成,结果显示,较卡铂单纯孵育组,同时孵育GSH组PARP裂解量明显减少,表明ROS生成在卡铂诱导HN-3细胞凋亡过程中发挥决定性作用。
我们先前的研究表明,诱导大量的ROS产生是光动力疗法的主要机制之一[8]。因此,联合卡铂和PDT可能提高肿瘤细胞内的ROS生成,进而有利于杀伤肿瘤细胞。我们曾尝试卡铂和PDT联合治疗HN-3细胞,结果提示,联合治疗组较单一治疗组有协同的细胞毒性杀伤效果和凋亡诱导[3],从而提出,卡铂可能是通过增加PDT的ROS生成途径增强其光化学毒性及凋亡诱导。本实验结果进一步支持了这一假说。联合治疗后能否协同产生ROS,调控ROS生成后细胞毒性杀伤效果和凋亡诱导能否随之改变,以及具体参与的凋亡信号传导通路均需进一步的实验证实。
同为铂类化疗药,卡铂较顺铂的肾毒性更低,对一些肿瘤的疗效更好,但其治疗过程中存在固有的或获得性的耐药以及其他药物不良反应。有学者将卡铂与其他化疗药或PDT等其他治疗方式联合应用[3, 9-10],为进一步提高疗效、降低药物不良反应做了有益的尝试,其中的机制值得深入研究。
[1] Rajeswaran A, Trojan A, Burnand B, et al. Efficacy and side effects of cisplatin- and carboplatin-based doublet chemotherapeutic regimens versus non-platinum-based doublet chemotherapeutic regimens as first line treatment of metastatic non-small cell lung carcinoma: a systematic review of randomized controlled trials[J]. Lung Cancer, 2008,59(1):1-11.
[2] Kim SY, Chu KC, Lee HR, et al. Establishment and characterization of nine new head and neck cancer cell lines[J]. Acta Otolaryngol, 1997,117(5):775-784.
[3] He P, Ahn JC, Shin JI, et al. Enhanced apoptotic effect of combined modality of 9-hydroxypheophorbide alpha-mediated photodynamic therapy and carboplatin on AMC-HN-3 human head and neck cancer cells[J]. Oncol Rep, 2009,21(2):329-334.
[4] Afri M, Frimer AA, Cohen Y. Active oxygen chemistry within the liposomal bilayer. Part Ⅳ: locating 2′,7′-dichlorofluorescein (DCF), 2′,7′-dichlorodihydrofluorescein (DCFH) and 2′,7′-dichlorodihydrofluorescein diacetate (DCFH-DA) in the lipid bilayer[J]. Chem Phys Lipids, 2004,131(1):123-133.
[5] Hato SV, Khong A, de Vries IJ, et al. Molecular pathways: the immunogenic effects of platinum-based chemotherapeutics[J]. Clin Cancer Res, 2014,20(11):2831-2837.
[6] Finkel T. Oxidant signals and oxidative stress[J]. Curr Opin Cell Biol, 2003,15(2):247-254.
[7] Sabharwal SS, Schumacker PT. Mitochondrial ROS in cancer: initiators, amplifiers or an Achilles′ heel?[J]. Nat Rev Cancer, 2014,14(11):709-721.
[8] He P, Ahn JC, Shin JI, et al. Photoactivation of 9-hydroxypheophorbide alpha triggers apoptosis through the reactive oxygen species-mediated mitochondrial pathway and endoplasmic reticulum stress in AMC-HN-3 laryngeal cancer cells[J]. Int J Oncol, 2010,36(4):801-808.
[9] Rizvi I, Celli JP, Evans CL, et al. Synergistic enhancement of carboplatin efficacy with photodynamic therapy in a three-dimensional model for micrometastatic ovarian cancer[J]. Cancer Res, 2010,70(22):9319-9328.
[10] Grilley-Olson JE, Keedy VL, Sandler A, et al. A randomized phase II study of carboplatin with weekly or every-3-week nanoparticle albumin-bound paclitaxel (abraxane) in patients with extensive-stage small cell lung cancer[J]. Oncologist, 2015,20(2):105-106.
(本文编辑 杨美琴)
Role of reactive oxygen series generation in the apoptosis of HN-3 human laryngeal carcinoma cells induced by carboplatin
MAOWen-jing,ZHANGHuan-kang,SHENBo*,HEPei-jie.
DepartmentofOtolaryngology,EyeEarNoseandThroatHospitalofFudanUniversity,Shanghai200031,China
HE Pei-jie, E mail: hepj2002@sina.com
Objective To investigate the role of reactive oxygen series (ROS) in suppressing cell viability and inducing apoptosis of HN-3 human laryngeal squamous carcinoma cells induced by carboplatin. Methods The attached HN-3 cancer cells were treated with different concentrations of carboplatin for 24 h and 0.08 mg/mL carboplatin at indicated time points. Methyl thiazolyl tetrazolium(MTT) assay was used to detect cellular viability. H2DCFDA staining and Hoechst 33343/PI double staining were performed to monitor reactive oxygen series (ROS) generation and apoptosis/necrosis, respectively. Western blotting technique was used to assess the expression of poly ADP-ribose polymerase(PARP). Results Suppression of cellular viability on HN-3 cells induced by carboplatin was exhibited in a dose and time related pattern. Remarkable generation of ROS and apoptosis of HN-3 cells were initiated by carboplatin in dose and time related manner. Up-regulated expression of PARP under oxidative stress, induced by carboplatin, was partially inhibited by co-incubated with glutathione. Conclusions Generation of ROS and up-regulated PARP may play an important role in the suppression of cellular viability and apoptosis induction of HN-3 cells exerted by carboplatin. (Chin J Ophthalmol and Otorhinolaryngol,2015,15:384-387)
Laryngeal squamous cell carcinoma; Carboplatin; Reactive oxygen series; Apoptosis; Poly ADP-ribose polymerase
国家自然科学基金面上项目(81172557);教育部留学回国人员科研启动基金(第45批)
复旦大学附属眼耳鼻喉科医院耳鼻喉科 上海 200031;*复旦大学放射医学研究所 上海 200032
何培杰(Email:hepj2002@sina.com)
10.14166/j.issn.1671-2420.2015.06.002
2015-04-02)

