冠状动脉微血管内皮细胞释放的神经调节蛋白-1对缺血/再灌注心肌的作用及其机制探讨
郝启萌 司瑞 叶瑾 付志诚 王琛 邵虹 张荣庆 郭文怡
·基础研究·
冠状动脉微血管内皮细胞释放的神经调节蛋白-1对缺血/再灌注心肌的作用及其机制探讨
郝启萌 司瑞 叶瑾 付志诚 王琛 邵虹 张荣庆 郭文怡
目的 探讨大鼠缺血/再灌注损伤(I/RI)时,神经调节蛋白-1(NRG-1)在冠状动脉微血管内皮细胞(CMECs)-心肌细胞共培养中的作用及其机制。方法 分离培养大鼠CMECs和心肌细胞,建立CMECs-心肌细胞共培养(Coculture)模型和体外模拟缺血/再灌注(SI/R)模型,收集CMECs 培养上清。MTT法检测心肌细胞活性,TUNEL法检测心肌细胞凋亡指数,Western blot法检测CMECs 培养上清中NRG-1表达、心肌细胞pErbB2、pERK基因和环氧化酶-2 (COX-2)水平,含半胱氨酸的天冬氨酸蛋白水解酶-3(caspase-3)酶活性反应心肌细胞凋亡。结果 在心肌细胞中,与对照组相比,SI/R(4 h/4 h)组细胞活性明显降低(P<0.01),SI/R+Coculture组细胞活性升高(P=0.02)。CMECs在SI/R 4 h/4 h时,NRG-1的分泌较对照组增加最明显(P<0.01)。心肌细胞SI/R组凋亡指数和Caspase-3酶活性比对照组明显升高(27.97±0.90比3.58±0.23,P<0.01;375.93±11.76比100.00±0.00,P<0.01)。共培养或NRG-1处理细胞后,凋亡指数和Caspase-3酶活性较SI/R组降低(16.82±1.03比27.97±0.90,P<0.01;166.16±15.15比375.93±11.76,P<0.01),且ErbB2和ERK磷酸化水平以及COX-2表达明显增加(均为P<0.01)。用ErbB2或ERK1/2抑制剂预处理心肌细胞后,共培养和NRG-1的作用消失(均为P<0.01)。结论 在I/RI过程中,CMECs释放NRG-1,抑制I/RI诱导的心肌细胞凋亡,其保护作用与增加ErbB2、ERK磷酸化和COX-2表达可能有关。
缺血/再灌注损伤; NRG-1; 心肌细胞; 冠状动脉微血管内皮细胞; 凋亡
缺血性心脏病是许多国家人口死亡的主要原因。当发生急性血管堵塞时,及时恢复心肌血供是治疗的关键。然而,再灌注常引起缺血/再灌注损伤(ischemia/reperfusion injury,I/RI),可导致病情恶化。前期研究证实,冠状动脉微血管内皮细胞(cardiac microvascular endothelial cells,CMECs)和心肌细胞的凋亡与I/RI的发生密切相关。内皮细胞-心肌细胞的相互作用在调节心脏功能中占有重要地位。研究显示,心内膜和血管内皮细胞可以促进心肌细胞存活[1-2]。但在I/RI过程中,CMECs是否能保护心肌报道少见。
神经调节蛋白-1(neuregulin-1,NRG-1)是表皮生长因子家族的成员之一,由内皮细胞合成释放[3],作用于受体ErbB2,发挥心脏保护作用[4]。然而,在I/RI过程中,CMECs是否能释放NRG-1,促进心肌细胞存活,鲜有报道。ErbB2受体可以激活细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)信号级联反应[5],受ERK1/2调节的环氧酶-2(cyclo-oxygen-ase-2,COX-2)[6],对I/RI的心肌起保护作用[7]。但在CMECs-心肌细胞共培养时,ERK是否在保护I/RI心肌中起重要作用以及ERK和COX-2是否有关联仍不明确。本实验将在细胞水平模拟缺血/再灌注损伤(SI/R),建立内皮-心肌细胞相互作用的实验模型,观察NRG-1是否减少I/RI诱导的心肌细胞凋亡,并初步探讨其发生机制。
1 材料和方法
1.1 实验动物和材料
雄性SD大鼠,清洁动物,3~4周龄,体质量100~150 g,购自第四军医大学实验动物中心。NRG-1小鼠抗大鼠单克隆抗体和COX-2兔抗大鼠单克隆抗体购自Millipore公司,pErbB2和pERK兔抗大鼠单克隆抗体,以及ERK1/2抑制剂PD98059购自Cell Signaling Technologies公司,ErbB2抑制剂购自Neomarkers公司,NRG-1β重组蛋白购自PeProtech公司。
1.2 方法
1.2.1 细胞培养 采用酶消化法分离SD大鼠CMECs[8]。处死SD大鼠,取出心脏,去除心房、大血管及结缔组织,酒精中浸泡。剪碎心肌组织,加入Ⅱ型胶原酶,水浴中消化7 min;再加入胰蛋白酶,水浴中消化15 min。终止消化,离心弃上清,重悬后,接种于25 cm2培养瓶,培养6 h后换液。以后每2 d换液1次,待细胞呈鹅卵石状铺满培养瓶底时,进行细胞传代。实验所用细胞为稳定生长的第2~3代细胞。参照文献[9]的方法,大鼠心肌细胞从1~3 d的SD大鼠乳鼠中分离。
[4]的方法,心肌细胞接种到6孔板或24孔板底部,CMECs接种到transwell共培养小室中,并插入到接种有心肌细胞的孔板中,共同培养一段时间,直至两种细胞均单层融合。随后移除小室,检测心肌细胞。
1.2.2 SI/R模型的建立 模拟缺血/再灌注(simulated ischemia/reperfusion,SI/R)的模型建立参考文献[10]。更换培养液为缺血液(mmol/L):包含NaCl (118),KCl(16),MgCl2(0.49),CaCl2·2H2O(2.5),NaHCO3(24),NaHPO4·H2O(1.0),EDTA·2H2O(0.5),乳酸(20),PH为6.5。共培养细胞37℃缺氧孵箱内孵育4 h,更换正常培养液,37℃ 5%CO2孵箱内孵育4 h。
1.2.3 实验分组 (1)CMECs采用随机数字表分组:①对照组:正常培养液培养,不加任何干预; ②SI/R组(缺血缺氧2、4、6 h,复氧4 h)。分别收集各组CMECs培养上清,储存在-20 ℃中。(2)心肌细胞随机分组:①对照组;②SI/R组:缺血缺氧4 h,复氧4 h;③SI/R+Coculture组:与CMECs共培养建立SI/R模型;④SI/R+Coculture+anti-ErbB2组:1 μg/ml ErbB2抑制剂预处理心肌细胞1 h,与CMECs共培养建立SI/R模型;⑤SI/R+NRG-1组:SI/R时加入3 μmol/L NRG-1β重组蛋白;⑥SI/R+NRG-1+anti-ErbB2组;⑦SI/R+NRG-1+PD组:50 mmol/L PD98059预处理心肌细胞1 h,加入NRG-1β重组蛋白,建立SI/R模型。
1.2.4 MTT法检测心肌细胞活性 取同一批分离的心肌细胞,接种于24孔板,每组设4个复孔。待细胞生长至70%汇合后,按上述方法进行分组及造模。复氧结束后加MTT培养4 h,吸弃上清后,加入DMSO震荡10 min。待结晶物溶解,用酶标仪处检测各组吸光度值。
1.2.5 TUNEL法检测心肌细胞凋亡指数 制备细胞玻片,建立模型后,按照TUNEL试剂盒说明书操作。TUNEL染色阳性为凋亡细胞,呈绿色荧光,DAPI对所有细胞核进行染色,呈蓝色荧光。每张爬片随机选取10个视野进行计数,每个实验组计数80个视野,统计内皮细胞总数和凋亡细胞数,取其平均值。AI(凋亡指数)=TUNEL阳性细胞数/总细胞数×100%。
1.2.6 Western blot检测 将细胞重悬至细胞裂解液中,低温离心取上清液备用。收集的CMECs培养上清液用millipore离心超滤装置4 ml浓缩,蛋白质进一步用三氯乙酸沉淀。电泳转膜孵抗后,化学发光法曝光观察结果,以β-actin作为内参,采用Bio-image(Bio-Rad)分析软件采集信号和灰度扫描。
1.2.7 Caspase-3活性的检测 使用Caspase-3酶活性检测试剂盒检测Caspase-3活性。按照说明制备细胞样本,测定A405。样品的A405扣除空白对照的A405即为样品中Caspase-3催化产生的4-硝基苯胺(p-nitroaniline,pNA)产生的吸光值。计算出各个样品单位重量蛋白中所含的Caspase-3的酶活力单位。
1.3 统计学方法
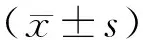
2 结果
2.1 各组心肌细胞活性的比较
图1显示,与对照组相比较,SI/R组的心肌细胞活性明显下降(0.330±0.018比0.180±0.017,P<0.01)。CMECs-心肌细胞共培养,可增加SI/R后的细胞活性(0.265±0.011比0.180±0.017,P=0.02)。
与对照组相比,aP<0.01;与SI/R组相比,bP<0.05
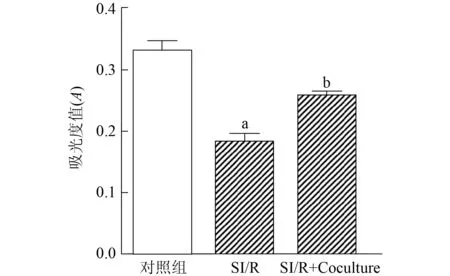
2.2 CMECs培养上清中NRG-1表达检测
与对照组相比,aP<0.01
正常情况下,CMECs培养上清中几乎无分泌型NRG-1。CMECs进行SI/R处理后,NRG-1水平升高。与对照组相比,缺血缺氧2,4,6 h时,NRG-1分别升高2.32%、3.51%、3.75%(均为P<0.01),且4 h时升高最明显。故以4 h/4 h作为SI/R的时间点。见图2。
2.3 各组心肌细胞凋亡指数比较
与对照组相比,SI/R组的心肌细胞凋亡率明显增加(3.58±0.23比27.97±0.90,P<0.01)。而SI/R+Coculture组和SI/R+NRG-1组的心肌细胞凋亡率(16.82±1.03、12.07±0.46)较SI/R组(27.97±0.90)明显降低(均为P<0.01)。心肌细胞
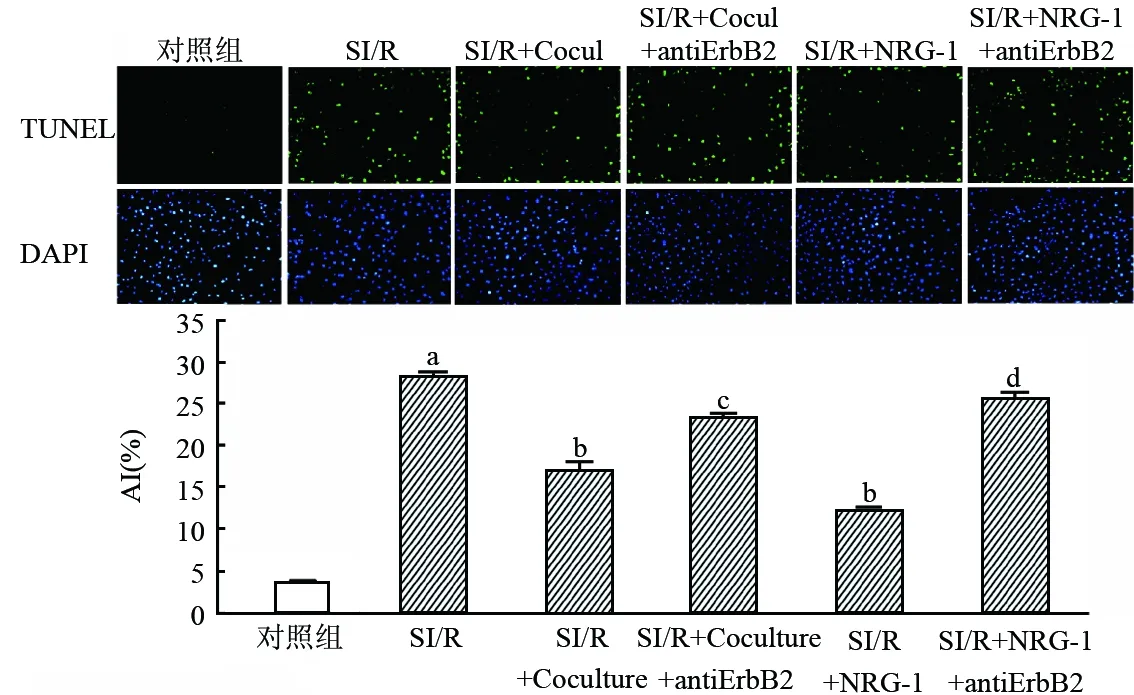
与对照组相比,aP<0.01;与SI/R组相比,bP<0.01;与SI/R+Coculture组相比,cP<0.01;与SI/R+NRG-1组相比,dP<0.01
用ErbB2抑制剂处理后,共培养和NRG-1的这种抗凋亡作用减弱(SI/R+Coculture+anti-ErbB2组23.08±0.62,SI/R+NRG-1+anti-ErbB2组25.33±0.83,均为P<0.01)。见图3。
2.4 心肌细胞中pErbB2、pERK和COX-2表达检测
图4A显示,心肌细胞SI/R少量诱导ErbB2磷酸化。SI/R+Coculture组和SI/R+NRG-1组ErbB2磷酸化水平(3.50±0.23,4.49±0.15)较SI/R组明显增加(1.37±0.09)(均为P<0.01)。ErbB2抑制剂预先处理心肌细胞后磷酸化水平下降(SI/R+Coculture+anti-ErbB2组1.11±0.23比SI/R+Coculture组3.50±0.23,P<0.01;SI/R+NRG-1+anti-ErbB2组1.98±0.16比SI/R+NRG-1组4.49±0.15,P<0.01)。
图4B显示,SI/R组的心肌细胞中有少量磷酸化ERK。与SI/R组(1.27±0.05)相比,SI/R+Coculture组(3.47±0.32)和SI/R+NRG-1组(4.50±0.11)可以明显上调ERK磷酸化水平(均为P<0.01)。使用ErbB2抑制剂后共培养和NRG-1的磷酸化作用下降(SI/R+Coculture+anti-ErbB2组2.09±0.24比SI/R+Coculture组3.47±0.32,P<0.01;SI/R+NRG-1+anti-ErbB2组2.82±0.29比SI/R+NRG-1组4.50±0.11,P<0.01)。
图4C显示,与SI/R组相比,SI/R+NRG-1组可明显上调COX-2的表达(2.08±0.22比6.28±0.22,P<0.01)。分别使用ErbB2和ERK1/2抑制剂后,SI/R条件下的COX-2表达明显下降(SI/R+NRG-1+anti-ErbB2组3.12±0.28,SI/R+NRG-1+
PD组3.95±0.39,比SI/R+NRG-1组6.28±0.22,均为P<0.01)。
2.5 心肌细胞中Caspase-3活性检测
图5显示,与对照组相比,SI/R组细胞的Caspase-3酶活性明显升高(100.00±0.00比375.93±11.76,P<0.01)。与SI/R组相比,SI/R+NRG-1组的Caspase-3酶活性降低(375.93±11.76比166.16±15.15,P<0.01)。心肌细胞用ErbB2和ERK1/2抑制剂处理后,Caspase-3酶活性又升高(SI/R+NRG-1+anti-ErbB2组337.51±15.21,SI/R+NRG-1+PD组297.57±18.59,比SI/R+NRG-1组166.16±15.15,均为P<0.01)。
3 讨论
I/RI机制复杂尚未完全阐明[11]。以往研究多集中在心肌细胞和大血管内皮细胞。近年来研究显示微血管内皮细胞在机体生理和病理过程中起着非常重要的作用[12]。冠状动脉微血管内皮细胞(CMECs)数量多分布广,占整个心脏细胞的约1/3,且在形态和功能上呈明显特异性。发生I/RI时CMECs主要表现为正常屏障功能损伤和细胞凋亡[13]。我们前期研究证实,I/RI可以抑制CMECs的增殖能力和迁移能力,诱导细胞凋亡[14-15]。
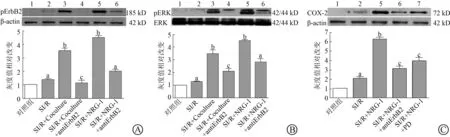
A和B:与对照组相比,aP>0.05;与SI/R组相比,bP<0.01;与SI/R+Coculture组相比,cP<0.01;与SI/R+NRG-1组相比,dP<0.01;C:与对照组相比,aP<0.01;与SI/R组相比,bP<0.01;与SI/R+NRG-1组相比,cP<0.01;1:对照组;2:SI/R;3:SI/R+Coculture;4:SI/R+Coculture+antiErB2;5:SI/R+NRG-1;6:SI/R+NRG-1+antiErB2;7:SI/R+NRG-1+PD
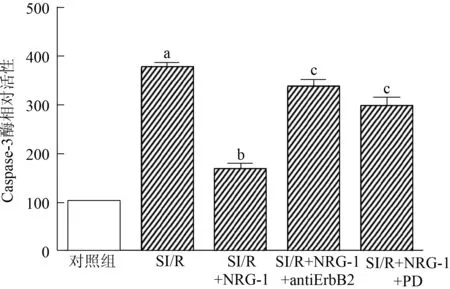
与对照组相比,aP<0.01;与SI/R组相比,bP<0.01;与SI/R+NRG-1组相比,cP<0.01
内皮细胞-心肌细胞的相互作用在调节心脏功能中占有重要地位。文献显示,心内膜内皮细胞和人冠状动脉内皮细胞可明显促进心肌细胞存活[1-2],减少缺氧复氧诱导的心肌细胞损伤[16]。但在I/RI过程中,CMECs是否能保护心肌细胞报道少见。我们的研究显示,SI/R(4 h/4 h)时心肌细胞活性明显下降,当CMECs和心肌细胞共培养时,SI/R的心肌细胞活性升高。表明CMECs-心肌细胞共培养可以保护SI/R诱导的心肌细胞损伤,这与Kuramochi 等[17]的研究结果相似。神经调节蛋白-1(neuregulin-1,NRG-1)是表皮生长因子(EGF)家族的成员之一,心内膜内皮细胞和心肌微血管内皮细胞可表达此蛋白[3, 18]。而心肌细胞则表达其受体ErbB2。I/RI诱导冠状动脉内皮细胞释放NRG-1,作用于受体ErbB2,发挥心脏保护作用[4]。然而,在I/RI过程中,CMECs是否也能释放NRG-1,促进心肌细胞存活少有报道。我们通过检测SI/R不同时间点,CMECs培养上清中NRG-1表达量,发现4 h/4 h时NRG-1表达量明显升高,确定4 h/4 h为SI/R的最佳时间。随后建立CMECs-心肌细胞共培养模型,进行SI/R。结果显示,SI/R时心肌细胞凋亡指数增高,共培养和加入NRG-1的心肌细胞凋亡指数均明显下降,而心肌细胞用受体ErbB2抑制剂预先处理后,这两组细胞的凋亡指数又增高。表明共培养中存在NRG-1,其作用效果与外源性NRG-1相同,作用于受体ErbB2,减少SI/R诱导的心肌细胞凋亡。
ErbB2受体活化可以激活ERK信号级联反应,促进心肌细胞成熟和生长,防止细胞凋亡[5]。但在CMECs-心肌细胞共培养时,ERK是否在保护SI/R心肌中起重要作用仍不明确。我们的研究结果显示,在SI/R过程中,共培养和NRG-1明显上调心肌细胞ErbB2和ERK磷酸化水平,降低Caspase-3酶活性。用ErbB2或ERK1/2抑制剂预先处理心肌细胞,磷酸化水平均降低,且Caspase-3酶活性升高。表明ERK参与了共培养时的NRG-1信号通路,且起重要作用。有研究报道,COX-2对I/RI的心肌起保护作用[7],其表达受ERK1/2活性的调节[6]。但在NRG-1/ErbB2通路中两者之间是否有关联仍不明确。我们发现,SI/R+NRG-1组的心肌细胞中COX-2表达明显增加,而分别用ErbB2和ERK1/2抑制剂处理后,COX-2表达减少。表明COX-2可能是ERK下游的分子,但COX-2是否起关键性作用有待进一步研究。
本研究表明,I/RI过程中CMECs可释放NRG-1,通过上调心肌细胞表面ErbB2磷酸化,激活下游ERK/COX-2通路,抑制I/RI诱导的心肌细胞凋亡。研究进一步阐明了CMECs和心肌细胞相互作用的可能机制,为研究有效保护I/RI心肌提供更多的实验依据。
参 考 文 献
[1] Noireaud J,Andriantsitohaina R. Recent insights in the paracrine modulation of cardiomyocyte contractility by cardiac endothelial cells[J]. Biomed Res Int, 2014, 2014: 923805.
[2] Kubin T,Ando H,Scholz D, et al.Microvascular endothelial cells remodel cultured adult cardiomyocytes and increase their survival[J]. Am J Physiol, 1999, 276: H2179-2187.
[3] Lemmens K,Segers VF,Demolder M,et al.Role of neuregulin-1/ErbB2 signaling in endothelium-cardiomyocyte cross-talk[J]. Biol Chem, 2006, 281: 19469-19477.
[4] Hedhli N,Huang Q,Kalinowski A,et al.Endothelium-derived neuregulin protects the heart against ischemic injury[J]. Circulation, 2011, 123: 2254-2262.
[5] Fuller SJ,Sivarajah K,Sugden PH. ErbB receptors, their ligands, and the consequences of their activation and inhibition in the myocardium[J]. J Mol Cell Cardiol, 2008, 44: 831-854.
[6] Wang H,Zhu QW,Ye P,et al.Pioglitazone attenuates myocardial ischemia-reperfusion injury via up-regulation of ERK and COX-2[J]. Biosci Trends, 2012, 6: 325-332.
[7] Shibata R,Sato K,Pimentel DR,et al.Adiponectin protects against myocardial ischemia-reperfusion injury through AMPK- and COX-2-dependent mechanisms[J]. Nat Med, 2005, 11: 1096-1103.
[8] Li B,Xiao J,Li Y,et al.Gene transfer of human neuregulin-1 attenuates ventricular remodeling in diabetic cardiomyopathy rats[J]. Exp Ther Med, 2013, 6: 1105-1112.
[9] Zhang SW,Gao HK,Chen HH,et al.Protective effects and mechanism of simvastatin on hypoxia/reoxygenation-induced apoptosis in rat cardiomyocyte[J]. Chin Heart J, 2011, 23: 189-192. (in Chinese) 张申伟,高好考,陈江红,等. 辛伐他汀对缺氧/复氧诱导的心肌细胞凋亡的拮抗作用及其作用机制[J]. 心脏杂志, 2011, 23: 189-192.
[10] Li J,Zhang H,Wu F,et al.Insulin inhibits tumor necrosis factor-alpha induction in myocardial ischemia/reperfusion:role of Akt and endothelial nitric oxide synthase phosphorylation[J]. Crit Care Med, 2008, 36: 1551-1558.
[11] Lamendola P,Di Monaco A,Barone L,et al.Mechanisms of myocardial cell protection from ischemia/reperfusion injury and potential clinical implications[J]. G Ital Cardiol (Rome), 2009, 10: 28-36.
[12] Brutsaert DL.Cardiac endothelial-myocardial signaling: its role in cardiac growth, contractile performance, and rhythmicity[J]. Physiol Rev, 2003, 83: 59-115.
[13] Wei L,Sun D,Yin Z,et a1.A PKC-beta inhibitor protects against cardiac microvascular ischemia reperfusion injury in diabetic rats[J]. Apoptosis, 2010, 15: 488-498.
[14] Gao YL,Si R,Dang JY,et a1.Insulin protects cardiac microvascular endothelial cells against IR injury ,the key role of survivin[J]. Chin J Geriatr Heart Brain Vessel Dis,2012, 14: 186-190. (in Chinese) 高砚丽,司瑞,党晶艺,等. 生存素在胰岛素抑制大鼠心肌微血管内皮细胞缺血再灌注损伤中的关键作用[J]. 中华老年心脑血管病杂志, 2012, 14:186-190.
[15] Dang JY,Zuo HR,Jiang N,et a1.Protective efects of des-aspartate-angiotension-I against cardiac microvascular endothelial cell injury induced by ischemia/reperfusion[J]. Chin J Card iovasc Med, 2013,18:125-129. (in Chinese) 党晶艺,左惠荣,蒋娜,等. 去天门冬氨酸血管紧张素Ⅰ减轻大鼠心肌微血管内皮细胞缺血/再灌注损伤[J]. 中国心血管杂志, 2013,18: 125-129.
[16] Leucker TM,Bienengraeber M,Muravyeva M,et al.Endothelial-cardiomyocyte crosstalk enhances pharmacological cardioprotection[J]. J Mol Cell Cardiol, 2011, 51: 803-811.
[17] Kuramochi Y,Cote GM,Guo X,et al.Cardiac endothelial cells regulate reactive oxygen species-induced cardiomyocyte apoptosis through neuregulin-1beta/erbB4 signaling[J]. J Biol Chem, 2004, 279: 51141-51147.
[18] Liu FF,Stone JR,Schuldt AJ,et a1.Heterozygous knockout of neuregulin-1 gene in mice exacerbates doxorubicin-induced heart failure[J]. Am J Physiol Heart Circ Physiol, 2005,289:H660-666.
(本文编辑:周白瑜)
·会议报道·
德国心血管年会会议热点研究报道(七)
ST段抬高型心肌梗死急诊介入治疗后核磁共振评估左心室射血分数及心肌瘢痕面积对预测预后的意义(作者:Julia Steiner)
背景:心脏核磁共振增强造影检查是一种无创的心脏检查,可测定左心室功能指标、分析心肌结构以及计算心肌瘢痕面积,不受检查者经验和患者身体状态的限制。现有的核磁共振研究侧重于分析常用的检查参数,但并未关注这些参数与心肌梗死患者的预后联系。ST段抬高型心肌梗死(STEMI)患者接受急诊介入治疗后,心肌结构和功能的改变是否相关,对判断预后是否有意义,至今尚不明确。本研究将STEMI患者上述参数进行了大规模多中心研究,将这些参数对预后的影响进行分析。
方法:本研究纳入德国3个大型心脏治疗中心,STEMI并行急诊冠状动脉介入治疗的390例患者。患者在冠状动脉介入术后及心肌梗死后4个月接受了增强核磁共振扫描。测量LVEF、左心室收缩/舒张末期容积及心肌瘢痕占左心室面积的比例,随访36个月,分析上述数据和患者预后的关系。
结果:STEMI急诊介入治疗术后立即进行的心脏核磁共振显示平均LVEF为(51.1±12.0)%,心肌梗死瘢痕占左心室面积的(19.8±13.0)%。4个月随访核磁共振显示LVEF升高到(54.4±13.0)%(P<0.001),心肌瘢痕占左心室面积比例明显减小到(16.8±12.0)%(P<0.001)。功能(LVEF)和结构(瘢痕面积)的改变之间存在相关性(r=-0.416,P=0.004)。36个月的随访期内有8例患者死亡(2.1%)和15例患者(3.8%)因失代偿性左心衰竭入院治疗。随访期间发生主要心血管不良事件(MACE)的患者在4个月LVEF没有明显的改善(0.9±13)%,心肌瘢痕也没有明显的缩小(-2.6±24)%。而没有发生MACE的患者LVEF增加了(8.0±18)%,心肌瘢痕缩小了(14.2±36)%。Kaplan-Meier生存分析也证实了STEMI后4个月心肌瘢痕持续大于4.76%和LVEF没有明显恢复的患者,3年内MACE的发生率较高。风险分析显示,STEMI后4个月的心肌瘢痕面积无明显减少是发生MACE的重要危险因素(HR=4.32,P=0.001),LVEF的改变(HR=0.63,P=0.377)和STEMI后CK的最高值(HR=1.29,P=0.029)都不是影响预后的重要因素。
讨论:STEMI患者急诊介入治疗后首日和4个月后进行核磁共振检查显示,LVEF改变和心肌瘢痕面积比例改变之间不存在明显的关联。STEMI后4个月LVEF没有明显改善,心肌瘢痕没有明显缩小的患者在3年内发生MACE的风险升高。其中心肌瘢痕面积无明显减小是增加MACE发生率的重要危险因素,直接影响STEMI患者的远期预后。
本研究证明,心脏增强核磁共振造影对系统分析STEMI患者心肌结构和功能的改变,预测MACE发生和判断预后有着重要的意义。
(编译:马迎,审校:刘兵)
(本文编辑:周白瑜)
Role of neuregulin-1 released from cardiac microvascular endothelial cells in ischemia/reperfusion myocardium and its mechanism of action
HaoQimeng,SiRui,YeJin,FuZhicheng,WangChen,ShaoHong,ZhangRongqing,GuoWenyi.
DepartmentofCardiovascularDiseases,XijingHospital,FourthMilitaryMedicalUniversity,Xi′an710032,China
GuoWenyi,Email:guowenyi@tom.com
Objective To explore the effects and mechanism of neuregulin-1 (NRG-1) in rat cardiac microvascular endothelial cells (CMECs)-cardiomyocytes coculture, during ischemia/reperfusion injury. Methods Cardiac myocytes were isolated from the hearts of neonatal rats and CMECs from the adult rats. CMECs-cardiomyocytes coculture model was established. Then cells were endured simulated I/R(4 h/4 h). Collected CMECs culture medium during SI/R. The cell viability of cardiomyocytes was measured by MTT assay. The apoptosis of cardiomyocytes was detected by TUNEL method. The expression of secreted NRG-1 in CMECs culture medium, phosphorylation of ErbB2 and ERK and COX-2 in cardiac myocytes were analyzed by Western blot. Measured Caspase-3 activity reflected the apoptosis of cardiomyocytes. ResultsThe cardiomyocytes viability was impaired in the SI/R (4 h/4 h) group (P<0.01) while increased in the SI/R+Coculture group (P=0.02). Within the groups of CMECs, the secretion of NRG-1 was remarkable increased in the time of 4 h/4 h under SI/R(P<0.01) when compared with the Control group. Within the groups of cardiomyocytes, the apoptosis index and Caspase-3 activity were increased after SI/R when compared with the Control group (27.97±0.90vs. 3.58±0.23,P<0.01; 375.93±11.76vs. 100.00±0.00,P<0.01). While trained with Coculture or NRG-1 during SI/R could reduce the apoptosis index and Caspase-3 activity when compared with the SI/R group(16.82±1.03vs. 27.97±0.90,P<0.01;166.16±15.15vs. 375.93±11.76,P<0.01). Besides, they can significant up-regulate the level of phosphorylation of ErbB2 and ERK and the expression of COX-2 (P<0.01vs. Control and SI/R). However, when cardiomyocytes were pretreated with ErbB2 or ERK1/2 inhibitor, the effect of Coculture and NRG-1 vanished (P<0.01). Conclusions The process of I/RI, the secretion of NRG-1in CMECs protect cardiomyocytes against ischemic reperfusion injury through up-regulation of pErbB2, pERK and COX-2.
Ischemia/reperfusion injury; NRG-1; Cardiomyocytes; CMECs; Apoptosis
10.3969/j.issn.1007-5410.2015.03.011
国家自然科学基金(81070126)
710032 西安,第四军医大学西京医院心内科
郭文怡,电子邮箱:guowenyi@tom.com
2014-12-15)
ThisworkwassupportedbyagrantfromtheNationalNaturalScienceFoundationofChina(No.81070126)

