列腺素E1降低心脏瓣膜置换术患者心肌细胞NF-κB活性及血浆TNF-α水平*
张文斌,朱成均,石 泉,赵振海
(桂林医学院附属医院麻醉科,广西桂林541001)
心脏瓣膜置换术后常伴有黏附分子的消耗及炎性因子的级联释放,导致心肌发生炎性反应,出现心肌细胞损伤、凋亡和坏死[1]。核转录因子κB(nuclear factor-κB,NF-κB)是调节基因转录的关键因子,广泛存在于心肌细胞和血管内皮细胞等各种细胞内,主要参与机体防御功能及炎性反应有关的早期应答因子如肿瘤坏死因子-α(TNF-α)、IL-6及IL-8等的表达调控[2]。研究表明,前列腺素E1(prostaglandin E1,PGE1)可通过调节炎性因子水平,抑制炎性反应[3-4]。本研究拟观察PGE1对心脏瓣膜置换术患者心肌细胞NF-κB活性及血浆TNF-α水平的影响,以阐明其减轻心脏瓣膜置换术心肌损伤的机制。
1 资料与方法
1.1 一般资料 选择2012年2月至2013年4月,在本院择期行体外循环下心脏瓣膜置换术的患者40例,男23例,女17例,年龄32~67岁,体质量指数17~28kg/m2,美国麻醉师协会(ASA)分级Ⅱ或Ⅲ级,纽约心脏病协会(NYHA)分级Ⅱ或Ⅲ级,左室射血分数大于或等于30%,无高血压、冠心病和糖尿病病史,无心脏手术史。采用随机数字表法,将患者随机分为2组(n=20):对照组(C组)和PGE1组(P组)。两组患者的年龄、性别比、体质量指数、ASA 分级、体外循环时间、主动脉阻断时间和手术时间差异无统计学意义(P>0.05),具有可比性。本研究已获本院医学伦理委员会批准,并与患者签署知情同意书。
1.2 方法
1.2.1 麻醉和体外循环 麻醉前30min肌肉注射东莨菪碱0.3mg。入室后监测心电图(ECG)、血压(BP)和血氧饱和度(SpO2)。建立外周静脉通道。静脉注射咪达唑仑0.1~0.3 mg/kg、芬太尼8~10μg/kg和依托咪酯0.3 mg/kg麻醉诱导,待患者睫毛反射消失后静脉注射维库溴铵0.12 mg/kg。气管插管后行机械通气,潮气量8~10mL/kg,通气频率10~12 次/min,维持PETCO235~45mm Hg。行左侧桡动脉及右侧颈内静脉穿刺置管,分别用于监测平均主动脉压(MAP)和中心静脉压(CVP)。静脉输注咪达唑仑0.5~1.0μg·kg-1·min-1,芬太尼0.1~0.2μg·kg-1·min-1和维库溴铵0.8~1.2μg·kg-1·min-1维持麻醉,维持心率和血压平稳,使其波动幅度不超过基础值的20%。常规建立体外循环,中度血液稀释(红细胞压积为0.20~0.25),中心体温降至28 ℃,体外循环期间MAP维持在50~80mm Hg,心肌保护采用间断正向灌注冷血高钾心脏停搏液(氯化钾浓度为20mmol/L),方法同文献[4]。患者术后送返监护室,于循环稳定、自主呼吸恢复并稳定,且动脉血气分析无异常后拔除气管导管。
表1 两组患者不同时点血浆TNF-α水平的比较(±s,μg/L,n=20)

表1 两组患者不同时点血浆TNF-α水平的比较(±s,μg/L,n=20)
aP<0.01,与T0 比较;b P<0.05,与C组比较。
组别 T0 T1 T2 T3 T 4 C组 6.57±2.28 54.33±18.98a 94.64±23.16a 135.44±32.76a 115.67±29.68 a P组 7.21±1.94 37.25±14.65ab 72.18±20.55ab 102.54±27.37ab 87.49±22.57 ab
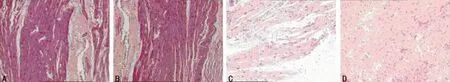
图1 两组患者不同时点心肌组织病理学变化的比较(HE×100)
1.2.2 干预方法 P组在麻醉诱导后静脉输注PGE1(北京泰德制药股份有限公司,国药准字:H10980024,产品批号:2011H)20ng·kg-1·min-1,直至手术结束;C 组给予等容量生理盐水。
1.2.3 ELISA 检测血浆TNF-α水平 于体外循环前(T0,基础值),体外循环开始后30min(T1),体外循环结束时(T2),体外循环结束后12h(T3)、24h(T4)抽取动脉血3mL,即刻在4℃下以3 000r/min离心10min,取上清液,置入-80 ℃冰箱内保存待测血浆TNF-α水平。采用双抗体夹心ELISA 法测定TNF-α水平,试剂盒来自美国Santa Cruz公司。
1.2.4 蛋白免疫印迹法(Western blot)检测右心耳组织NFκB的活性 于T0和T2时剪取未被钳夹或结扎的右心耳组织,分为2份。第1份立即浸入10%甲醛溶液固定,常规石蜡包埋、切片,行苏木素-伊红(HE)染色观察心肌细胞形态学变化。第2份用液氮冷冻后-80℃保存,采用Western blot检测NF-κB的表达:将心肌组织均浆后提取心肌蛋白,Lowry法测定蛋白含量。取100μg心肌蛋白置于12.5%十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)进行电泳,湿转至聚偏氟乙烯(PVDF)膜,膜在封闭液中室温作用3h。再加入小鼠NFκB抗体,4 ℃孵育过夜,用TBST 缓冲液冲洗15 min,共3次后,加入二抗羊抗兔IgG,室温摇动孵育1h,再用TBST 缓冲液充分冲洗,最后进行增强化学发光反应。将PVDF 膜上显影的条带扫描入电脑,结合图像分析软件分析NF-κB的表达,以β-肌动蛋白(β-actin)为内参照。
1.3 统计学处理 采用SPSS13.0软件进行统计分析,计量资料以±s表示,组间比较采用成组t检验,组内比较采用重复测量设计的方差分析,计数资料比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 两组患者不同时点血浆TNF-α水平的比较 与T0比较,两组血浆TNF-α水平T1时开始升高(P<0.05),T3时达峰值(P<0.05),差异有统计学意义;与C组比较,P组在T1~T4时点血浆TNF-α水平明显下降(P<0.05),差异有统计学意义。见表1。
2.2 两组患者不同时点心肌组织病理学变化的比较 T0时两组心肌结构基本正常,心肌细胞排列整齐,细胞核清晰,少见炎性细胞。T2时C组心肌细胞肿胀,排列紊乱,大量肌原纤维断裂,并可见大量淋巴细胞和中性粒细胞等炎性细胞浸润,未见明显细胞坏死及间质纤维化;T2时P组心肌细胞轻度肿胀,部分肌原纤维断裂,排列略紊乱,淋巴细胞和中性粒细胞等炎症细胞浸润较少,病理学改变明显轻于C组。见图1。
2.3 两组患者不同时点心肌细胞NF-κB活性的比较 与T0比较,T2时两组心肌细胞NF-κB活性明显升高(P<0.05);与C组比较,T2时P 组心肌细胞NF-κB 活性明显下降(P<0.05)。见图2,表2。
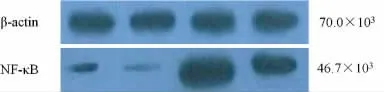
图2 Western blot检测两组患者不同时点心肌细胞NF-κB活性
表2 两组患者不同时间点心肌细胞NF-κB表达 的比较(±s,%,n=20)

表2 两组患者不同时间点心肌细胞NF-κB表达 的比较(±s,%,n=20)
a:P<0.05,与T0 比较;b:P<0.05,与C组比较。
组别 T0 T 2 C组 17.6±5.5 92.4±12.7 a P组 18.7±5.2 85.4±13.4 ab
3 讨 论
心脏瓣膜置换术造成心肌细胞损伤的原因,除心内操作所致的机械损伤和心肌缺血再灌注损伤外,心肌炎性反应也是其中重要的因素[1]。在心脏瓣膜置换术中采用有效的心肌保护措施,已成为心脏外科的研究热点。
PGE1是一种有效的血管扩张剂,既往主要用于肺动脉高压的治疗[5],随着临床研究的深入,多数学者发现PGE1具有稳定生物膜、抑制中性粒细胞活性、减轻脂质过氧化反应和缺血再灌注损伤等作用。有研究发现,PGE1可靶向扩张病变血管,升高细胞内cAMP 水平,减少血栓素A(TXA)合成,可以抑制神经末梢释放去甲状腺肾上腺素,抑制血小板聚集,防止凝血因子大量释放导致的血栓形成。它可以抑制氧自由基的活化与迁移,可以增加超氧化物歧化酶(SOD)的含量,防止组织内缺血再灌注损伤的发生;它可以通过降低血浆内皮素、保护血管内皮细胞[6],显著降低炎症细胞介质因子,防止全身炎症反应综合征(SIRS)的发生,降低多器官损伤的可能,升高细胞内cAMP,激活腺苷酸环化酶,抑制TNF-α的释放。PGE1之所以能够减少促炎症介质的释放主要与其能够抑制炎症介质或因子等相关基因的表达有关,还与增加组织溶酶体酶与cGMP的释放作用有关[7]。此外,它可能是通过抑制巨噬细胞产生TNF-α而导致炎症细胞因子表达降低。大剂量的PGE1有明显的降压作用,而Nacije等[8]证实小剂量持续应用时(输注浓度小于或等于40ng·kg-1·min-1)时,对体循环血压无明显影响。因此,本研究选用20ng·kg-1·min-1静脉输注,实验过程中未见与PGE1相关的血压波动。
NF-κB在心功能下降、心肌炎性反应及心肌细胞凋亡等病理生理过程中发挥重要作用[9]。正常生理情况下,NF-κB与其抑制物IκB结合,以无活性的状态存在于细胞质内,当细胞受到外界信号刺激后,IκB和NF-κB解离,游离的NF-κB快速进入细核内,与靶基因κB位点结合,迅速诱导靶基因的转录,上调TNF-α、IL-6 和IL-8 等 多 种 炎 症 因 子 水 平,加 重 细 胞 损伤[10]。李欣等[11]的临床研究显示,心肌损伤可使患者体内NF-κB激活,NF-κB活性在心肺复苏后多脏器功能障碍综合征组和死亡组明显高于存活组。在本实验中,麻醉诱导后静脉PGE1 20ng·kg-1·min-1至手术结束相较于诱导后静脉给予生理盐水在手术结束时心肌细胞的NF-κB 活性明显降低。因此作者推测输注PGE1 可能通过介导NF-κB的下调在体外循环中起到心肌保护的作用。
细胞炎症因子(如TNF-α、IL-6和IL-8等)的水平可反映炎性反应的剧烈程度[12]。TNF-α是一种关键的炎性介质,在炎性级联反应中起主导作用,其主要由巨噬细胞以自分泌形式产生,但缺血心肌细胞本身也可产生TNF-α,加重心肌炎性反应,造成心肌损伤[13]。TNF-α通过中性粒细胞依赖性和非中性粒细胞依赖性机制,导致血管通透性增加[14]。TNF-α介导中性粒细胞聚集,可能是通过促进中性粒细胞和内皮细胞上黏附分子表达上调,促进ICAM1表达和E-选择素内皮表达[15],介导多形核中性粒细胞与内皮细胞之间黏附,上调中性粒细胞糖蛋白黏附分子和它们的内皮配位子,使其游动黏附内皮,激发中性粒细胞及其他炎性细胞释放大量损伤介质,导致中性粒细胞发生氧化爆发、脱颗粒,引起血管和组织损伤。在本实验中,麻醉诱导后静脉输注PGE1 20ng·kg-1·min-1至手术结束相较于诱导后静脉给予生理盐水在体外循环后30 min、手术结束时及其手术后12h血浆内的TNF-α表达水平明显降低。因此推测输注输注PGE1 可能引起体外循环过程中机体内血浆TNF-α的表达降低,进而减少炎性反应的发生,从而起到心肌保护的作用。
心肌组织病理学结果显示,与C 组比较,P 组心肌组织结构破坏较轻,炎性细胞浸润较少,心肌细胞受损程度相对较轻。本研究结果还显示,心脏瓣膜置换术可升高心肌细胞NF-κB活性及血浆TNF-α水平,但P组各时点NF-κB活性和TNF-α水平均明显低于C 组,说明PGE1可抑制心肌细胞NF-κB 活性,减少血浆TNF-α水平,从而减轻心肌损伤。
综上所述,PGE1可减轻心脏瓣膜置换术患者心肌损伤,其机制可能与抑制心肌细胞NF-κB 活性,减少血浆TNF-α水平有关。但前列腺素E1可引起NF-κB 表达变化的上游通路靶点以及NF-κB表达与血浆TNF-α表达水平是否存在相关性还有待进一步的研究。
[1] Siepe M,Goebel U,Mecklenburq A,et al.Pulsatile pulmonary perfusion during cardiopulmonary bypass reduces the pulmonary inflammatory response[J].Ann Thorac Surg,2008,86(1):115-122.
[2] Qiao S,Xie H,Wang C,et al.Delayed anesthetic preconditioning protects against myocardial infarction via activation of nuclear factor-κB and upregulation of autophagy[J].J Anesth,2013,27(2):251-260.
[3] 洪文娟,黄韬,洪志鹏,等.前列腺素E1对移植肺的保护作用及其机理[J/CD].中华肺部疾病杂志:电子版,2012,5(5):404-407.
[4] 涂杰,张炳东,吕静,等.氨甲环酸对发绀型先天性心脏病患儿的血液保护效果[J].实用儿科临床杂志,2011,26(23):1793-1795.
[5] Buckley MS,Feldman JP.Inhaled epoprostenol for the treatment of pulmonary arterial hypertension in critically ill adults[J].Pharmacotherapy,2010,30(7):728-740.
[6] 赵飞,陈亮,甄福喜,等.前列腺素E 在体外循环中调控炎症反应及肺保护作用的研究[J].南京医科大学学报(自然科学版),2007;27(8):864-866.
[7] 何非方,李利,钟泰迪,等.前列腺素E 预处理拮抗出血性休克复苏后大鼠急性肺伤[J].中国病理生理杂志,2009,25(3):604-606.
[8] Nacije R,Melot C,Mols P,et al.Reduction in pulmonary hypertension by prostaglandin E1in decompensated chronic obstructive pulmonary disease[J].Am Rev Respir Dis,1982,125(1):1-5.
[9] Kumar R,Yong QC,Thomas CM.Do multiple nuclear factor kappa B activation mechanisms explain its varied effects in the heart?[J].Ochsner J,2013,13(1):157-165.
[10] Sirlak M,Akar AR,Eryilmaz S,et al.Micronized purified flavonoid fraction in pretreating CABG patients[J].Tex Heart Inst J,2010,37(2):172-177.
[11] 李欣,荆小莉,熊艳,等.核因子κB 活性在心肺脑复苏后的变化[J].中华急诊医学杂志,2006,1(15):19-22.
[12] Zhou W,Zeng D,Chen R,et al.Limb ischemic preconditioning reduces heart and lung injury after an open heart operation in infants[J].Pediatr Cardiol,2010,31(1):22-29.
[13] Giacco F,Brownlee M,Circ R.Oxidative stress and diabetic complications[J].Circ Res,2010,107 (9):1058-1070.
[14] Grifin GK,Newton G,Tarrio ML,et a1.IL-17and TNF-α sustain neutrophil ecruitment during inflammation through synergistie effects on endothelial aetivation.JIm-munol,2012,188:6287-6299.
[15] Huang X,Wang F,Chen W,et a1.Dao-Tan decoction inhibits tumor ecrosisfactor-α-induced intercellular adhesion molecule-1xpression by blocking JNK and p38signaling pathways in humanumbilical vein endothelial cells[J].Pharm Bio1,2012,50(9):1111-1117.

