大鼠髁突软骨在髁突颈骨折和截骨致异常应力下的超微结构改变*
陈建中,杨 春,刘春雷,朱房勇,胡 瑜,李 松△
(1.昆明医科大学口腔医学院,云南昆明650031;2.云南文山州医院口腔科,云南文山663000;3.江苏省无锡市第三人民医院口腔科,江苏无锡214021)
髁突软骨在生长发育中受到各种形式应力的作用,这些生物力对髁突软骨的生长发育及病理改变起着重要的作用[1-8]。目前关于应力改变在体内对髁突软骨超微结构影响的研究报道不多,本实验通过建立年轻大鼠髁突颈部截骨及骨折动物模型,造成体内应力改变的程度不同,利用扫描电镜(SEM)及透射电镜(TEM)观察髁突软骨组织在术后不同时间点的超微结构变化,进一步探索应力变化对髁突软骨影响的机制及其生理、病理意义。
1 材料与方法
1.1 动物与材料 选择4 周龄雄性SD 大鼠54只(昆明医科大学动物试验中心),体质量(149±3)g。镊子、单面刀片、毛笔、日立SD450型SEM、日立H2600型TEM。
1.2 方法
1.2.1 分组 分为3 组:截骨组(右侧),骨折组(右侧),空白对照组(右侧)。
1.2.2 髁突颈骨折及截骨的动物模型建立 用1%戊巴比妥钠行大鼠腹腔注射实施全身麻醉。大鼠右侧耳前1cm 切口,切开皮肤、皮下组织,从颞肌、咬肌及外耳道之间凹陷处进入,钝性剥离暴露髁突颈部,截骨组用自制血管钳横行截除髁突颈部分软骨,髁突颈骨折组用眼科剪剪断髁突颈,分层缝合创口。术后2d内喂以精细食物,再进行2d精细物与常规饲料的混合喂养,之后恢复常规饲料饲养。分别于术后1、3、5周时处死SD 大鼠;分成3部分,分别用苏木素-伊红(HE)染色、SEM 及TEM 观察。于截骨组手术侧(右侧)、骨折组手术侧(右侧)、对照组(右侧)取下髁突软骨。
1.2.3 HE 染色 4%多聚甲醛固定液固定24h。在20%甲酸中脱钙(约18h),常规脱水、透明、浸蜡包埋,制备4μm 厚石蜡切片,HE染色,光镜观察。
1.2.4 SEM 观察 样品用0.1mol/L 磷酸缓冲液(pH7.2)冲洗3次,每次15s。4%多聚甲醛4 ℃条件下固定72h。将标本置于30%~100%乙醇逐级脱水,其中30%乙醇1次,每次10min,100%乙醇2 次,每次10 min,纯乙酸异戊酯处理,CO2临界点干燥,离子溅射,日立SD450型SEM 观察。
1.2.5 TEM 观察 样品在2.5%的戊二醛溶液中4 ℃固定过夜,磷酸缓冲液漂洗样品3次,每次15min;10mL/L锇酸再固定后,脱水,丙酮置换,环氧树脂618包埋,切片机切片,日立H2600型TEM 观察。
2 结 果
2.1 大体标本观察 实验组(截骨组、骨折组)与空白对照组大鼠体质量差异无统计学意义(P>0.05),实验中各组大鼠无意外死亡,截骨组术后3周髁突头呈缩小趋势,术后5、9周髁突变窄而高,呈现缩小趋势。骨折组术后3、5、9周,髁突呈缩小趋势,但缩小程度较截骨组小。
2.2 光镜结果 髁突从外至内分为纤维层、增殖层、成软骨细胞层及肥大细胞层。术后3、5周,截骨组及骨折组总厚度均小于空白对照组,术后3周截骨组手术侧更多的形成软骨下骨组织。见图1。
2.3 SEM 观察结果 空白对照组髁突软骨表面呈波纹状结构,上散布颗粒状物质。随着鼠龄的增大,颗粒状物质减少,波纹状结构紊乱,但表面光滑,凝胶状物质覆盖完整。骨折组术后1周,髁突软骨表面波纹状形态不明显,颗粒状物质相比于同龄空白对照组减少。术后3周,表面波纹状形态不明显,少部分区域凝胶状物质消失,深层胶原纤维暴露。术后5周,颗粒状物质消失,表面波纹状形态不明显,凝胶状物质消失,深层胶原纤维暴露,但未出现纤维断裂。截骨组术后1周,髁突软骨表面波纹状形态紊乱,颗粒状物质相比于空白对照组减少,凝胶状物质覆盖完整。术后3周,大部分区域凝胶状物质消失,多处深层胶原纤维暴露。术后5周,颗粒状物质消失,深层胶原纤维广泛暴露,并有纤维断裂、崩解。见图2。
2.4 TEM 观察结果 骨折组术后3周,纤维层可见到裂隙及空泡样变,胶原纤维断裂。截骨组术后1周,纤维细胞层排列更为稀疏,表面纤维排列紊乱甚至缺失。术后3周,胶原排列紊乱,软骨细胞较空白对照组成熟分化更为明显。术后5周,胶原纤维排列更为紊乱,纤维层中可见到裂隙。空白对照组在纤维层未见到裂隙及纤维排列紊乱。见图3。
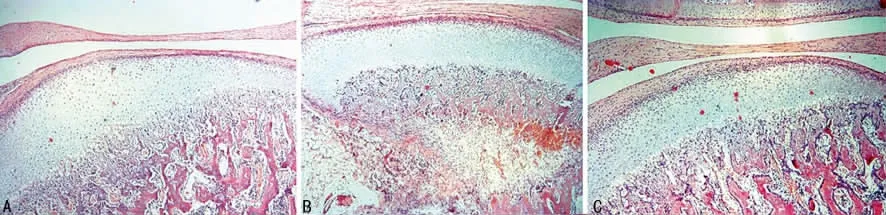
图1 髁突软骨的光镜结果(×100)
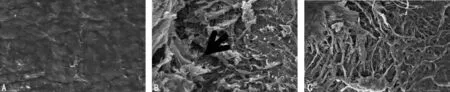
图2 髁突软骨的SEM 观察结果

图3 髁突软骨的TEM 观察结果
3 讨 论
髁突软骨作为下颌骨重要的生长区,在髁突与下颌骨的生长发育中起着非常重要的作用。髁突软骨与四肢生长板软骨不同,为纤维软骨,成骨方式为软骨内成骨。在软骨生长发育过程中,关节软骨在受到各种类型的应力后,引起软骨一系列的物理、化学变化,进而引起软骨细胞的生理活动的变化。
正常的颞颌关节髁突表面覆盖有一层厚约2μm 的凝胶样物质,此物质来源于关节滑液,由滑膜B 细胞产生,被认为是关节健康标志。当滑液的润滑功能被破坏或软骨表层胶原纤维暴露时,关节内摩擦系数将升高[9],久之将会破坏关节健康。本实验通过建立大鼠髁突颈部骨折及截骨的动物模型模拟作用于髁突的异常应力模型,SEM 观察到髁突骨折及截骨组在术后3周均有胶原纤维暴露,截骨组在术后5周见到胶原纤维断裂,且两组均有凝胶样物质的消失。TEM 也观察到术后3周,骨折组见胶原纤维断裂,而截骨组术后5周,纤维层中可见到裂隙。在空白对照组中,纤维层未见到裂隙及纤维排列紊乱。SEM 及TEM 均观察到胶原纤维排列紊乱或断裂,与国内一些学者观察结果相似。傅开元等[10]通过建立牙合创伤的动物模型,观察到创伤组3、5个月组的髁突软骨均可见明显的退行性改变,最表面的覆盖物脱落,胶原纤维排列松散、断裂。黄洋等[11]建立偏侧咀嚼动物模型,发现偏侧咀嚼一段时间后髁突表面凝胶状物质不完整,胶原纤维松解、断裂及暴露。一些学者认为胶原纤维的暴露可能是软骨变性的开始,而当关节出现不平衡运动时,纤维可能松解、裂隙甚至断裂[12],这与本实验结果相符,截骨组手术侧纤维层出现裂隙及胶原断裂可能与截骨导致应力改变更为明显有关。此外,胶原纤维松解断裂,暴露于关节腔,软骨内蛋白多糖和胶原纤维等大分子进入关节腔,可能成为抗原而刺激机体引发局部的免疫反应,使软骨组织受到破坏。同时,随着应力的改变,术后3周截骨组手术侧软骨细胞成熟分化能力较空白对照组增强,更多的软骨细胞加速钙化形成骨组织,提示应力变化影响软骨细胞的成熟分化。Chen等[13]通过髁突软骨细胞体外培养,施加不同应力,观察到当施加静压力90kPa 60min时,细胞体积变大,粗面内质网膨胀。而当施加时间为360min时,则出现凋亡小体。张旻等[14]也发现对髁突软骨细胞施加90kPa的应力6h后细胞部分出现明显的细胞凋亡指征。此外,Sharawy等[15]建立兔关节盘前移位动物模型,观察到软骨细胞凋亡增加及软骨细胞基质中胶原类型的改变,提示不同的应力会影响软骨细胞的凋亡及基质的结构,本实验中未见到明显的凋亡小体,可能与观察面积局限,而髁突软骨细胞凋亡未广泛分布所致。
以上研究表明异常的应力作用于髁突软骨,会引起软骨表面胶原纤维结构的改变,且随应力改变程度不同而不同,纤维结构的变化使髁突表层容易受磨耗。同时手术侧髁突软骨细胞更多的成熟分化为骨组织,使软骨细胞数目减少。单独或二者联合的结果使手术侧髁突形状变小。同时,随着时间延长,手术侧髁突未观察到明显的修复发生,手术侧髁突体积随着时间未能恢复正常,提示在髁突的生长发育期内,由骨折等外伤原因引起的异常应力可能会对髁突的超微结构产生一定的损害,影响髁突的形状,进而影响颌面部的形态及功能。此外,由于电镜技术本身的限制,有关形态变化与髁突软骨细胞功能的关联有待于结合其他研究方法和手段进一步深入研究。
[1] 吴拓江,许跃,李煌,等.不对称性颌间牵引作用下BMP2在成年SD 大鼠髁突关节下骨中的表达[J].口腔医学研究,2010,36(3):349-352.
[2] 朱房勇,陈玉华,李国民,等.SD 大鼠单侧髁突颈横行截骨、骨折致下颌骨偏斜的研究[J].重庆医学,2013,(19):2191-2193.
[3] Hu Y,Yang HF,Li S,et al.Condyle and mandibular bone change after unilateral condylar neck fracture in growing rats[J].Int J Oral Maxillofac Surg,2012,41(8):912-921.
[4] Gredes T,Mack H,Spassov A,et al.Changes in condylar cartilage after anterior mandibular displacement in juvenile pigs[J].Arch Oral Biol,2012,57(6):594-598.
[5] Jahan E,Matsumoto A,Rafiq AM,et al.Fetal jaw movement affects Ihh signaling in mandibular condylar cartilage development:the possible role of Ihh as mechanotransduction mediator[J].Arch Oral Biol,2014,59(10):1108-1118.
[6] Magara J,Nozawa-Inoue K,Suzuki A,et al.Alterations in intermediate filaments expression in disc cells from the rat temporomandibular joint following exposure to continuous compressive force[J].J Anat,2012,220(6):612-621.
[7] Sobue T,Yeh WC,Chhibber A,et al.Murine TMJ loading causes increased proliferation and chondrocyte maturation[J].J Dent Res,2011,90(4):512-516.
[8] Zhang M,Chen FM,Chen YJ,et al.Effect of mechanical pressure on the thickness and collagen synthesis of mandibular cartilage and the contributions of G proteins[J].Mol Cell Biomech,2011,8(1):43-60.
[9] Tanaka E,Iwabe T,Dalla-Bona DA,et al.The effect of experimental cartilage damage and impairment and restoration of synovial lubrication on friction in the temporomandibular joint[J].J Orofac Pain,2005,19(4):331-336.
[10] 傅开元,马绪臣,张震康,等.创伤致家兔颞下颌关节滑膜和软骨超微结构的改变[J].中华口腔医学杂志,1998,33(1):18-20.
[11] 黄洋,陈远萍,倪雪岩,等.偏侧咀嚼大鼠髁突组织学及嚼肌超微结构的研究[J].口腔医学研究,2003,19(4):277-279.
[12] 韩传火,李金荣,赵怡芳.髁状突软骨纤维组织的超微结构观察[J].口腔医学研究,2003,19(5):368-370.
[13] Chen YJ,Zhang M,Wang JJ.Study on the effects of mechanical pressure to the ultrastructure and secretion ability of mandibular condylar chondrocytes[J].Arch Oral Biol,2007,52(2):173-181.
[14] 张旻,王美青,王景杰.压力对髁突软骨细胞超微结构及可聚蛋白多糖分泌的影响[J].医用生物力学,2004,19(2):69-73.
[15] Sharawy M,Ali AM,Choi WS,et al.Ultrastructural characterization of the rabbit mandibular condyle following experimental induction of anterior disk displacement[J].Cells Tissues Organs,2000,167(1):38-48.

