JSI-124抑制STAT3通路阻滞食管癌Eca-109细胞增殖的研究
崔 凯,朱 涛△,王 竞,张 涛,李小飞
(1.第四军医大学唐都医院胸腔外科,西安 710038; 2.南京军区总医院肿瘤科,南京 210002)
JSI-124抑制STAT3通路阻滞食管癌Eca-109细胞增殖的研究
崔凯1,朱涛1△,王竞2※,张涛1,李小飞1
(1.第四军医大学唐都医院胸腔外科,西安 710038; 2.南京军区总医院肿瘤科,南京 210002)
摘要:目的采用葫芦素(JSI-124)阻断信号转导及转录激活因子3(STAT3)信号通路传导后,观察其对人食管癌Eca-109细胞增殖的影响。方法不同浓度的JSI-124(0、0.6、1.2、2.5、5.0 μmol/L)处理Eca-109细胞后,利用CCK-8法检测细胞增殖水平、逆转录-聚合酶链反应法检测STAT3及下游细胞周期蛋白D1转录水平的表达、Western blot法检测食管癌Eca-109细胞中STAT3和抗凋亡因子bcl-2的表达以及使用流式细胞仪技术检测细胞的凋亡率的变化。结果在Eca-109细胞中,经JSI-124处理的Eca-109细胞中,STAT3的活化水平明显降低;同时随着JSI-124抑制浓度(0、1.2、2.5、5.0μmol/L)的增加,Eca-109细胞的总凋亡率也随之增加(3.52%、19.26%、39.89%、55.22%)(P<0.05)。结论JSI-124 作为STAT3的选择性抑制剂,可显著抑制食管癌Eca-109细胞的增殖并促进细胞的凋亡。
关键词:食管癌;葫芦素;信号转导及转录激活因子3;增殖;凋亡
转录因子信号转导及转录激活因子(signal transduction and activator of transcription,STAT)家族的重要成员STAT3是表皮生长因子受体 (epidermal growth factor receptor,EGFR)下游重要通路JAK-STAT3的关键点[1]。STAT3基因的异常活化可使下游抗凋亡相关蛋白Bcl-2与增殖相关因子细胞周期蛋白D1等表达改变,进而促进肿瘤细胞的异常增殖和肿瘤的恶性转化[2]。葫芦素(cucurbitacin-I,JSI-124)是STAT3的抑制剂,但对其他信号通路中如蛋白激酶B和细胞外调节蛋白激酶等相关因子无特殊影响。它抑制STAT3酪氨酸磷酸化形成p-STAT3(第705位酪氨酸磷酸化位点),抑制STAT3形成二聚体,阻断信号转导,且体内外未有明显毒性现象出现[3]。目前报道指出,在某些类型的癌细胞的中,JSI-124对肿瘤的生长具有良好的抑制效用[4-5],但其在食管癌中的报道少见,提示JSI-124未来在食管癌中有较强的研究前景。本研究以人食管癌Eca-109细胞为研究对象,探讨JSI-124抑制STAT3后对食管癌增殖水平及凋亡水平的影响,为临床应用提供相关实验依据。
1材料与方法
1.1试剂与仪器胰蛋白酶(Gibco公司,德国),胎牛血清(Hyclone公司,美国),CCK-8(Dojindo公司,日本),JSI-124(Calbiochem公司,美国);一抗总STAT3、p-STAT3(Tyr705)、甘油醛-3-磷酸脱氢酶(GADPH)(Cell Signaling Technology公司,美国),Bcl-2抗体(Santa Cruz公司,美国),二抗(Jackson公司,美国);Trizol试剂(Invitrogen公司,美国),逆转录聚合酶链反应试剂盒(TaKaRa公司,日本);所有引物均购自上海生工生物工程技术服务有限公司;AnnexinV-EGFP 细胞凋亡检测试剂盒(武汉博士德生物工程有限公司)。JSI-124由二甲基亚砜(上海伟进生物科技有限公司生产)稀释到所需工作浓度。 主要实验仪器:紫外分光光度计(UV1800 日本岛津),PCR仪(MJ Mini PCR,美国Bio-Rad),流式细胞仪(COULTER EPICS XL,美国Beckman Coulter)。
1.2细胞培养冻存状态的食管癌Eca-109细胞自液氮中取出,迅速置于37 ℃水浴中,使其尽快全部融化(慢冻快融);无菌条件下将解冻后的细胞转移至离心管内,以离心半径3 cm,1000 r/min离心5 min,弃上清,加入2 mL培养液(含20% 胎牛血清; pH 7.2~7.4)混匀;将细胞悬液滴入培养瓶内,加入4 mL培养液,放入37 ℃恒温培养箱内孵育(含5%CO2),2~3 d传代1次。实验时取用对数生长期细胞。
1.3CCK-8法待细胞密度达到培养皿90%后制成细胞悬液,5000个/孔接种于96孔板,将粉末状JSI-124用二甲基亚砜充分溶解,配置成1000 μmol/L浓度的母液(二甲基亚砜终浓度≤0.01%),现用现配,分别给予JSI-124不同浓度(0、0.6、1.2、2.5、5.0 μmol/L),每个浓度设6个复孔,同时设调零组(仅含培养基)继续培养24、48、72 h后加入CCK-8 20 μL/孔,继续孵育2 h,测定每孔490 nm 波长处的光密度(OD)值,实验重复3次。细胞抑制率(%)=[1-(OD实验组-OD调零孔)/(OD对照孔-OD调零孔)]×100%。
1.4Western blot法经JSI-124不同浓度加入食管癌Eca-109 细胞中,用裂解液提取其总蛋白。将蛋白样品和上样缓冲液混合,100 ℃煮10 min;聚丙烯酰胺凝胶电泳将蛋白转至聚偏氟乙烯膜,封闭2 h后加入相应比例稀释的一抗,置于4 ℃;过夜后Tris-HCl缓冲盐溶液+吐温洗膜3次;加入相应比例稀释的二抗,孵育1 h;Tris-HCl缓冲盐溶液+吐温洗膜2次,Tris-HCl缓冲盐溶液溶液洗膜 1次后发光显色; Quantity one 软件进行蛋白条带的灰度值测定。实验重复3次。
1.5RT-PCR法提取Eca-109细胞的总RNA,紫外分光光度计测定总RNA在260 和280 nm处的吸光值,计算核酸浓度,将提出的总RNA溶于DEPC水。根据TaKaRa RT-PCR试剂盒说明书对STAT3上游5′-ATA GCC GCT TCC TGC AAG AG-3′,下游5′-CGT CCG TGA GAG TTT TCT GC-3′;细胞周期蛋白D1(CyclinD1)上游5′-GAG ACC ATC CCC CTG ACG GC-3′,下游5′-CTC TTC CTC CTC CTC GGC GGC-3′进行反转录和聚合酶链式反应,以GADPH上游5′-CCTTCATTGACCTCAACTA-3′,下游5′- GGAAGGCCATGCCAGTGAGC-3′为内参。于2%琼脂糖凝胶上进行PCR产物的电泳鉴定。实验重复3次。
1.6流式细胞仪法收集处于对数生长期的Eca-109细胞经JSI-124不同浓度处理,培养24 h 后细胞密度达到80%~90%收集细胞,磷酸缓冲液洗涤细胞1次,去离子水按1∶4比例稀释Buffer浓缩结合缓冲液,以离心半径3 cm,2000 r/min 离心5 min后磷酸缓冲液再次洗涤,取1×109/L 细胞待检。用250 μL结合缓冲液再次悬浮,从中取出195 μL 的悬液加入5 μL 经异硫氰酸荧光素标记的钙依赖性磷脂结合蛋白(Annexin V-FITC),混匀后间隔3 min,再加入10 μL碘化丙锭溶液,混匀后室温避光10 min,再加入300 μL稀释过的结合缓冲液冲悬细胞,上机检测,实验重复3次。

2结果
2.1JSI-124抑制食管癌Eca-109细胞的生长增殖同一时间经不同浓度JSI-124(0.6、1.2、2.5、5.0 μmol/L)处理Eca-109 细胞后,JSI-124对细胞的生长抑制率逐渐加大,而相应浓度下,二甲基亚砜对细胞的生长无明显效用。同一浓度的JSI-124处理Eca-109细胞48、72 h后,JSI-124对食管癌细胞的抑制水平也逐渐升高(P<0.05)。
表1JSI-124处理Eca-109细胞24、48、72 h后对
Eca-109细胞的抑制率


JSI-124浓度24h48h72h0μmol/L0.000.000.000.6μmol/L0.24±0.03a0.32±0.02ae0.51±0.02aef1.2μmol/L0.42±0.02ab0.53±0.03abe0.78±0.02abef2.5μmol/L0.57±0.02abc0.61±0.02abce0.81±0.02abcef5.0μmol/L0.63±0.01abcd0.71±0.01abcde0.96±0.01abcdef
a与0 μmol/L比较,P<0.05;b与0.6 μmol/L比较,P<0.5;c与1.2 μmol/L比较,P<0.05;d与2.5 μmol/L比较,P<0.05;e与24 h比较,P<0.05;f与48 h比较,P<0.05
2.2不同浓度JSI-124对Eca-109细胞STAT3 信使RNA水平表达的影响 以不同浓度的JSI-124处理Eca-109细胞48 h后,Eca-109细胞中STAT3 的信使RNA水平逐渐减少(F=13.650,P<0.05)(图1)。


图1JSI-124作用于Eca-109细胞后,STAT3在转录水平的表达a与0 μmol/L JSI-124比较,P<0.05;STAT:信号转导及转录激活因子;GADPH:甘油醛-3-磷酸脱氢酶
2.3JSI-124抑制Eca-109细胞STAT3及其相关蛋白的表达经不同浓度JSI-124处理细胞24 h后,p-STAT3(Tyr705)的蛋白表达水平随着抑制浓度的增加而逐渐减少,总STAT3蛋白表达不变,同时,抗凋亡蛋白Bcl-2的表达水平随着p-STAT3 蛋白水平的减少而下降(F=12.460,P<0.05)(图2)。
2.4JSI-124提高食管癌Eca-109细胞的细胞凋亡率以不同浓度的JSI-124处理Eca-109细胞24 h,结果显示,JSI-124浓度的增加,Eca-109细胞的凋亡水平也不断升高,且差异有统计学意义(P<0.05)。见图3。1.2 μmol/L、2.5 μmol/L、5.0 μmol/L JSI-124作用于Eca-109细胞的早期凋亡率、晚期凋亡率、总凋亡率均显著高于0 μmol/L,5.0 μmol/L JSI-124作用于Eca-109细胞的早期凋亡率、晚期凋亡率、总凋亡率均显著高于1.2 μmol/L、2.5 μmol/L,2.5 μmol/L总凋亡率均显著高于1.2 μmol/L,差异有统计学意义(P<0.05)。见表2。


图2STAT3在JSI-124作用下翻译水平的表达a与0 μmol/L JSI-124比较,P<0.05;STAT:信号转导及转录激活因子;GADPH:甘油醛-3-磷酸脱氢酶



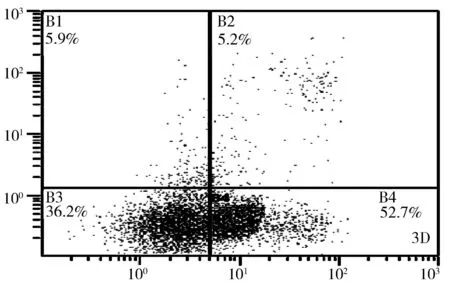
图3流式细胞仪检测不同浓度的JSI-124作用于Eca-109细胞后细胞的凋亡水平变化3a:0 μmol JSI-124;3b:1.2 μmol JSI-124;3c:2.5 μmol JSI-124; 3d:5 μmol JSI-124
表2JSI-124作用于Eca-109细胞24 h后的凋亡率

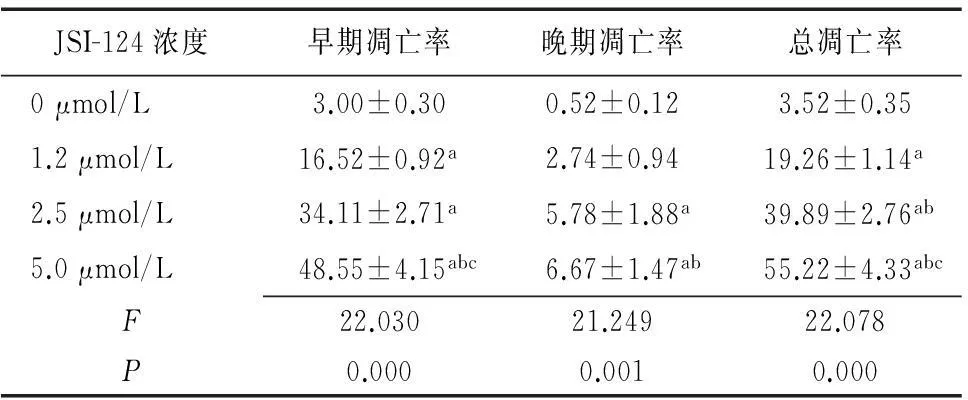
JSI-124浓度早期凋亡率晚期凋亡率总凋亡率0μmol/L3.00±0.300.52±0.123.52±0.351.2μmol/L16.52±0.92a2.74±0.9419.26±1.14a2.5μmol/L34.11±2.71a5.78±1.88a39.89±2.76ab5.0μmol/L48.55±4.15abc6.67±1.47ab55.22±4.33abcF22.03021.24922.078P0.0000.0010.000
a与0 μmol/L比较,P<0.05;b与1.2 μmol/L比较,P<0.05;c与 2.5 μmol/L比较,P<0.05
3讨论
食管癌在我国是最常见的恶性肿瘤类型之一,现有对食管癌的治疗手段中,外科及放射治疗仍然是最重要的治疗方式,但是食管癌的早期诊断率低下,且其易转移、易复发,因此食管癌患者在经过外科及放射治疗后多数存在预后不良,5年生存率也不令人满意。因此,对于食管癌发生、发展、侵袭、转移的机制研究很关键。近年来,基于对信号转导通路的深入研究,人们认识到食管癌的发生是众多致癌因子的激活和抑癌因子失活的共同作用,某些关键的转录因子可以通过相应的信号转导通路,从而控制其下游多个基因的表达,影响肿瘤的生物学特性。这些转录因子就是影响相关基因表达的关键[6],换言之,针对这些关键因子进行各种干预,降低它们的表达水平,能级联式影响其他相关基因的表达,抑制癌细胞生长、侵袭、转移和促进凋亡[7]。
STAT3在恶性肿瘤细胞中持续活化。有研究指出,STAT3的持续激活可能上调相关抗凋亡因子和细胞增殖相关因子的表达,可以刺激细胞增殖,诱导肿瘤组织血管生成,并参与肿瘤免疫逃逸[8]。另有研究发现,STAT3活化水平在肺癌细胞中明显升高[9],并且抑制STAT3活化后可提高胃癌[10]、卵巢癌[11]、恶性黑色素瘤[12]及白血病[13]细胞等肿瘤对药物的化疗敏感性。
本研究采用JSI-124选择性阻断食管癌Eca-109细胞中的STAT3通路,以探知其对人食管癌细胞增殖和凋亡的影响。研究结果表明,JSI-124对Eca-109细胞增殖的影响与时间和剂量呈正比,且浓度一致的情况下,随着药物处理时间的延长,JSI-124对食管癌细胞的抑制率也呈不断上升的趋势。而选取不同浓度JSI-124 (0、0.6、1.2、2.5、5.0 μmol/L)分别作用于食管癌Eca-109细胞后,STAT3及下游的信号因子在转录和翻译水平均与对照组有不同程度的影响,这与在乳腺癌[14]、鼻咽癌[15]、神经母细胞瘤[16]及黑色素瘤细胞[17]中的研究结果相一致,提示抑制STAT3的活化能够明显抑制肿瘤细胞的增殖。本研究采用流式细胞仪法将不同浓度的JSI-124 处理Eca-109细胞后对细胞的凋亡水平进行检测,结果随JSI-124 抑制浓度的增加,Eca-109细胞的早期凋亡水平和总凋亡水平均有所升高(P<0.05),因此认为,JSI-124能剂量依赖性的诱导人食管癌Eca-109细胞的凋亡,结合前部分实验,可以证明JSI-124能特异性抑制STAT3因子,为临床上针对食管癌靶向治疗的研究提供可行性。
综上所述,食管癌细胞中STAT3蛋白的表达是肿瘤治疗的分子靶点,其抑制剂JSI-124可明显抑制人食管癌Eca-109细胞的增殖,并且诱导其细胞的凋亡,提示STAT3抑制剂或可考虑作为食管癌患者的生物靶向治疗手段,为JSI-124等STAT3抑制剂应用于食管癌的基因治疗提供了实验研究基础,可成为食管癌靶向治疗的新策略。
参考文献
[1]Spitzner M,Ebner R,Wolff HA,etal.STAT3:A Novel Molecular Mediator of Resistance to Chemoradiotherapy[J].Cancers(Basel),2014,6(4):1986-2011.
[2]Caldera V,Mellai M,Annovazzi L,etal.Stat3 expression and its correlation with proliferation and apoptosis-autophagy in gliomas[J].J Oncol,2008,2008:219-241.
[3]Chang CJ,Chiang CH,Song WS,etal.Inhibition of phosphorylated STAT3 by cucurbitacin I enhances chemoradiosensitivity in medulloblastoma-derived cancer stem cells[J].Childs Nerv Syst,2012,28(3):363-373.
[4]Fujita M,Zhu X,Sasaki K,etal.Inhibition of STAT3 promotes the efficacy of adoptive transfer therapy using type-1 CTLs by modulation of the immunological microenvironment in a murine intracra-nial glioma[J].J Immunol,2008,180(4):2089-2098.
[5]Shi X,Franko B,Frantz C,etal.JSI-124 (cucurbitacin I) inhibits Janus kinase-3/signal transducer and activator of transcription-3 signalling,downregulates nucleophosmin-anaplastic lymphoma kinase (ALK),and induces apoptosis in ALK-positive anaplastic large cell lymphoma cells[J].Br J Haematol,2006,135(1):26-32.
[6]Chan KS,Sano S,Kiguchi K,etal.Disruption of Stat3 reveals a critical role in both the initiation and the promotion stages of epithelial carcinogenesis[J].J Clin Invest,2004,114(5):720-728.
[7]付彦超,张庆瑜.胃癌基因治疗靶点的研究进展[J].国际消化病杂志,2008,28(6):489-491.
[8]Choi S,Sano D,Cheung M,etal.Vandetanib inhibits growth of adenoid cystic carcinoma in an orthotopic nude mouse model[J].Clin Cancer Res,2008,14(16):5081-5089.
[9]Alvarez JV,Greulich H,Sellers WR,etal.Signal transducer and activator of transcription 3 is required for the oncogenic effects of non-small-cell lung cancer-associated mutations of the epidermal growth factor receptor[J].Cancer Res,2006,66(6):3162-3168.
[10]Huang S,Chen M,Shen Y,etal.Inhibition of activated Stat3 reverses drug resistance to chemotherapeutic agents in gastric cancer cells[J].Cancer Lett,2011,315(2):198-205.
[11]Yue P,Zhang X,Paladino D,etal.Hyperactive EGF receptor,Jaks and Stat3 signaling promote enhanced colony-forming ability,motility and migration of cisplatin-resistant ovarian cancer cells [J].Oncogene,2011,31(18):2309-2322.
[12]Zhou J,Ong CN,Hur GM,etal.Inhibition of the JAK-STAT3 pathway by andrographolide enhances chemosensitivity of cancer cells to doxorubicin[J].Biochem Pharmacol,2010,79(9):1242-
1250.
[13]Ishdorj G,Johnston JB,Gibson SB.Inhibition of Constitutive Activation of STAT3 by Curcurbitacin-I (JSI-124) Sensitized Human B-Leukemia Cells to Apoptosis[J].Mol Cancer Ther,2010,9(12):3302-3314.
[14]Lee DH,Iwanski GB,Thoennissen NH.Cucurbitacin:ancient compound shedding new light on cancer treatment[J].Scientific World Journal,2010,10:413-418.
[15]Lui VW,Yau DM,Wong EY,etal.Cucurbitacin I elicits anoikis sensitization,inhibits cellular invasion and in vivo tumor formation ability of nasopharyngeal carcinoma cells[J].Carcinogenesis,2009,30(12):2085-2094.
[16]Gheeya JS,Chen QR,Benjamin CD,etal.Screening a panel of drugs with diverse mechanisms of action yields potential therapeutic agents against neuroblastoma[J].Cancer Biol Ther,2009,8(24):2386-2395.
[17]Molavi O,Ma Z,Hamdy S,etal.Synergistic antitumor effects of CpG oligodeoxynucleotide and STAT3 inhibitory agent JSI-124 in a mouse melanoma tumor model[J].Immunol Cell Biol,2008,86(6):506-514.
兼症医学
兼症医学是临床医学在应用诊断、治疗、预防的一种方法学。这方法学强调了“统一同一时体论”在医疗、教学、科研实践上的重要性。统一性强调了共性(整体性),同一时性明确了个性(差异性)。人是由系统、器官、组织、细胞、分子组成的自身整体的个体,也是宇宙间的独立体,但是必须统一于宇宙。
兼症医学是讲在疾病的个体,在空间里时间内是怎样发生、发展、转归的。
疾病一旦发生在人类群体或个体时,同种疾病尽管有共同临床表现,但也可有千奇百怪的现象发生。“统一同一时体论”可以完美解释。
兼症医学在临床上应用最多的是对发病机制、诊断、治疗进行探讨,其中又重点讲述原发病、合并病、继发病、并发症、同源病、后遗症和综合征等在临床实践中的应用。
———刘桂蕊
Study on JSI-124 Inhibition on the STAT3 Pathway to Block the Proliferation of Eca-109 Cells of Esophageal CanceCUIKai1,ZHUTao1,WANGJing2,ZHANGTao1,LIXiao-fei1.(1.DepartmentofThoracicSurgery,TangduHospital,theFourthMilitaryMedicalUniversity,Xi′an,710038,China; 2.DepartmentofOncology,theGeneralHospitalofNanjingMilitaryRegion,Nanjing210002,China)
Abstract:ObjectiveTo explore the effect of inhibition of signal transduction and activator of transcription 3 (STAT3) with JSI-124 on the proliferation of Eca-109 cells of esophageal cancer.MethodsAfter treatment with JSI-1244(0,0.6,1.2,2.5,5.0 μmol/L),CCK-8 assay was used to detect the inhibitory rate of Eca-109 cells,STAT3 and p-STAT3 protein levels were tested by Western blot and the levels of STAT3 mRNA were tested by reverse transcription-polymerase chain reaction in Eca-109 cells. The flow cytometry was used to detect the apoptosis rate of Eca-109 cells.ResultsSTAT3 activation level was obviously decreased in the JSI-124 treated Eca-109 cells. Along with the increase of the concentration level of JSI-1244(0,1.2,2.5,5.0 μmol/L),the cell apoptosis rate increased as well(3.52%,19.26%,39.89%,55.22%) (P<0.05).ConclusionJSI-124,as a STAT selective inhibitor,inhibits the cell proliferation and enhances the apoptosis rate of Eca-109 cells.
Key words:Esophageal cancer; Cucurbitacin; Signal transduction and activator of transcription 3; Proliferation; Apoptosis
收稿日期:2014-10-20修回日期:2015-08-25编辑:相丹峰
doi:10.3969/j.issn.1006-2084.2015.20.046
中图分类号:R730.23
文献标识码:A
文章编号:1006-2084(2015)20-3772-04

