有序介孔硅MCM-41对美洛昔康的包载及其形成的复合物MCM41-MX 的溶出特征
袁 悦,郭 卓,包志红,陈洪涛,傅彦妍,李三鸣
(1.沈阳药科大学药学院,辽宁 沈阳110016;2.沈阳化工学大学材料科学与工程学院,辽宁 沈阳110142)
有序介孔硅基材料由于其本身无毒、无生理活性,具有较大的比表面积和孔体积,因此具有较强的载药能力[1].最初,介孔硅基材料用于开发缓释制剂[2],但是现在已被拓展于增强水难溶性药物的溶解度[3-4].MCM-41是一种有序介孔硅基材料,自20世纪90年代以来,已成为研究最多的一类介孔硅基材料.其显著的特性表现为具有规则的六方孔道结构、狭窄的孔径分布、极高的比表面积、较高的化学稳定性和水热稳定性,而且孔径可调,表面含有丰富的自由硅羟基,使得它被广泛应用于药物制剂中.
美洛昔康是一种烯醇酸类非甾体抗炎药,在生物药剂学分类系统中属于第二类药物,即低溶解性和高透膜性.美洛昔康主要用于治疗类风湿性关节炎、骨关节炎、强直性脊柱炎和其他关节类疾病[5].美洛昔康在水中几乎不溶(水中溶解度仅为12μg/mL),所以其溶出速率成为吸收速率的限制步骤,进而影响其镇痛效果.为此,人们设计很多方法来提高美洛昔康的溶出速率,人们将美洛昔康制成环瑚精包合物[6]或固体分散体[7].也有利用MCM-41极大的比表面积和吸附特性来增加水难溶性药物吡罗昔康的溶出速率[8].本文通过用介孔硅基材料MCM-41增加美洛昔康溶出速率.采用紫外分光光度法与热重分析测定美洛昔康-MCM-41复合物的载药量,采用XRD 分析与差热扫描描述包合物中美洛昔康的存在形式.以有序介孔硅基材料作为新型的药物载体,来提高美洛昔康的溶解度和溶出速率,为其进一步制成适宜的剂型打下实验基础.
1 实验部分
1.1 仪器与材料
仪器:UV9100紫外-可见分光光度计(北京瑞利分析仪公司);JB-2型集热式恒温加热磁力搅拌器(上海雷磁新径有限公司);DL-101-1型电热干燥箱(天津市中环实验电炉有限公司);SHB-Ⅲ型循环水式多用真空泵(郑州长城科工贸有限公司);S ETSYS Evolution18综合热分析仪(法国SETARAM 公司);DSC-60差热分析仪(日本岛津公司);(Rigaku)D/max 2500PC 型X 射线衍射仪(日本理学);TGA-50热重分析仪(日本岛津公司);RH-5K 型智能溶出仪(天津大学仪器厂);RJX-4-13型马弗炉(天津市中环实验电炉有限公司).
材料:美洛昔康原料药(宁夏康亚药业有限公司);N,N-二甲基甲酰胺(天津市康科德科技有限公司);正硅酸乙酯(TEOS)(天津天泰化学品有限公司);十六烷基三甲基溴化氨(CTAB)(北京益利精细化学品有限公司);其他试剂均为分析纯.
1.2 实验方法
1.2.1 介孔材料MCM-41的合成
以CTAB为模板剂[4],水玻璃为硅源,在温热条件下搅拌得到凝胶,然后将其放入反应釜中,于100℃恒温晶化72h.将所得产物洗涤、抽滤、自然干燥,在550℃空气中焙烧除去表面活性剂,得到介孔材料MCM-41.
1.2.2 美洛昔康的载药过程
将400.0mg美洛昔康溶于20.0mL混合溶剂(V(丙酮)∶V(N,N-二甲基甲酰胺)=3∶7)中,然后加入500.0mg MCM-41,在室温下搅拌48h.停止搅拌后,静置2h,然后抽滤,所得固体在恒温39℃烘箱中干燥24h至恒重,成品置于保干器中保存.
1.2.3 美洛昔康体外释放
先精密称取3份美洛昔康原料药18.0mg备用;再精密称取3份美洛昔康原料药18.0mg,按质量比1∶9精密称取MCM-41 162.0mg,充分混匀制成物理混合物备用;按复合物载药量10%计算,精密称取3份含18.0mg美洛昔康的复合物备用.
按照中国药典溶出度测定法(桨法,2000版附录XC第二法),以900mL 磷酸盐缓冲液(pH=7.4)为溶出介质,转速为75r/min,温度为37℃.将上述称量样品粉末分别加到溶出介质中,预定时间取样5mL,立即补充等量的溶出介质.取出样品溶液,用0.45μm 微孔滤膜过滤,取续滤液,用紫外-可见分光光度法测定药物浓度.
2 结果与讨论
2.1 美洛昔康载药溶剂的选择
根据药典可知,美洛昔康在N,N-二甲基甲酰胺中溶解;在氯仿、丙酮中微溶;在甲醇、乙醇中极微溶;在水中几乎不溶.由于N,N-二甲基甲酰胺沸点过高,所以加入低沸点的丙酮组成混合溶剂.
取6.0mL丙酮与14mL N,N-二甲基甲酰胺充分混合,得到20mL混合溶剂,加入400.0mg美洛昔康,溶解.同法可知在丙酮与N,N-二甲基甲酰胺的体积比为4∶6,5∶5,6∶4时美洛昔康亦能溶解,但通过实验验证,混合溶剂比例为3∶7时所制得的复合物载药量最高.故选择体积比3∶7的混合溶剂作为载药溶剂.
2.2 美洛昔康-MCM-41投料比
美洛昔康和MCM-41按照3∶5,4∶5和5∶5的体积比分别投料,加入20mL的混合溶剂,在室温下搅拌48h.搅拌停止后,静置2h,然后抽滤,所得固体在恒温40℃烘箱中干燥24h至恒重,然后置于保干器中保存.
2.3 载药量的确定
复合物中美洛昔康的含量由热重分析法完成.MCM-41-美洛昔康热重分析见图1.由图1可知:在100℃~250℃复合物质量开始逐渐减少,这是由于原始药物降解引起的,然后在500℃~600℃时药物最后分解.再结合紫外-可见分光光度法确定美洛昔康的载药量为(10±2)%.
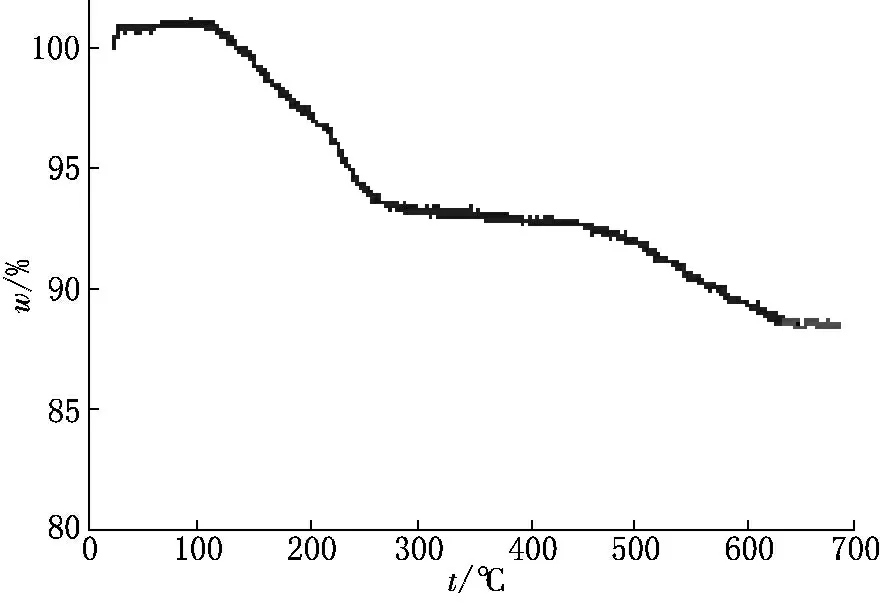
图1 美洛昔康的热重分析曲线
2.4 XRD 分析
美洛昔康、MCM-41、MCM-41-美洛昔康复合物和物理混合物的XRD 谱见图2.由图2可知:美洛昔康具有结晶特征的高强度的反射峰;MCM-41表现出的是较平滑的衍射图,但在2°~8°有典型的反射;物理混合物显示MCM-41和晶体美洛昔康的衍射峰,说明物理混合物中有药物晶体存在,但与美洛昔康原料药相比强度低很多;复合物与原料药和物理混合物相比,几乎没有出现药物峰,复合物与辅料MCM-41的峰形相似,说明形成复合物后,MCM-41的物理结构并没有改变,这说明MCM-41载药后保持原有的结构并且药物在复合物中不是以晶体形式存在.
2.5 差热扫描分析
美洛昔康、MCM-41、MCM-41-美洛昔康复合物和物理混合物的差热扫描分析曲线见图3.由图3可知:美洛昔康在260℃有一个很锐的吸热峰,代表熔点,药物以晶体形式存在复合物中,并没有明显的相变峰,且与MCM-41曲线相似;形成复合物后,MCM-41的物理结构并没有改变,美洛昔康在复合物中不是以晶体形式存在;物理混合物在237℃有一较小的吸热峰,表明物理混合物中药物仍以晶体形式存在,但与原料药的吸收峰位和大小相比,吸热峰的位置有所改变且峰变小,可能是由于物理混合物在差热扫描分析加热过程中,辅料MCM-41的存在影响了药物熔点的释放.

图2 4种物质的XRD谱
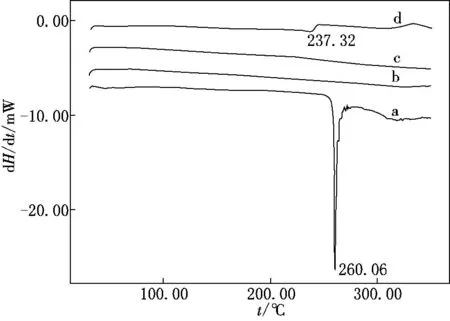
图3 4种物质的差热扫描曲线
为了研究药物在体内胃肠道中药物释放行为,依据文献[9],选择pH=7.4的磷酸盐作为溶出介质,进行溶出度测定(见图4).由图4可以看出,复合物在大约15min时即达到最大溶出度,而物理混合物在45min时达到最大溶出度,药物晶体在80min达到最大溶出度.由此可见,复合物比美洛昔康药物晶体与物理混合物的溶出速率要高得多.
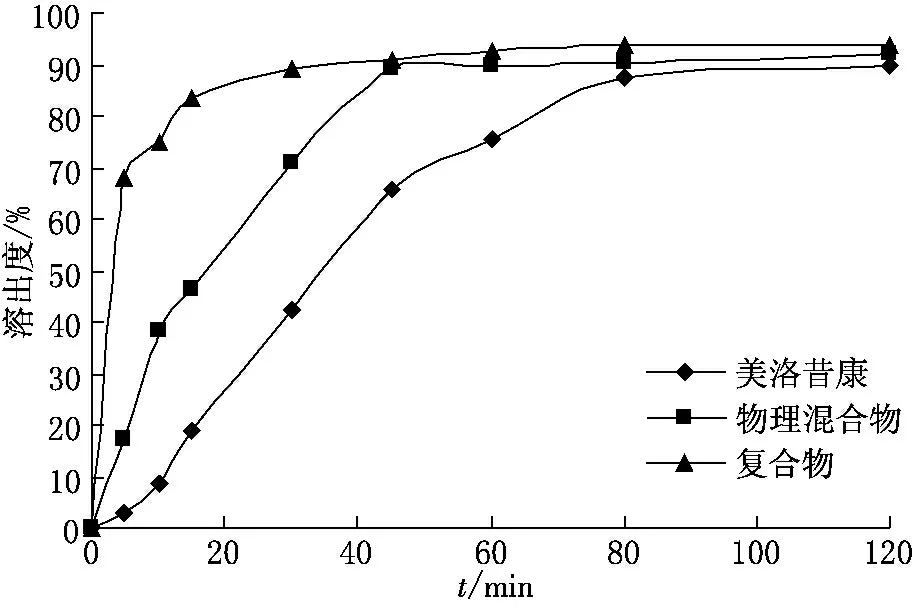
图4 美洛昔康、物理混合物和复合物的累积溶出度
3 结论
本文利用MCM-41 提高水难溶性药物美洛昔康的溶出速率.采用热重分析、紫外-可见分光光度法、差热扫描与XRD 分析测定可知:包合物载药量为10%左右;美洛昔康并不是以晶体形式存在于包合物中,而是以分子形式通过氢键与MCM-41结合的;在pH=7.4环境下,体外溶出实验可知,复合物比单纯药物晶体的溶出速率高很多,说明介孔材料MCM-41对提高水难溶性药物的溶出速率有很大的潜力.
[1]IGOR I S,JUAN L V,CHIA-WEN WU,et al.Mesoporous silica nanoparticles as controlled release drug delivery and gene transfection carriers[J].Advanced Drug Delivery Reviews,2008,60:1278-1288.
[2]WANG SHAOBIN.Ordered mesoporous materials for drug delivery[J].Microporous and Mesoporous Materials,2009,117:1-9.
[3]THOMAS M J K,SLIPPER I,WALUNJ A,et al.Inclusion of poorly soluble drugs in highly ordered mesoporous silica nanoparticles[J].International Journal of Pharmaceutics,2010,387:272-277.
[4]GUO ZHUO,LIU XIAO-MENG,MA LEI,et al.Effects of particle morphology,pore size and surface coating of mesoporous silica on naproxen dissolution rate enhancement[J].Colloids and Surfaces B:Biointerfaces,2013,101:228-235.
[5]DAVIES N M,SKJODT N M.Clinical pharmacokinetics of meloxicam[J].Clin Pharmacokinet,1999,36:115-126.
[6]NAIDU N B,CHOWDARY K P,MURTHY K V,et al.Physicochemical characterization and dissolution properties of meloxicam-cyclodextrin binary systems[J].Journal of Pharmaceutical and Biomedical Analysis,2004,35:75-86.
[7]VIJAYA KUMAR S G,MISHRA D N.Preparation and evaluation of solid dispersion of meloxicam with skimmed milk[J].Yakugaku Zasshi,2006,126(2):93-97.
[8]AMBROGI V,PERIOLI L,MARMOTTINI F,et al.Improvement of dissolution rate of piroxicam by inclusion into MCM-41 mesoporous silicate[J].Eur J Pharm Sci,2007,32(3):216-222.
[9]BUCHI NAIDU N,CHOWDARY K P R,MURTHY K V R,et al.Physicochemical characterization and dissolution properties of meloxicam-cyclodextrin binary systems[J].Journal of Pharmaceutical and Biomedical Analysis,2004,35:75-86.

