Toll样受体2介导的JNK信号分子在小鼠支气管哮喘发病中的作用机制
沈佩婷,方 磊,吴惠梅,沈启英,何 芳,刘荣玉
Toll样受体2介导的JNK信号分子在小鼠支气管哮喘发病中的作用机制
沈佩婷,方 磊,吴惠梅,沈启英,何 芳,刘荣玉
摘要目的 探讨Toll样受体2(TLR2)介导的c-Jun氨基末端激酶(JNK)信号分子参与小鼠支气管哮喘发病的作用机制。方法 健康SPF级C57(TLR2野生型)鼠和TLR2基因缺失(TLR2-/-)鼠各14只,按随机数字表法分为4组:C57对照组、C57哮喘组、TLR2-/-对照组、TLR2-/-哮喘组,每组7只,哮喘组以卵清蛋白(OVA)腹腔注射联合雾化吸入致敏和激发建立哮喘模型,对照组以生理盐水代替OVA致敏和激发。利用免疫组织化学染色技术(ABC法)检测TLR2蛋白在C57对照组、C57哮喘组肺内的表达差异,JNK及磷酸化JNK(P-JNK)蛋白表达在各组肺内的表达差异。结果 HE染色提示较其余3组,C57哮喘组有较明显的炎症细胞浸润及呼吸道平滑肌增生。以平均吸光度(mA)衡量各组织蛋白相对表达量,免疫组化结果提示TLR2蛋白在C57哮喘组表达显著高于C57对照组(P<0.01),JNK蛋白在各组的表达差异无统计学意义,P-JNK蛋白在C57哮喘组肺组织的表达量显著高于C57对照组、TLR2-/-哮喘组、TLR2-/-对照组(F=43.261,P<0.01)。结论 TLR2介导的JNK信号分子通路可能参与了支气管哮喘的发病过程。
关键词哮喘;TLR2;JNK;P-JNK;免疫组化
2015-02-02接收
作者单位:安徽医科大学第一附属医院干部呼吸科,安徽省老年病研究所,合肥 230022
支气管哮喘(简称哮喘)是多基因参与的具有遗传易感性的慢性呼吸道变应性疾病,其发病涉及多种炎症细胞、炎性介质和复杂的细胞因子网络。Toll样受体家族(Toll like receptors,TLRs)是参与非特异性免疫(天然免疫)的一类重要蛋白质分子,同时具有激活和调节特异性免疫系统的作用。TLR2在调控哮喘的发病机制中扮演的角色备受争议[1-2]。TLRs的激活依赖于连接蛋白髓样分化蛋白88的结合,将信号传至胞内Toll/IL-1受体同源结构域,从而激活下游的信号转导通路,如核转录因子NF-κB诱导激酶,促丝裂原活化蛋白激酶,通过c-Jun氨基末端激酶(c-Jun amino-terminal kinase,JNK)激活活化蛋白-1转录因子家族,即可启动细胞内炎性因子的合成及释放[3-4]。但TLR2激活JNK信号分子通路参与哮喘的发病过程少见报道。基于以上研究背景,该研究建立TLR2-/-小鼠哮喘模型,拟从形态学角度探讨TLR2介导的JNK信号分子通路在哮喘发病中的可能机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 非特定病原体雌性小鼠,6~8周龄,SPF级C57小鼠(上海斯莱克实验动物有限责任公司)及TLR2-/-小鼠(中国科学技术大学生命科学院田志刚教授馈赠)各14只,(25±2)g。饲养于中国科学技术大学生命科学学院实验动物中心,饲养环境符合SPF实验动物级环境设施标准。
1.1.2 实验器材和试剂 超声雾化器402AI(江苏鱼跃医疗设备股份有限公司);卵清蛋白(ovalbumin,OVA)、硫酸铝钾(上海生工生物工程技术服务有限公司);兔抗鼠TLR2多克隆抗体(美国Abcam公司);兔抗鼠JNK、P-JNK多克隆抗体(美国CST公司);SP9000免疫组化染色试剂盒、浓缩型DAB试剂盒(北京中杉金桥生物技术有限公司)。
1.2 方法
1.2.1 动物分组及模型复制 按照随机数字表法将C57及TLR2-/-小鼠各14只分成4组:C57对照组、C57哮喘组、TLR2-/-对照组、TLR2-/-哮喘组。哮喘组小鼠于第0天腹腔注射10 μg OVA和含1 mg硫酸铝钾的生理盐水溶液0.5 ml致敏。第14天开始激发,给予1%OVA生理盐水50 ml雾化吸入,1次/d,30 min/次,连续7 d。对照组参照哮喘组方法,只是致敏和激发时均以生理盐水代替OVA。各组均于末次激发后24 h处死,切下一半右肺组织经4%多聚甲醛固定,常规石蜡包埋切片,用
于HE染色及免疫组化检测。
1.2.2 HE染色检测肺组织病理变化 光镜(× 10)下观察HE染色的支气管肺组织周围炎症细胞浸润、平滑肌增生情况。
1.2.3 免疫组织化学检测蛋白表达 切片常规脱蜡至水,采用高火微波修复抗原,柠檬酸缓冲液pH =6.0。3%过氧化氢抑制内源性过氧化物酶活性及0.3%Triton-X 100增加肺组织通透性,以5%山羊血清(A液)封闭减少非特异性表达。滴加一抗,37℃孵育1 h后4℃过夜(视抗体表达程度可适当予以延长),PBS洗涤后,生物素标记的二抗(B液)处理30 min,辣根过氧化物酶标记的C液37℃孵育30 min,ABC液均为SP9000检测试剂盒内容物,DAB显色,镜下控制染色时间,含有粗细不一的棕黄色颗粒即为阳性细胞。苏木精轻度复染,脱水,透明,中性树胶封片。每张切片随机选择4个结构较完整的支气管(×20),应用JD 801D图像分析软件测定阳性部位的平均吸光度(mean absorbance,mA),代表各蛋白表达水平。
1.3 统计学处理 所有数据经SPSS 16.0软件分析,计量资料均符合正态分布,以±s表示,两样本均数比较采用两独立样本t检验,多组样本均数采用单因素方差分析法,两两比较采用Bonferroni检验。
2 结果
2.1 小鼠行为学改变 哮喘组在激发时均出现不同程度的烦躁不安、呼吸急促、毛发竖直、大小便失禁等症状,严重者呼吸减慢,行动迟缓,而对照组无明显上述表现。
2.2 肺组织形态学改变 光镜示C57哮喘组支气管、血管周围大量炎症细胞浸润,嗜酸性粒细胞增多,呼吸道上皮黏液腺增生,支气管壁明显增厚、管腔狭窄,肺泡壁结构紊乱,而C57对照组及TLR2-/-对照组支气管周围则有少量炎症细胞浸润,无明显平滑肌增生、支气管壁增厚,肺泡结构完整。TLR2-/-哮喘组炎症细胞浸润及平滑肌增生等较C57哮喘组有所减弱。见图1。
2.3 肺组织TLR2、JNK、P-JNK蛋白表达TLR2、JNK、P-JNK蛋白主要表达定位在胞质和胞核,支气管上皮细胞、平滑肌细胞及浸润的炎症细胞均可见表达。TLR2蛋白在C57哮喘组肺组织的表达量显著高于C57对照组(P<0.01),见图2、表1。JNK蛋白在各组中的表达差异无统计学意义,见图3、
表1。P-JNK蛋白在C57哮喘组肺组织的表达量显著高于C57对照组、TLR2-/-哮喘组、TLR2-/-对照组(F=43.261,P<0.01),见图3、表1。
表1 TLR2、JNK、P-JNK在各组小鼠肺组织mA比较(n=7,±s)
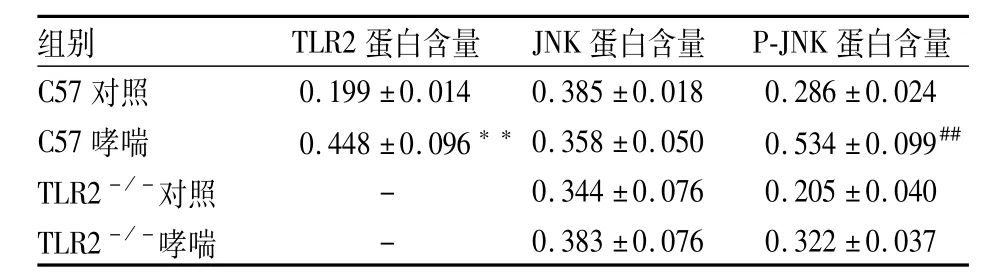
表1 TLR2、JNK、P-JNK在各组小鼠肺组织mA比较(n=7,±s)
与C57对照组比较:**P<0.01;与其他3组比较:##P<0.01
组别 TLR2蛋白含量 JNK蛋白含量 P-JNK 蛋白含量C57对照0.199±0.014 0.385±0.018 0.286±0.024 C57哮喘 0.448±0.096**0.358±0.050 0.534±0.099##TLR2-/-对照 - 0.344±0.076 0.205±0.040 TLR2-/-哮喘 - 0.383±0.076 0.322±0.037
3 讨论
TLRs在参与哮喘气道炎症的不同细胞上均有表达,如上皮细胞、巨噬细胞、树突状细胞、肥大细胞[5]和气道平滑肌[6]。Ferreira et al[1]收集24例致命性哮喘患者的临床标本,发现TLR2蛋白在气道上皮的表达较对照组升高。Th2细胞及其分泌的细胞因子的增多在哮喘的发病中起着重要的作用,Re-
decke et al[7]发现TLR2的配体Pam3Cys通过持续性诱导Th2反应,下调Th1因子,从而使免疫反应向Th2优势的方向发展,促进实验性哮喘的发生,而另一项研究[2]显示TLR2的配体Pam3Cys通过降低气道高反应性,减弱肺内Th2型炎症反应及特异性IgE的分泌等抑制哮喘的发生。
有研究[8-9]显示,TLR2基因变异是哮喘易感性的主要决定因素。研究[10]表明,TLR2-/-时哮喘组小鼠气道炎症浸润程度显著降低,且一种新型的晚期炎症介质即高迁移率族蛋白1信号分子在BALF及肺组织中的表达亦减少。本研究在前期工作基础上,通过OVA致敏及激发小鼠成功建立哮喘模型,进一步提出TLR2介导了JNK信号通路参与哮喘的发病机制。免疫组织化学直观地显示出TLR2蛋白在C57哮喘组的表达显著高于C57对照组,与上述TLR2可能促进小鼠支气管哮喘发生的结论相符。
JNK是促丝裂原活化蛋白激酶超家族成员之一,通过三级酶促级联反应,完成JNK磷酸化,从而在炎症反应的诸多方面发挥免疫调控作用[11]。Nath et al[12]通过哮喘造模发现JNK信号通路在气道炎症、气道重塑及伴随的气道高反应性中发挥重要作用。Oltmanns et al[13]研究证实在气道慢性炎症和重构过程中,JNK是一个重要的信号分子,可促进气道平滑肌细胞分泌炎性因子如活性调节蛋白、白介素-8等。有研究[14]表明P-JNK与哮喘气道重塑密切相关,表现为蛋白表达量升高,而JNK作为P-JNK的前体其表达量无显著差异。本研究免疫组织化学检测JNK蛋白在各组之间的表达无明显差异,P-JNK在哮喘组中表达升高与以上结论相符。
肺泡巨噬细胞主要通过吞噬病原体和协调炎症反应来调控天然免疫应答,参与哮喘的发病,Fang et al[15]通过金黄色葡萄球菌刺激RAW264.7肺泡巨噬细胞系,发现TLR2基因沉默可以显著地降低PJNK在巨噬细胞的表达,推测TLR2可能活化并介导了JNK信号通路。Watanabe et al[16]也有过类似的发现。本研究中免疫组织化学检测显示活化的P-JNK在C57哮喘组显著升高,TLR2-/-时其表达量则明显降低。因此,推测TLR2蛋白在诱发哮喘过程中占主导地位,同时进一步激活并介导JNK信号分子参与小鼠支气管哮喘的发生,但其确切的调控机制仍需深入探讨。
参考文献
[1] Ferreira D S,Annoni R,Silva L F,et al.Toll-like receptors 2,3 and 4 and thymic stromal lymphopoietin expression in fatal asthma [J].Clin Exp Allergy,2012,42(10):1459-71.
[2] Haapakoski R,Karisola P,Fyhrquist N,et al.Toll-like receptor activation during cutaneous allergen sensitization blocks development of asthma through IFN-gamma-dependent mechanisms[J].J Invest Dermatol,2013,133(4):964-72.
[3] Aderem A,Ulevitch R J.Toll-like receptors in the induction of the innate immune response[J].Nature,2000,406(6797):782-7.
[4] Kawai T,Akira S.TLR signaling[J].Cell Death Differ,2006,13 (5):816-25.
[5] Takeda K,Kaisho T,Akira S.Toll-like receptors[J].Annu Rev
Immunol,2003,21:335-76.
[6] Sukkar M B,Xie S,Khorasani N M,et al.Toll-like receptor 2,3,and 4 expression and function in human airway smooth muscle[J].J Allergy Clin Immunol,2006,118(3):641-8.
[7] Redecke V,Hcker H,Datta S K,et al.Cutting edge:Activation of Toll-like receptor 2 induces a Th2 immune response and promotes experimental asthma[J].J Immunol,2004,172(5):2739 -43.
[8] Smit L A,Bouzigon E,Bousquet J,et al.Mold allergen sensitization in adult asthma according to integrin beta3 polymorphisms and Toll-like receptor 2/+596 genotype[J].J Allergy Clin Immunol,2011,128(1):185-191.e7.
[9] Eder W,Klimecki W,Yu L,et al.Toll-like receptor 2 as a major gene for asthma in children of European farmers[J].J Allergy Clin Immunol,2004,113(3):482-8.
[10]何 芳,沈启英,方 磊,等.Toll样受体2介导的高迁移率族蛋白1信号分子在小鼠支气管哮喘中的作用机制[J].中华医学杂志,2014,94(16):1219-22.
[11]Hommes D W,Peppelenbosch M P,van Deventer S J,et al.Mitogen activated protein(MAP)kinase signal transduction pathways and novel anti-inflammatory targets[J].Signal Transduct,2003, 52(1):144-51.
[12]Nath P,Eynott P,Leung S Y,et al.Potential role of c-Jun NH2-terminal kinase in allergic airway inflammation and remodelling:effects of SP600125[J].Eur J Pharmacol,2005,506(3):273-83.
[13]Oltmanns U,Issa R,Sukkar M B,et al.Role of c-jun N-terminal kinase in the induced release of GM-CSF,RANTES and IL-8 from human airway smooth muscle cells[J].Br J Pharmacol,2003,139 (6):1228-34.
[14]林 立,管小俊,李昌崇,等.c-Jun氨基末端激酶磷酸化在支气管哮喘大鼠气道重塑中的作用及糖皮质激素的影响[J].中华结核和呼吸杂志,2010,33(3):188-92.
[15]Fang L,Wu H M,Ding P S,et al.TLR2 mediates phagocytosis and autophagy through JNK signaling pathway in Staphylococcus aureus-stimulated RAW264.7 cells[J].Cell Signal,2014,26(4):806-14.
[16]Watanabe I,Ichiki M,Shiratsuchi A,et al.TLR2-mediated survival of Staphylococcus aureus in macrophages:a novel bacterial strategy against host innate immunity[J].J Immunol,2007,178 (8):4917-25.
Mechanism of c-Jun N-terminal kinase mediated by Toll like receptor 2 in murine asthma
Shen Peiting,Fang Lei,Wu Huimei,et al
(Dept of Geriatric Pulmonary,The First Affiliated Hospital of Anhui Medical University,Geriatric Institute of Anhui Province,Hefei 230022)
AbstractObjective To explore the mechanism of c-Jun N-terminal kinase mediated by Toll like receptor 2 in murine asthma.Methods 14 healthy SPF grade C57 wild-type mice and 14 TLR2 knockout(TLR2-/-)mice were randomly divided into four groups:C57 control group,C57 asthma group,TLR2-/-control group,TLR2-/-asthma group(n=7).We utilized intraperitoneal injection combined with inhalation of ovalbumin(OVA)to sensitize and challenge the mice,thus establishing the experimental models of asthma.Meanwhile,the control group received normal saline instead of OVA.The protein expression of TLR2 was detected by immunohistochemistry(ABC method)in C57 control group and C57 asthma group,as well as JNK and phosphorylation c-Jun(P-JNK)between each group.Results In C57 asthma group,HE-staining showed more obvious inflammatory cell infiltration around bronchi and airway smooth muscle hyperplasia than the other three groups.The relative protein expressions were measured by mean absorbance(mA).Immunohistochemistry indicated that mean absorbance values of TLR2 was significantly higher in C57 asthma group than those of C57 control group(P<0.01).There was no obvious difference of JNK protein expression between each group.The immunoexpression of P-JNK in C57 asthma group was notablely higher than those of C57 control group,TLR2-/-asthma group,TLR2-/-control group(F=43.261,P<0.01).Conclusion TLR2-mediated JNK signaling molecules may be involved in the process of murine asthma.
Key wordsasthma;Toll like receptor 2;c-Jun N-terminal kinase;phosphorylation c-Jun N-terminal kinase;immunohistochemistry
作者简介:沈佩婷,女,硕士研究生;刘荣玉,女,教授,主任医师,博士生导师,责任作者,E-mail:rongyuliu@gmail.com
基金项目:国家自然科学基金(编号:81270082、81170030、81300027);高等学校博士学科点专项科研基金(编号:20113420110006);安徽省重点实验室计划项目(编号:1206c0805028);安徽省科技攻关项目(编号:12010402135)
文献标志码A
文章编号1000-1492(2015)05-0573-04
中图分类号R 562.2+5;Q 241;Q 74

