新辅助放化疗前后低位直肠癌癌旁组织TRAIL的表达情况
王雪平 戴光耀 马亮亮 罗玉贤 赫建平 顾福杭
新辅助放化疗前后低位直肠癌癌旁组织TRAIL的表达情况
王雪平戴光耀马亮亮罗玉贤赫建平顾福杭
【摘要】目的研究肿瘤坏死因子相关凋亡诱导配体( TNF-related apoptosis-inducing ligand,TRAIL)在低位直肠癌癌旁组织新辅助放化疗前后的表达情况。方法选取2011年6月至2013年10月低位直肠癌患者60例,分别于放化疗前活检及放化疗手术后取材癌旁组织,利用免疫组织化学SP法分别检测放化疗前后TRAIL的表达情况。结果新辅助放化疗后TRAIL在癌旁组织的阳性表达率较放化疗前升高40%,差异有统计学意义( P<0.05)。结论TRAIL的表达情况与肿瘤的分期密切相关(经放化疗后肿瘤降期),提示通过检测患者癌旁组织的TRAIL的表达,或有助于判断肿瘤患者的预后。
【关键词】TRAIL;低位直肠癌;新辅助放化疗; TNM分期
作者单位: 050011河北省石家庄市第一医院
TRAIL即肿瘤坏死因子相关凋亡诱导配体。最早由Wiley等[1]在1995年及1996年Pitti等[2]克隆出来并被逐渐认知。TRAIL属TNF超家族成员,TRAIL通过触发caspase级联反应,最终导致程序性细胞凋亡[3]。TRAIL广泛表达于正常人的各种组织,在各种消化道肿瘤中则会出现表达缺失或低表达。如胰腺癌[4]、结直肠癌等。TRAIL作为抑癌基因在直肠正常组织中高表达,而在直肠癌癌旁组织及癌组织中则依次递减,大量试验证明了TRAIL可作为临床新的敏感免疫组化参考指标[1-3],新辅助放化疗的引入,降低了直肠癌局部复发率,同时提高了保肛率,增加了患者的生存时间。新辅助放化疗前后TRAIL在低位直肠癌癌旁组织中的表达情况笔者尚未见国见报道,本文就我院相关研究报告如下。
1 资料与方法
1.1一般资料选取我院2011年6月至2013年10月低位直肠癌患者60例,其中男33例,女27例;年龄19~80岁,平均年龄58.5岁。患者入组前身体状况整体评估可行新辅助放化疗,活检病理限定为T3期中分化腺癌,同时满足影像及腔内超声双重检查均提示无远处脏器转移之条件,分别于同步放化疗前后取材癌旁组织(指距病灶2 cm的组织),并分别检测放化疗前后癌旁组织中TRAIL的表达水平。
1.2标本制备及主要试剂活检组织离体后用蒸馏水立刻清洗迅速取材。取材后即刻固定于10%中性甲醛溶液中。鼠抗人TRAIL抗体购于美国Santa Cruz公司;鼠及兔SPN免疫组化试剂盒、DAB试剂盒购于中国中山公司。
1.3方法
1.3.1免疫组化SP法: TRAIL出现概率:细胞浆明显小于细胞核,TRAIL阳性是细胞浆和细胞核内出现棕黄色颗粒。参照Wiley等[1,5]的方法进行全面评估,即包括染色强度和染色范围,即在每个视野中,计数要超过500个细胞并对细胞染色的强度进行半定量分析。采用奥林巴斯显微镜40×50观察组织图像,并通过摄像头和数字化的软件对产生免疫反应的组织总面积进行定量分析,通过反应的程度(范围)和强度计算,最终以染色强度及范围的乘积确定得分; TRAIL的阳性率,染色程度即TRAIL阳性染色所百分率。TRAIL阳性参照则采用已知阳性切片,阴性参照则以PBS替换一抗。抗体浓度TRAIL为1∶50,以PBS溶液代替一抗做空白对照,操作按照试剂盒说明逐步进行。
1.3.2放疗:患者于模拟定位机以俯卧位定位,直肠内冲入造影剂80~120 ml,显影后观察直肠以上肠段有无癌瘤发生,首先确定各边界范围。野前缘达膀胱后壁,野后缘达骨外0.5 cm,后野达骨盆外1.0 cm,下界达会阴,上界达骶1,放疗剂量45 Gy/20~25次,缩野时追加10~15 Gy。放疗时间一般为5周左右。期间考虑放疗的不良反应,根据副作用的强度决定放疗的具体时间。如果期间有空白放疗期则顺延放疗时间。
1.3.3化疗:根据NCCN指南,每日据体表面积计算用药剂量,口服卡培他滨1 250 mg/m2,2次/d,7周左右。根据服药后的药物耐受情况随时调整卡培他滨片(希罗达)的剂量。如出现剧烈恶心、顽固腹泻等情况则对症治疗无效时减少药物剂量,
此次试验中未发生因各种原因而中途离组情况,
仅有少量患者出现轻度放化疗不良反应,经积极对症治疗后顺利完成放化疗,期间未介入其他治疗,如生物治疗、中医药治疗等。
1.4结果判定免疫组化根据染色反应的深度及阳性细胞的数量分别记分为0~3分,其中染色深度以多数细胞的呈色反应为准。浅黄色为1分,棕黄色为2分,棕褐色为3分,不着色为0分。阳性细胞数<10% 为0分,10%~45%为1分,46%~70%为2分,>70%为3分,并根据这两项指标的积分数分为4级,即阴性(-)为0分,弱阳性( + )为2分,阳性( + + )为3~4分,强阳性( + + + )为5~6分。
1.5统计学分析应用SPSS 11.5统计软件,计量资料以珋x±s表示,采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1新辅助放化疗后TRAIL在癌旁组织的表达率比较放化疗前TRAIL阳性率20% ( 12/60),放化疗后TRAIL阳性率60%( 36/36),较放化疗前升高40%( P <0.05)。
2.2免疫组化各组组织化学评分分级及例数见表2。
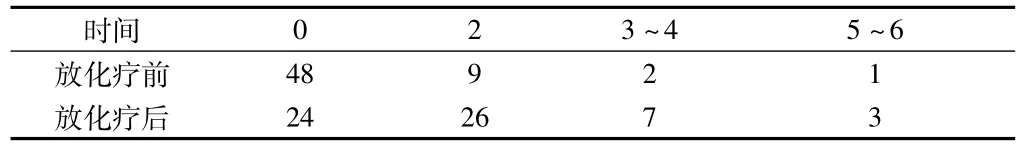
表2 TRAIL表达情况参数分级 n =60,例
2.3放化疗前后TRAIL组化染色见图1。
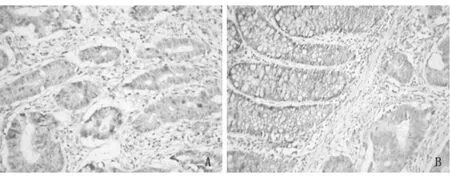
图1 TRAIL在直肠癌旁组织放化疗前后的活检表达情况(免疫组化×2000)
3 讨论
直肠癌包括于大肠癌之中,目前大肠癌的患病率及死亡率全球每年2%的速度上升,直肠恶性肿瘤的出现是多环节、多因素的复杂过程。大量研究汇总分析提示,电子结直肠镜下腺瘤至癌就需要五年左右的时间[6]。早期癌多数情况下是可以达到临床治愈的,而早期直肠癌可无明显的临床症状。传统的影像检测有局限性如辐射,癌灶小时则易漏诊,肠镜则较为痛苦,且需要肠道准备,多有不便。因此临床需要一种较为敏感的检测指标,同时又简便易行。研究显示TRAIL在直肠癌、癌旁组织及正常直肠黏膜组织中呈递增的表达趋势,提示直肠癌的发生发展过程中存在TRAIL的缺失,TRAIL能作用各种肿瘤细胞,可明显诱导肿瘤细胞的凋亡,与此同时,其对正常细胞则未发现有细胞毒性,其不依赖于p53的诱导凋亡模式,也迥异于放化疗所导致的肿瘤细胞的凋亡,因此其制剂对化疗耐药的癌瘤亦是有其特定的临床应用的可行性。TRAIL的免疫组织化学SP法研究广泛而彻底,临床验证其可靠性高,并且较为敏感,可以作为直肠癌检测的灵敏指标。
新辅助放化疗作为降低肿瘤分期的有效方法,在临床上应用广泛,其能增加肿瘤手术切除的机率,尤其是直肠癌局部放疗能明显降低局部的复发率。但有研究显示单纯的新辅助放疗并不能有效提高生存率。
NCCN指南中系统阐述了术前放化疗(新辅助放化疗)的积极意义[7],关于新辅助放化疗的研究验证了其临床获益性[6-8],值得一提的是目前关于TRAIL制剂联合放化疗的治疗新模式也被提出,Nagane等[9]试验证实了化疗联合TRAIL降低了耐药性,显示了二者联合应用的优势及临床价值,Marini等[10]研究得出,放疗所致的电离辐射可使多种消化道、腺体等的癌细胞对TRAIL显示更高的敏感性。关锋等[11]则具体就肿瘤坏死因子与单纯放疗进行了系统的研究。TRAIL联合放疗也是一新的诊疗模式。
本文针对低位直肠癌进行了TRAIL与新辅助放化疗相关的临床研究,通过新辅助放化疗前后检测癌旁组织中TRAIL的表达情况,新辅助放化疗提高了其阳性表达率,但弱阳性者居多,考虑短期内基因活化不足,可能存在放化疗对于细胞活性及功能的影响,同时放化疗后出现的放射性皮炎及膀胱炎、肠道功能紊乱、性功能障碍,化疗性静脉炎,化疗产生的全身不适如酸痛、恶心、腹泻等诸多不良反应,糖尿病[12]、激素紊乱等体质因素等。使部分患者不能坚持规律治疗也影响结果判定,因此需进一步深入研究其机制。以期发现新辅助放化疗与抑癌基因生物治疗的契合点。
参考文献
1Wiley SR,Schooley K,Smolak PJ,et al.Identification and characterization of a new member of the TNF family that induces apoptosis.Immunity,1995,3: 673-682.
2Pitti RM,Marsters SA,Ruppert S,et al.Induction of apoptosis by Apo-2 ligand,a new member of the tumor necrosis factor cytokine family.J Boil Chem,1996,271: 12687-12690.
3Playing the DISC: Turning on TRAIL death receptor-mediated apoptosis in cancer,Bodva l Pennarun,Annemieke Meijer,Elisabeth G.E.de Vries,Biochimica et Biophysica Acta ( BBA).Reviews on Cance,2010,182: 123-140.
4Dominic S,Andrea M,Caroline R.TRAIL-Induced Apoptosis Is Preferentially Mediated via TRAIL Receptor 1 in Pancreatic Carcinoma Cells and Profoundly Enhanced by XIAP Inhibitors.Clin Cancer Res December,
2010,16: 5734-5749.
5Engelen SM,Beets-Tan RG,Lahaye MJ,et al.MRI after chemoradiotherapy of rectal cancer: a useful tool to select patients for local excision.Dis Colon Rectum,2010,53: 979-986.
6Twu CM,Wang HM,Chen JB,et al.Neoadjuvant concurrent chemoradiotherapy in treating locally advanced rectalcancer.J Chin Med Assoc,2009,72 : 179-182.
7Clinical practice guidelines of rectal cancer 2011vll.Available at http: / / www.nccn.org/professionals/physician_gls/PDF/rectal.pdf.
8Gérard JP,Azria D,Gourgou-Bourgade S,et al.Comparison of two neoadjuvant chemoradiotherapy regimens for locally advancedrectal cancer: results of the phaseⅢtrial ACCORD 12/0405Prodige 2.J Clin Oncol,2010,28: 1638-1644.
9Nagane M,Pan GH,Weddle JJ,et al.Increased death receptor 5 expression by chemotherapeutic agentsin human gliomas causes synergistic cytotoxicity with tumor necrosis factor related apoptosis—inducing ligandin vitro and in vivo E.Cancer Res,2000,60: 847-853.
10Marini P,Schmid A,Jendrossek V,et al.Irradiation specifically sensitizes solid tumour cell lines to TRAILm ediated apoptosis.BMc Cancer,2005,5: 5.
11关锋,龚平生,王志成,等.肿瘤坏死因子相关凋亡配体在肿瘤放射治疗中的作用.中华放射医学与防护杂志,2014,34: 231-234.
12宋春法,王贵英.腹腔镜与开腹结直肠癌合并2型糖尿病患者术后炎症的对比分析.河北医科大学学报,2013,34: 1384-1386.
·论著·
收稿日期:( 2013-12-30)
doi:10.3969/j.issn.1002-7386.2015.04.014
【中图分类号】R 735.37
【文献标识码】A
【文章编号】1002-7386( 2015) 04-0522-03

