淫羊藿苷预防给药对快速老化小鼠SAMP8学习记忆能力及脑组织线粒体氧化应激的影响
张晓菲,路 畅,贺晓丽,毕明刚(中国医学科学院药用植物研究所药理毒理中心,北京 100193)
淫羊藿苷预防给药对快速老化小鼠SAMP8学习记忆能力及脑组织线粒体氧化应激的影响
张晓菲,路畅,贺晓丽,毕明刚
(中国医学科学院药用植物研究所药理毒理中心,北京100193)
中国图书分类号: R-332; R284.1; R322.81; R338. 64; R339. 38; R977. 12
摘要:目的考察淫羊藿苷(icariin,ICA)预防给药对快速老化小鼠SAMP8学习记忆能力及脑组织线粒体氧化应激的影响。方法选择即将出现学习记忆障碍的6月龄快速老化小鼠SAMP8为实验对象,随机分为模型组、ICA组(75,150 mg·kg-1)、阳性药己烯雌酚组和雌激素受体抑制剂ICI182780联合ICA高剂量(150 mg·kg-1)组,以同月龄抗快速老化小鼠SAMR1为正常对照。预先灌胃给药8周,用Morris水迷宫和跳台行为学实验检测ICA预防给药对SAMP8小鼠学习记忆能力的影响。提取脑线粒体,通过测定脑组织线粒体内活性氧(ROS)水平、脂质过氧化物(MDA)含量、还原性谷胱甘肽GSH含量和过氧化氢酶(CAT)的活力,研究ICA预防给药对SAMP8小鼠脑组织线粒体氧化应激的影响。结果ICA预防给药可以明显改善SAMP8小鼠的定位航行能力以及空间探索能力,提高其在跳台实验中的被动回避条件反射能力,减少SAMP8小鼠脑组织线粒体ROS水平和MDA含量,增加GSH含量,但对CAT活性作用不明显。ICA和ICI182780联合给药后,与ICA单独给药组相比,ICA对SAMP8小鼠学习记忆能力的改善作用明显降低,对脑组织线粒体氧化应激的改善作用变化不大。结论ICA预防给药可明显改善快速老化小鼠SAMP8学习记忆能力及脑组织线粒体氧化应激的水平,其改善学习记忆能力的作用机制可能与其植物雌激素样作用有关,其对脑组织线粒体发挥抗氧化应激的作用可能与雌激素受体无关。
关键词:淫羊藿苷;快速老化小鼠;学习记忆;线粒体;氧化应
网络出版时间:2015-6-5 11:22网络出版地址: http://www.cnki.net/kcms/detail/34.1086.R.20150605.1122.008.html
贺晓丽(1982-),女,博士,副研究员,研究方向:神经药理学和抗肿瘤药理学,共同通讯作者,E-mail: xlhe@ implad.ac.cn;
毕明刚(1970-),男,博士,研究员,博士生导师,研究方向:神经药理学和抗肿瘤药理学,通讯作者,E-mail: mgbi @ implad.ac.cn激;雌激素样作用;雌激素受体抑制剂
阿尔茨海默病(Alzheimer’s disease,AD)是以渐进性认知功能障碍为主要临床表现的神经退行性疾病,其发病机制十分复杂,迄今为止尚不明确。流行病学研究表明,绝经女性AD的发病率明显高于同龄男性1. 5~3. 0倍[1]。线粒体是真核生物细胞的重要细胞器,是细胞的产能中心、代谢中心和凋亡中心。近年来,AD病人线粒体功能的异常逐渐被人们所重视。AD中的氧化应激损伤、能量代谢缺陷以及钙离子稳态失衡等都与线粒体密切相关。
淫羊藿苷(icaritin,ICA)为小檗科淫羊属植物淫羊藿的主要活性成分,具有雌激素样作用[2]。本课题组前期研究表明,ICA可明显改善增龄SAMP8小鼠和去卵巢SAMP8小鼠定位航行和空间搜索学习记忆障碍,明显提高去卵巢SAMP8小鼠大脑皮层的抗氧化能力;并且ICA改善SAMP8学习记忆功能与升高血清E2水平有关[3-5]。在此基础上,本文选择即将出现学习记忆障碍的6月龄SAMP8小鼠为模型鼠,以同月龄SAMR1为正常对照,预先给予已确证具有雌激素样生物活性的淫羊藿苷,以雌激素受体拮抗剂为工具药,进一步探讨淫羊藿苷预防给药对快速老化小鼠SAMP8学习记忆能力及脑线粒体氧化应激的影响。
1 材料
1.1动物SAMP8小鼠及其正常对照SAMR1小鼠由中国科学院遗传与发育生物学研究所陈清轩教授惠赠,在本所SPF级动物房饲养繁殖。本实验选择6月龄♀小鼠用于实验。
1.2药品与试剂ICA(纯度>98%)购于南京泽朗医药科技有限公司,雌激素受体抑制剂ICI182780购于英国Tocris公司,己烯雌酚(diethylstibestrol,DES)购于大连美仑生物技术有限公司,考马斯亮蓝蛋白定量试剂盒为北京普利莱基因技术有限公司产品,活性氧(ROS)检测试剂盒购于碧云天生物技术有限公司,丙二醛(MDA)、微量还原型谷胱甘肽(GSH)、过氧化氢酶(CAT)测试盒购自南京建成生物工程研究所。
1.3仪器Morris水迷宫和小鼠跳台仪STT-2均由中国医学科学院药物研究所研制,高速冷冻台式离心机(Sorvall ST-16R)由德国Thermo公司生产,酶标仪由美国BIOTEK公司生产,EPS-1201型便携式电子天平由长沙湘平科技发展有限公司生产。
2 方法
2.1动物分组及给药将6月龄♀SAMP8小鼠按体重随机分为5组,分别为模型组、ICA组(75,150 mg·kg-1)、阳性药己烯雌酚DES组(0. 2 mg· kg-1)和雌激素受体抑制剂联合ICA高剂量(150 mg·kg-1)组,每组8只。以同月龄♀SAMR1小鼠为正常对照。雌激素受体抑制联合ICA高剂量组腹腔注射雌激素受体抑制剂ICI182780(1 mg· kg-1)1 h后灌胃给予ICA(150 mg·kg-1),SAMP8模型组和SAMR1组对照组给同体积生理盐水。灌胃给药,每天给药1次,连续给药8周,分别在给药前和给药8周后进行行为学实验。
2.2 Morris水迷宫实验[6]Morris水迷宫主要由一金属圆柱形水池(池高60 cm,直径120 cm)和自动显示、监测、记录装置及安全岛(直径10 cm的平台)组成。预先在水迷宫内注入清水,使水高出平台1 cm,水温控制在(23±2)℃,在水池边缘上等距离设置4个标记点,将水池均分为4个象限,将平台置于第一象限。定位航行实验(place navigation test)中,每只动物每天训练1次,持续进行5 d。训练时将动物面朝池壁轻轻放入水中,同时启动记录装置,电脑自动记录小鼠找到平台的潜伏期。如果小鼠在入水后2 min内没有找到平台,需要实验者将其引领于平台上放置20 s,引导其学习。
空间搜索实验(spatial probe test)在定位航行实验结束后进行,撤去第一象限的平台,从相同的入水点将小鼠面向池壁放入水中,测定其在120 s内穿越平台的次数、平台所在象限停留时间和第1次穿越平台的时间。
2.3跳台实验[6]小鼠跳台测试箱由5个小隔间组成,一次可同时测试5只动物,隔间内有1个橡胶平台,底部铜栅可通电。d 1训练时,将小鼠在隔间内适应2 min,通电3 min,小鼠被电击时跳上平台,24 h后,将小鼠头朝角落放置平台上,秒表记录小鼠第1次跳到电栅上受到电击的时间记为潜伏期,观察小鼠在5 min内跳下平台的次数记为错误次数。
2.4脑线粒体的分离参照本实验室建立的方法[7],采用差速离心的方法制备脑线粒体。水迷宫实验结束后,断头处死小鼠,迅速在冰盘上取出脑组织,去除小脑和脑干。置于预冷的小烧杯中,用冰冷的分离缓冲液冲洗3次,剥去血管,去除淤血,用小剪刀将脑组织剪成碎块。将脑组织转入玻璃匀浆器中,每克脑组织按照1∶10比例加入分离缓冲液(250 mmol·L-1蔗糖,10 mmol·L-1Tris-HCl,1 mmol·L-1EDTA,0. 2% BSA,pH 7. 4),冰浴中手动匀浆10次。所得匀浆液以700×g离心10 min,取上清液以10 000×g离心10 min,所得沉淀即为线粒体。以分离缓冲液将所得沉淀洗涤一次(离心10 000×g,10 min)。将线粒体沉淀悬于分离缓冲液中,调整蛋白浓度为20~25 g·L-1。整个线粒体制备过程均在4℃进行。脑线粒体蛋白浓度测定采用Bradford法。
2.5脑组织线粒体内氧化应激水平的测定通过测定脑组织线粒体内活性氧(ROS)水平、脂质过氧化物(MDA)含量、还原性谷胱甘肽(GSH)含量和过氧化氢酶(CAT)的活力来反映SAMP8小鼠脑线粒体氧化应激的变化。将分离得到的线粒体,-80℃冷藏待用。测定时,各指标均按试剂盒说明书方法操作。
3 结果
3.1 ICA预防给药对SAMP8小鼠空间辨别学习记忆能力的影响Morris水迷宫实验是一种在行为神经科学中测定小动物空间定向和学习记忆的经典研究方法,可反映动物的空间辨别学习记忆能力。给药前对各组动物进行的Morris水迷宫的实验结果表明,经过5 d的训练,各组小鼠的潜伏期均表现出缩短的趋势,然而各组小鼠的潜伏期、目标象限的停留时间、目标象限的穿越次数和第1次到达平台的时间均没有变化(P>0. 05),说明6月龄SAMP8小鼠未出现明显的学习记忆障碍。结果见Tab 1和Fig 1。
给药8周后,Morris水迷宫结果显示,定位航行实验中,随着训练次数和实验天数的增加,各实验组小鼠潜伏期均表现为缩短趋势。d 1,各组动物差异无显著性;自实验d 2开始,与SAMR1组小鼠相比,SAMP8组小鼠逃避潜伏期明显延长(P<0. 05,P<0. 01),各给药组小鼠与SAMP8组小鼠相比潜伏期明显缩短(P<0. 05,P<0. 01)。实验d 5,雌激素受体抑制剂联合ICA高剂量组(ICI-ICA)小鼠与ICA高剂量组(ICA-H)小鼠相比,潜伏期明显延长(P<0. 05)。见Tab 2。
Tab 1 Place navigation test in SAMP8 mice before icariin administration(±s,n =8)

Tab 1 Place navigation test in SAMP8 mice before icariin administration(±s,n =8)
Group Escape latency/s day 1 day 2 day 3 day 4 day 5 SAMR1 89.46±10.82 50.32±24.84 42.62±17.63 34.2±17.76 28.59±14.28 SAMP8 83.16±16.45 59.91±17.38 50.45±11.74 36.88±18.19 26.45±15.55 DES 77.48±14.36 57.75±17.50 47.23±14.64 26.75±11.37 21.15±12.64 ICA-L 78.28±13.09 51.32±16.88 43.34±13.74 29.62±16.15 25.37±15.10 ICA-H 75.36±13.92 46.12±17.39 38.35±17.09 25.53±18.41 24.54±14.10 ICI-ICA 80.15±19.83 50.53±22.03 39.64±20.8538.02±14.78 26.29±10.54

Fig 1 Spatial probe test in SAMP8 mice before icariin administration(±s,n =8)A: Time in target quadrant; B: Crossing times; C: The first time through platform.
Tab 2 Effect of preventive administration of icariin on place navigation test in SAMP8 mice after 8 weeks(±s,n =8)

Tab 2 Effect of preventive administration of icariin on place navigation test in SAMP8 mice after 8 weeks(±s,n =8)
Group Escape latency/s day 1 day 2 day 3 day 4 day 5 SAMR1 57.33±10.28 36.70±17.61 25.78±10.58 24.02±9.11 26.13±8.32 SAMP8 62.13±11.76 57.30±15.83# 48.66±17.18## 46.16±10.16## 44.92±8.91##DES 61.75±12.24 32.96±9.87* 22.04±12.21** 28.59±9.75** 17.30±5.67**ICA-L 60.84±13.67 39.87±13.22* 31.41±9.98* 28.41±7.76* 30.38±8.07*ICA-H 61.41±14.15 41.60±19.17* 37.91±8.70 32.82±7.15* 16.57±6.38**ICI-ICA 56.71±11.24 45.78±10.54 32.75±11.89 33.67±10.60* 33.11±11.10*★#P<0.05,##P<0.01 vs SAMR1 group;*P<0.05,**P<0.01 vs SAMP8 group,★P<0. 05 vs ICA-H group.

Fig 2 Effect of preventive administration of icariin on spatial probe test in SAMP8 mice after 8 weeks(±s,n =8)A: Time in target quadrant; B: Crossing times; C: The first time through platform.#P<0.05 vs SAMR1 group,*P<0.05,**P<0.01 vs SAMP8 group;★P<0.05,★★P<0.01 compared with ICA-H group.
在空间探索实验中,与SAMR1组小鼠相比,SAMP8组小鼠的空间搜索能力下降,表现为在目标象限的停留时间缩短,穿越平台的次数明显减少(P <0. 05),第1次穿越平台的时间明显延长(P<0. 05)。ICA低、高剂量组给药8周后,可不同程度的提高SAMP8小鼠在Morris水迷宫中的空间探索能力(P<0. 05,P<0. 01)。雌激素受体抑制剂联合ICA高剂量组(ICI-ICA)小鼠与ICA高剂量组(ICAH)小鼠相比,穿越平台的次数减少(P<0. 05),第1次穿越平台的时间明显增加(P<0. 01),说明ICA改善SAMP8小鼠空间辨别学习记忆能力可能与其植物雌激素样作用有关。见Fig 2。3.2 ICA预防给药对SAMP8小鼠被动回避条件反射能力的影响跳台实验是利用鼠类好探索习性而设计,属于被动回避性条件反射。与SAMR1组小鼠相比,SAMP8组小鼠跳下平台的次数明显增多(P<0. 05)。与SAMP8组小鼠相比,灌胃给予DES 和ICA后,均可明显减少SAMP8小鼠受到电击的错误次数(P<0. 05,P<0. 01),明显延长第1次跳下平台的时间(P<0. 05)。雌激素受体抑制剂联合ICA高剂量组(ICI-ICA)小鼠与ICA高剂量组(ICAH)小鼠相比,受到电击的错误次数增加,第1次跳下平台的时间明显缩短(P<0. 01),同样说明ICA改善SAMP8小鼠被动回避条件反射能力可能与其植物雌激素样作用有关。见Fig 3。

Fig 3 Effect of preventive administration of icariin on step-down passive test in SAMP8 mice after 8 weeks(±s,n =8)#P<0.05 vs SAMR1 group;*P<0.05,**P<0.01 vs SAMP8 group;★★P<0.01 vs ICA-H group.
3.3 ICA预防给药对SAMP8小鼠脑组织线粒体氧化应激水平的影响通过测定脑组织线粒体内活性氧(ROS)水平、脂质过氧化物(MDA)含量、还原性谷胱甘肽GSH含量和过氧化氢酶(CAT)的活力来反映SAMP8小鼠脑线粒体氧化应激的变化。实验结果表明,与SAMP8组小鼠相比,各给药组小鼠脑线粒体内活性氧水平和MDA含量明显降低(P< 0. 05,P<0. 01),尤其ICA高剂量组能非常明显的降低SAMP8小鼠脑组织线粒体活性氧水平(P<0. 01)。与SAMP8组小鼠相比,各给药组小鼠脑线粒体内GSH含量均升高,其中DES组可以明显提高SAMP8鼠脑线粒体内GSH含量(P<0. 05),ICA低、高剂量对脑组织线粒体GSH含量的影响不大。各实验组小鼠脑组织线粒体CAT活性差异均无显著性(P>0. 05)。见Tab 3。
Tab 3 Preventive administration of icariin decreased ROS,MDA levels but increased GSH content in brain mitochondria of SAMP8 mice after 8 weeks(±s,n =5)
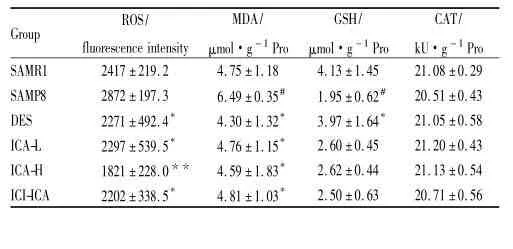
Tab 3 Preventive administration of icariin decreased ROS,MDA levels but increased GSH content in brain mitochondria of SAMP8 mice after 8 weeks(±s,n =5)
#P<0. 05 vs SAMR1 group;*P<0.05,**P<0.01 vs SAMP8 group.
ROS/MDA/GSH/CAT/Group fluorescence intensityμmol·g-1Proμmol·g-1ProkU·g-1Pro SAMR1 2417±219.2 4.75±1.18 4.13±1.45 21.08±0.29 SAMP8 2872±197.3 6.49±0.35# 1.95±0.62# 20.51±0.43 DES 2271±492.4* 4.30±1.32* 3.97±1.64* 21.05±0.58 ICA-L 2297±539.5* 4.76±1.15* 2.60±0.45 21.20±0.43 ICA-H 1821±228.0** 4.59±1.83* 2.62±0.44 21.13±0.54 ICI-ICA 2202±338.5* 4.81±1.03*2.50±0.63 20.71±0.56
4 讨论
随着老龄化社会的来临,AD的防治与治疗已成为当今社会研究的热点。目前AD治疗的一线药物多是通过增强胆碱能系统功能而改善患者的认知和记忆障碍胆碱酯酶抑制剂[8],如多奈哌齐、石杉碱甲等[9]。淫羊藿苷为淫羊藿的主要活性成分,最近有研究报道ICA体内代谢产物淫羊藿素(icaritin,ICT)体外试验发现对β淀粉样蛋白诱导的大鼠原代神经元细胞损伤具有保护作用[10];体内试验发现,ICA可通过其抗氧化活性和减少海马中Aβ1-40的含量的作用,改善铝中毒诱导的大鼠学习记忆障碍[11]。淫羊藿黄酮和ICA还可以明显缩短APP转基因小鼠在Morris水迷宫的潜伏期和游泳距离提高其在物体识别实验中的分辨指数等[12],提示ICA可能成为潜在的治疗老年痴呆的候选药物。快速老化模型小鼠SAMP8是目前公认的有效的研究老年痴呆的动物模型,其行为学表现和病理学特征与人类AD的临床症状及其复杂的神经系统病理学改变十分相似,在渡过生长期后(4-6月),伴快速老化自然发生,出现早期增龄性学习记忆缺陷,脑内具有多种与AD类似的病理变化及生化代谢异常[13]。结合本课题组前期研究基础,本文选用未出现明显老龄化的6月龄SAMP8小鼠,预防给予已确证具有雌激素样生物活性的淫羊藿苷,以雌激素受体拮抗剂为工具药,探究ICA对AD的预防作用及其作用机制。
学习记忆是脑的高级功能,是在中枢神经系统控制下的极其复杂的过程,特别是近期记忆能力的下降是脑衰老的一个重要表现。因此,有关抗AD的药物对学习记忆影响的研究多始于行为学实验。本实验采用了目前使用较常用的Morris水迷宫以及跳台方法对SAMP8小鼠的空间学习记忆能力进行了观察研究。Morris水迷宫是一种在行为神经科学中测定小动物空间定向和学习、记忆的研究方法。经典的Morris水迷宫测试程序主要包括定位航行试验和空间探索实验两个部分[14]。跳台实验是利用鼠类好探索习性而设计,属于被动回避性条件反射。研究结果表明,与SAMR1相较,SAMP8组小鼠空间学习记忆能力减退,定位航行试验中潜伏期延长;空间探索试验中,穿越平台次数减少、在平台象限停留时间缩短,且被动反应能力下降。ICA预防给药8周可以明显改善SAMP8的空间学习记忆能力,提高被动反应能力。然而腹腔注射雌激素受体抑制剂ICI182780后再给予ICA,发现ICA对SAMP8小鼠学习记忆能力和被动反应能力的改善作用明显降低,说明雌激素受体抑制剂ICI182780可以抑制ICA的作用,进一步证明ICA对学习记忆的影响与其雌激素样作用相关。
氧化应激在AD的发生和发展中具有重要作用,过度的氧化应激不仅可以直接损伤细胞膜、RNA和蛋白质,同时还可促进神经细胞凋亡的发生。线粒体被认为是细胞内产生ROS的重要部位,氧在线粒体内被消耗利用,通过氧化磷酸化产生的活性氧是体内氧自由基的主要来源[15]。在生理条件下,由于体内同时存在强大的自由基清除系统(如: SOD、GSH-Px、CAT、NADP/NADPH、GSH),使ROS处于产生和清除的动态平衡。衰老或AD病人体内这种平衡被打破,ROS大量聚集,线粒体的功能结构域暴露于高浓度的ROS下,造成线粒体损伤,细胞功能损伤以及凋亡[16]。雌激素通过调节生成活性氧的呼吸链复合物Ⅰ和呼吸链复合物Ⅲ[17],增加各种抗氧化剂酶,包括过氧化物酶-V、谷氧还蛋白和Mn-SOD的表达等[18],降低活性氧的生成,改善氧化应激。基于线粒体在氧化应激中的重要地位,我们推测脑组织线粒体氧化应激指标比检测脑组织匀浆氧化应激指标更能准确反映氧化应激程度。实验结果发现,SAMP8小鼠脑组织出现比较明显的线粒体氧化应激损伤,ICA预防给药后SAMP8小鼠脑组织线粒体内活性氧ROS和丙二醛MDA含量降低,还原型谷胱甘肽GSH含量升高,而过氧化氢酶CAT活性变化不大,证明ICA具有一定的线粒体保护作用,可改善SAMP8小鼠脑组织线粒体氧化应激。给予雌激素受体抑制剂后ICA对脑线粒体氧化应激的改善作用变化不大,说明ICA发挥抗氧化应激的作用可能与雌激素受体无关,其具体作用靶点与机制需要进一步探究。
总之,ICA预防给药可明显改善快速老化小鼠SAMP8学习记忆能力及脑组织线粒体氧化应激的水平。ICA预防给药发挥改善学习记忆的机制可能与其植物雌激素样作用有关,在改善学习记忆功能和治疗老年痴呆方面有较好的应用前景,其对脑组织线粒体发挥抗氧化应激的作用机制可能与雌激素受体无关,需要进一步深入研究。
参考文献:
[1]杨期东,周琳.中国阿尔茨海默病的流行病学特征[J].中国临床康复,2004,8(31): 6982-3.
[1]Yang Q D,Zhou L.Epidemiological characteristics of Alzheimer disease in China[J].Chin J Clin Rehab,2004,8(31):6982-3.
[2]赵丕文,王大伟,王玲巧,等.用小鼠子宫增重法筛选淫羊藿等10种中药雌激素样作用的实验研究[J].北京中医药大学学报,2006,29(10): 686-9.
[2]Zhang P W,Wang D W,Wang L Q,et al.Screening of ten kinds of Chinese herbal drugs including Herba Epinedii with estrogenic effects by uterus growth test in mice[J].J Beijing Univ Tradit Chin Med,2006,29(10): 686-9.
[3]周伟勤,邓景岳,毕明刚,等.淫羊藿苷改善快速老化小鼠SAMP8学习记忆功能及与血清雌激素水平相关性研究[J].中国实验方剂学杂志,2009,15(9): 38-41.
[3]Zhou W Q,Deng J Y,Bi M G,et al.Correlation between effect of icariin on learning and memory and level of estradiol in serum in senescence accelerated mouse prone 8[J].Chin J Exp Tradit Med Form,2009,15(9): 38-41.
[4]刘东华,吴满刚,毕明刚,等.淫羊藿苷对去卵巢快速老化(SAMP8)小鼠学习记忆及皮层氧化应激的影响[J].军医进修学院学报,2010,31(6): 580-3.
[4]Liu D H,Wu M G,Bi M G,et al.Effect of icariin on learning and memory,cortex oxidative stress in ovarietomized senescenceaccelerated prone/8 female mice[J].J Chin PLA Postgrad Med Sch,2010,31(6): 580-3.
[5]He X L,Zhou W Q,Bi M G,et al.Neuroprotective effects of icariin on memory impairment and neurochemical deficits in senescence-accelerated mouse prone 8(SAMP8)mice[J].Brain Res,2010,1334: 73-83.
[6]高琳娜,唐千淇,贺晓丽,等.淫羊藿苷对快速老化小鼠SAMP10学习记忆能力以及胆碱能系统活性的影响[J].中国中药杂志,2012,37(14): 2117-21.
[6]Gao L N,Tang Q Q,He X L,et al.Effect of icariin on learning and memory abilities and activity of cholinergic system of senescence-accelerated mice SAMP10[J].Chin J Chin Mater Med,2012,37(14): 2117-21.
[7]贺晓丽,毕明刚,杜冠华.慢性脑缺血大鼠脑组织线粒体蛋白质组与能量代谢相关性研究[J].中国药理学通报,2012,28(9): 1200-5.
[7]He X L,Bi M G,Du G H.Brain mitochondria proteome and energy metabolism in rats after chronic cerebral hypoperfusion[J].Chin Pharmacol Bull,2012,28(9): 1200-5.
[8]Hartmann J,Kiewert C,Duysen E G,et al.Choline availability and acetylcholine synthesis in the hippocampus of acetylcholinesterase-deficient mice[J].Neurochem Int,2008,52(6): 972-8.
[9]Liang Y Q,Tang X C.Comparative effects of huperzine A,donepezil and rivastigmine on cortical acetylcholine level and acetylcholinesterase activity in rats[J].Neurosci Lett,2004,361(1-3): 56-9.
[10]Wang Z,Zhang X,Wang H,et al.Neuroprotective effects of icaritin against beta amyloid-induced neurotoxicity in primary cultured rat neuronal cells via estrogen-dependent pathway[J].Neuroscience,2007,145(3): 911-22.
[11]Luo Y,Nie J,Gong Q H,et al.Protective effects of icariin against learning and memory deficits induced by aluminium in rats [J].Clin Exp Pharmacol Physiol,2007,34(8): 792-5.
[12]楚晋,李林,叶翠飞,等.淫羊藿黄酮对APP转基因痴呆小鼠学习记忆及β-amyloid生成的影响[J].中国科学技术大学学报,2008,38(4): 439-48.
[12]Chu J,Li L,Ye C F,et al.Effects of epimedium flavonoids on learning-memory ability and development of β-amyloid of APP transgenic mice[J].J Univ Sci Tech Chin,2008,38(4): 439-48.
[13]Miyamoto M.Characteristics of age-related behavioral changes in senescence-accelerated mouse SAMP8 and SAMP10[J].Exp Gerontol,1997,32(1-2):139-48.
[14]D'Hooge R,De Deyn P P.Applications of the Morris water maze in the study of learning and memory[J].Brain Res Brain Res Rev,2001,36(1): 60-90.
[15]Du G,Mouithys-Mickalad A,Slues F E.Generation of superoxide anion by mitochondria and impairment of their functions during anoxia and reoxygenation in vitro[J].Free Radic Biol Med,1998,25(9):1066-74.
[16]Naoi M,Maruyama W,Shamoto-Nagai M,et al.Oxidative stress in mitochondria: decision to survival and death of neurons in neurodegenerative disorders[J].Mol Neurobiol,2005,31(1-3): 81-93.
[17]Bor'ras C,Gámbini J,Gomez-Cabrera M C,et al.17 beta-estradiol up-regulated,antoxidant enzyme expression via the ERK1 and ERK2[MAPK]/NFkappaB cascade[J].Aging Cell,2005,4(3): 113-8.
[18]Nilsen J,Irwin R W,Gallaher T K,et al.Estradiol in vivo regulation of brain mitochondrial proteome[J].J Neurosci,2007,27(51): 14069-77.
Effect of preventive administration of icariin on learning and memory abilities and brain mitochondrial oxidative stress in SAMP8
ZHANG Xiao-fei,LU Chang,HE Xiao-li,BI Ming-gang
(Research Center for Pharmacology and Toxicology,Institute of Medicinal Plant Development,Chinese Academy of Medical Sciences and Peking Union Medical College,Beijing 100193,China)
Abstract:Aim To investigate the effect of preventive administration of icariin on learning and memory abilities and brain mitochondrial oxidative stress in senescence-accelerated mouse prone8(SAMP8).Methods
The 6-month-old SAMP8 mice were randomly divided into the SAMP8 model group,ICA groups(75,150 mg·kg-1),the positive Diethylstilbestrol(DES)group and estrogen receptor inhibitor ICI182780 combined with ICA(150 mg·kg-1)group,with 8 mice in each group.8 same month old SAMR1 mice were selected as the normal control group.After oral administration for 8 weeks,Morris water maze test and stepdown passive test were used to investigate the effects of preventive administration of ICA on learning and memory abilities in SAMP8 mice.Cerebral cortex mitochondria were isolated to determine the effect of preventive administration of ICA on the oxidative stress by detecting reactive oxygen species(ROS)level,lipid peroxides(MDA)content,glutathione GSH content and catalase(CAT)activity.Results Preventive treatment of ICA could significantly improve the abilities of place navigation and space exploration of SAMP8 mice,enhance their reflex ability in step-down passive test.ICA could also reduce the level of ROS and MDA content,increase GSH content in brain mitochondria of SAMP8 mice.CAT activity was not obviously changed.Compared with ICA high dose group,the learning and memory abilities of mice in ICA and estrogen receptor inhibitor ICI182780 co-administrated group were significantly decreased.However,brain mitochondria oxidative stress was not changed obviously.Conclusion Preventive administration of icariin can significantly improve learning and memory abilities and brain mitochondrial oxidative stress in SAMP8 mice.The mechanism of ICA improving learning and memory abilities may be related to its estrogen-like effect; while the action on brain mitochondrial oxidative stress may be independent of estrogen receptor.
Key words:icariin; senescence-accelerated mouse; learning and memory abilities; mitochondria; oxidative stress; estrogen-like effect; estrogen receptor inhibitor
作者简介:张晓菲(1989-),女,硕士生,研究方向:神经药理学,E-mail: xiaofei198913@163.com;
基金项目:国家自然科学基金资助项目(No 81202192,No 81473586);国家科技部“重大新药创制”科技重大专项(No 2012ZX09301002-001-026)
收稿日期:2015-03-02,修回日期:2015-04-30
文献标志码:A
文章编号:1001-1978(2015)07-0925-06
doi:10.3969/j.issn.1001-1978.2015.07.008