黄皮不同部位提取物的抗氧化活性
李奕星, 袁德保,陈 娇, 郑晓燕, 李芬芳, 郑丽丽, 王朝政, 谭 琳
(中国热带农业科学院 海口实验站/海南省香蕉遗传改良重点实验室, 海南 海口 570102)
黄皮不同部位提取物的抗氧化活性
李奕星, 袁德保,陈 娇, 郑晓燕, 李芬芳, 郑丽丽, 王朝政, 谭 琳*
(中国热带农业科学院 海口实验站/海南省香蕉遗传改良重点实验室, 海南 海口 570102)
为综合开发利用黄皮,选择黄皮枝条、果皮、果肉和种子4个部位,采用95 %乙醇浸提,得到4个部位的提取物,采用分光光度法,考察该4个部位提取物的多酚含量以及对1,1-二苯基-2-三硝基苯肼(DPPH)自由基、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵(ABTS)自由基、羟自由基和过氧化氢的清除活性。结果表明:黄皮果皮、枝条、果肉和种子浸膏的多酚含量分别为165.6 μg/mg、152.0 μg/mg、131.8μg/mg和117.5μg/mg;在0.05~2.0 mg/mL,对4种自由基的清除率呈量效关系,且清除率和半数清除率(IC50)均为果皮>枝条>果肉>枝子。
黄皮; 抗氧化活性; 多酚
黄皮(ClausenalansiumLour.)为芸香科(Rutaceae)黄皮属(Clausena)小乔木[1],是我国热带及亚热带的新兴优良果树,已有1500年以上的栽培历史[2]。其果实多汁,味道偏酸,完全成熟时,酸中带甜,风味独特,清香爽口,可做甜品、果酱等。此外,其多糖的果汁发酵后能制作鸡尾酒口味的碳酸饮料[3]。《中药大辞典》记载,黄皮的果、叶、根、种子均能入药,其果实有行气、消食、化痰的功效,主治食积胀满、脘腹疼痛、疝痛、痰饮、咳喘,根、叶及种子也可治腹痛、胃痛、感冒发热等证[4]。目前,已经从黄皮中分离得到一系列的化合物,如黄皮酰胺类[5]、咔唑类[6-7]、香豆素类[8]和挥发油[9]等。
据文献报道,黄皮的生物活性主要有抗真菌和艾滋病逆转录酶抑制作用[10],抗毛滴虫、抗糖尿病、抗炎和保肝活性[11],抗过敏活性[12]等。此外,还有文献报道,黄皮的皮具有抗氧化活性,且乙酸乙酯段活性最好[13]。然而,由于采收季节短,黄皮多为鲜食,并未得到广泛推广,且果皮、细枝、种子多被弃置,缺乏针对黄皮及其不同部位开发应用的研究。因此,选择黄皮为研究对象,分别对其枝条、皮、果肉、种子进行多酚含量测定,并通过清除DPPH自由基、清除ABTS自由基、清除羟自由基和过氧化氢能力4个方面考察这4个部位的抗氧化能力,以期为其开发利用提供理论依据。
1 材料与方法
1.1 材料
黄皮成熟果实及枝条,购买于海南海口,由中国热带农业科学院海口实验站鉴定。
试剂与仪器设备:ABTS、DPPH(梯希爱上海化成工业发展有限公司),Folin-酚(美国sigma公司),没食子酸(阿拉丁试剂上海有限公司),水杨酸、铁氰化钾、水杨酸、过硫酸钾、三氯乙酸、双氧水等均为分析纯(广州化学试剂厂生产)。
AXLD-1830超纯水系统(美国阿修罗科技有限公司),RF-UV1240紫外-可见分光光度计(日本岛津公司),TGL-20bR高速冷冻离心机(上海安亭科学仪器厂)。
1.2 黄皮不同部位提取物的制备
取新鲜黄皮果及枝条洗净、沥干,将枝条、果皮、果肉、果核分开,于40℃烘箱中干燥后,粉碎过60目筛,用体积分数为95%的乙醇超声浸提3次,抽滤,减压浓缩至干,分别得到枝条浸膏、果皮浸膏、果肉浸膏和果核浸膏。
1.3 黄皮不同部位提取物的多酚含量测定
多酚标准曲线参照Hanmmerschmidt P A 等[14]报道的Folin-Denis改良法建立,精密称取待测样品,分别用无水乙醇稀释成1 mg/mL,按照标准曲线的测定方法,平行测定3次,取其平均值,并按标准曲线计算多酚含量。
1.4 抗氧化性的测定
1.4.1 清除DPPH的活性 参照文献[15]报道的方法进行测定。取无水乙醇将样品分别配制成0.05 mg/mL、0.10 mg/mL、0.20 mg/mL、0.50 mg/mL、1.0 mg/mL、1.5 mg/mL、2.0 mg/mL的待测样品溶液。各取0.2 mL待测溶液,加入4 mL浓度为0.1 mmol/mL的DPPH溶液,摇匀置暗处反应30 min后,于波长517 nm处测其吸光度Ai,重复3次,结果取平均值。按式(1)计算DPPH自由基清除率。
DPPH自由基清除率 =[1-(Ai-Aj)/A0]×100%
(1)
式中,Ai为待测样品溶液+ DPPH溶液的吸光度,Aj为待测样品溶液+无水乙醇的本底吸光度,A0为无水乙醇+DPPH溶液的空白对照吸光度。
1.4.2 清除ABTS的活性 参考Villano D等[16]报道的方法,稍加改进。取超纯水将样品分别配制成0.05 mg/mL、0.10 mg/mL、0.20 mg/mL、0.50 mg/mL、1.0 mg/mL、1.5 mg/mL、2.0 mg/mL的待测样品溶液,各取0.2 mL,分别加入1.9 mL ABTS自由基工作液,准确反应6 min后于734 nm处测定吸光度Ai,重复3次,取平均值。按式(2)计算ABTS自由基清除率。
ABTS自由基清除率 =[1-(Ai-Aj) /A0]×100 %
(2)
式中,Ai为待测样品溶液+ABTS溶液的吸光度,Aj为待测样品溶液+超纯水的本底吸光度,A0为超纯水+ABTS溶液的空白对照吸光度。
1.4.3 清除羟自由基活性 采用孙红男[17]报道的方法,并稍加改进。取超纯水将样品分别配制成0.05 mg/mL、0.10 mg/mL、0.20 mg/mL、0.50 mg/mL、1.0 mg/mL、1.5 mg/mL、2.0 mg/mL的待测样品溶液,在反应体系中先加入5 mmol/L的水杨酸-乙醇2 mL、10 mmol/L的FeSO41 mL,混匀,分别加入1 mL不同浓度的待测样品溶液,并用去离子水使反应体系补至7 mL,最后加2 mL H2O2启动反应,37℃保温30 min,于510 nm处测定吸光值同时,重复3次,取平均值。按式(3)计算羟自由基清除率。
羟自由基清除率 =[1-(Ai-Aj) /A0]× 100%
(3)
式中:Ai为加入待测样品溶液的吸光度,Aj为不加H2O2时加入待测样品溶液的本底吸光度,A0为加入待测样品溶剂的空白对照吸光度。
1.4.4 清除过氧化氢活性 按文献[18-19]方法,并加以改进。取pH 7.4的磷酸盐缓冲溶液将样品分别配制成0.05 mg/mL、0.10 mg/mL、0.20 mg/mL、0.50 mg/mL、1.0 mg/mL、1.5 mg/mL、2.0 mg/mL的待测样品溶液,取待测样品溶液5 mL,加入5 mL磷酸盐缓冲溶液配制的10 mmol/L H2O2溶液,摇匀置暗处反应30 min后,于波长248 nm处测其吸光度Ai,重复3次,结果取平均值。按式(4)计算过氧化氢清除率。
H2O2清除率 % =[1-(Ai-Aj) /A0]×100%
(4)
式中,Ai为待测样品溶液+ H2O2溶液的吸光度,Aj为待测样品溶液+磷酸盐缓冲溶液的吸光度,A0为磷酸盐缓冲溶液+ H2O2溶液的吸光度。
2 结果与分析
2.1 黄皮不同部位提取物的多酚含量
以总酚(以没食子酸计)浓度为横坐标,吸光度为纵坐标绘制标准曲线(图1),求得回归方程:
y= 0.001 6x+ 0.054 1,R2= 0.997。
黄皮不同部位提取物的多酚含量最低的为种子浸膏(117.5±0.46)μg/mg,最高的为果皮浸膏(165.6 ±0.35) μg/mg,枝条浸膏和果肉浸膏的多酚含量分别为(152.0 ±0.75)μg/mg和(131.8 ±0.85)μg/mg。
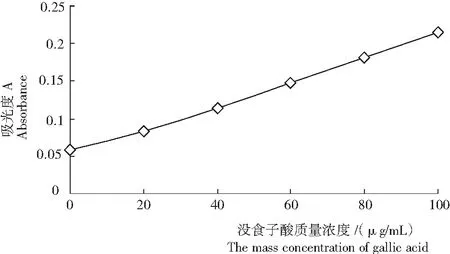
图1 没食子酸的标准曲线
2.2 黄皮不同部位提取物的抗氧化活性
2.2.1 清除DPPH自由基能力 由图2A可见,不同部位提取物清除DPPH自由基的能力与浓度呈线性关系,黄皮果皮、枝条、果肉、种子提取物与DPPH清除率的线性方程分别为
y果皮= 49.278x+ 16.574,R2= 0.920 6, IC50= 0.678 3 mg/mL;
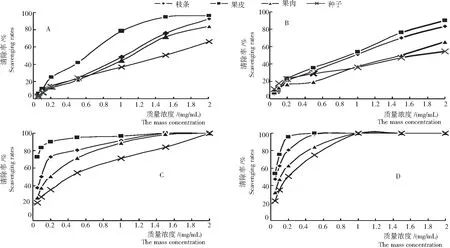
图2 黄皮不同部位提取物对DPPH、ABTS、OH-·H2O2的清除率
Fig.2 Scavenging rates of different parts ofC.lansiumon DPPH radical, ABTS radical, hydroxyl radical and hydrogen peroxide
y枝条= 45.711x+ 7.2134,R2= 0.995 4, IC50= 0.936 0 mg/mL;
y果肉= 42.509x+ 6.115 1,R2= 0.991 4, IC50= 1.032 4 mg/mL;
y种子= 30.968x+ 8.577,R2= 0.988 8, IC50= 1.337 6 mg/mL。
可见,清除DPPH自由基能力为果皮>枝条 >果肉>种子。
2.2.2 清除ABTS自由基能力 由图2B可见,提取物清除ABTS自由基的能力与浓度呈线性关系,黄皮果皮、枝条、果肉、种子提取物与ABTS清除率的线性方程分别为
y果皮= 42.121x+ 9.900 7,R2= 0.980 1,
IC50= 0.952 0 mg/mL;
y枝条= 39.77x+ 8.208 6,R2= 0.980 2,
IC50= 1.050 8 mg/mL;
y果肉= 27.767x+ 9.192 2,R2= 0.993 1,
IC50= 1.469 6 mg/mL;
y种子= 20.445x+15.56,R2= 0.964 5,
IC50= 1.684 5 mg/mL。
可见,清除ABTS自由基能力为果皮 >枝条 >果肉>种子。
2.2.3 清除羟自由基能力 由图2C可见,提取物清除羟自由基的能力与浓度呈线性关系,黄皮果皮、枝条、果肉、种子提取物与羟自由基清除率的线性方程分别为
y果皮= 360.1x+ 49.638,R2= 0.912,
IC50= 0.001 0 mg/mL;
y枝条= 234.71x+ 26.15,R2= 0.999 2,
IC50= 0.101 6 mg/mL;
y果肉= 157.57x+19.85,R2= 0.979 1,
IC50= 0.1913 mg/mL;
y种子= 39.07x+26.268,R2= 0.962,
IC50= 0.607 4 mg/mL。
可见,清除羟自由基能力为果皮 >枝条 >果肉>种子。
2.2.4 清除过氧化氢能力 由图2D可知,提取物清除过氧化氢能力与浓度呈线性关系,黄皮果皮、枝条、果肉、种子提取物与双氧水清除率的线性方程分别为
y果皮= 268.57x+ 43.6,R2= 0.023 8,
IC50= 0.952 0 mg/mL;
y枝条= 215.14x+ 38.5,R2= 0.982 5,
IC50= 0.053 4 mg/mL;
y果肉=198.29x+24.3,R2= 0.967,
IC50= 0.129 6 mg/mL;
y种子= 109.97x+22.382,R2= 0.954 1,
IC50= 0.2511 mg/mL。
可见,清除双氧水能力为果皮>枝条 >果肉>种子。
3 讨论与结论
在生活中,人们往往将黄皮的果皮、枝条和种子当作废弃物扔掉。试验发现,4个不同部位提取物的多酚含量大小顺序为果皮65.6 μg/mg>枝条152.0 μg/mg>果肉131.8μg/mg>种子117.5 μg/mg,并采用了4种评价体系比较黄皮4个不同部位提取物的抗氧化活性,4种方法测定的自由基清除活性以及IC50值均为果皮 >枝条>果肉>种子,表明多酚含量越高,清除活性越好,且在试验浓度范围内,4个不同部位对自由基的清除率随着提取物的浓度增加而逐渐增加,最高清除率达100%,该结果极大的提高了黄皮的综合开发价值,可以考虑将黄皮整果开发成大众饮品,且黄皮枝条多酚也可作为一种天然抗氧化剂,在药品、食品中具有较好的开发前景。
试验主要测定了黄皮不同部位提取物的多酚含量及抗氧化能力,并探讨其关系。然而,植物中的抗氧化物质不仅只有多酚,还有多糖类化合物、生物碱类、皂苷类等物质[20],这些物质与黄皮的抗氧化能力之间的关系如何,还需进一步研究。
本次研究结果丰富了黄皮的化学成分和生物活性,为黄皮及其废弃物的开发利用提供了科学依据。
[1] 中国科学院中国植物志编辑委员会.中国植物志[M].北京:科学出版社,1997.
[2] 李升锋,陈卫东,徐玉娟,等.无核黄皮的营养成分[J].食品科技,2005(6):96-98.
[3] Morton J.Fruits of warm climates[M].Miami,Fla,USA,1987:197-198.
[4] 江苏新医学院.中药大辞典(第2卷)[M].上海:上海科技出版社,1977.
[5] Yang M H,Chen Y Y,Huang L.Three novel cyclic amides from Clausena lansium[J].Phytochemistry,1988,27(2):445-450.
[6] Li W S,James D M,Farouk S E.Carbazole alkaloids from Clausena lansium[J].Phytochemistry,1991,30(1):343-346.
[7] Kumar V,Vallipuram K,Adebajo A C,et al. 2,7-Dihydrooxy-3-formyl-1-(3-methyl-2'-butenyl)carba-zole from Clausena lansium[J].Phytochemistry,1995,40:1563-1565.
[8] Prasad K N,Xie H H,Hao J,et al.Antioxidant and anticancer activities of 8-hydroxypsoralen isolated from wampee [Clausena lansium(Lour.)Skeels]peel[J].Food Chemistry,2010,118(1):62-66.
[9] Zhao J Y,Nan P,Zhong y.Chemical composition of essential oils of Clausena lansium from Hainan Island,China[J].Zeitschrift fur Naturforschung, 2004,59c,153-156.
[10] Ng T B,Lam S K,Fong W P.A homodimeric sporamin-type trypsin inhibitor with antiproliferative, HIV reverse transcriptase-inhibitory and antifungal activities from wampee(Clausena lansium)seeds[J].Biological Chemistry,2012,384(2):289-293.
[11] Adebajo A C,Iwalewa E O,Obuotor E M,et al.Pharmacological properties of the extract and some isolated compounds of Clausena lansium stem bark: Anti-trichomonal,antidiabetic,anti-inflammatory,hepatoprotective and antioxidant effects[J].Journal of Ethnopharmacology,2009,122:10-19.
[12] 赵丰丽,李洁荣,杨健秀.黄皮叶不同溶剂提取物抗过敏活性研究[J].食品工业科技,2009,30(1):109-112.
[13] Prasad N K,Hao J,Yi C. Antioxidant and anticancer activities of wampee (Clausena lansium(Lour.)Skeels)peel[J].Journal of Biomedicine and Biotechnology, 2009,2009:612805-612810.
[14] Hanmmerschmidt P A,Pratt D E.Phenolic antioxidants of dried soybeans[J].Food Science,1978,43(2):556-559.
[15] 杨新周,郝志云,董 毅,等.白花蛇舍草不同溶剂和方法提取物的抗氧化活性[J].贵州农业科学,2014,42(2):43-45.
[16] Villano D,Pachon M,Troncoso A M,et al.The antioxidant actvity of wines determined by the ABTS+method:influence of sample dilution and time[J].Talanta,2004,64(2):501-509.
[17] 孙红男.苹果渣中多酚类物质的高压脉冲电场处理及其生物活性研究[D].北京:北京林业大学,2011.
[18] 王 静,刘大川.紫(白)苏叶黄酮类化合物抗氧化性能的研究[J].中国油脂,2004,29(3):33-36.
[19] Ruch R J.Prevention of cytotoxicity and inhibition of intercellar communication by antioxitant catechins isolated from Chinese green tea[J].Carcinogenesis,1989,10:1003-1008.
[20] 郑瑞生,封 辉,戴聪杰,等.植物中抗氧化活性成分研究进展[J].中国农学通报,2010,26(9):85-90.
(责任编辑: 孙小岚)
Antioxidant Activity of Extracts from Different Parts ofClausenalansium
LI Yixing, YUAN Debao, CHEN Jiao, ZHENG Xiaoyan, LI Fenfang,ZHENG Lili, WANG Chaozheng, TAN Lin*
(HaikouExperimentalStation,ChineseAcademyofTropicalAgriculturalSciences,HainanKeyLaboratoryofBananaGeneticImprovement,Haikou,Hainan570102,China)
The polyphenolic contents and antioxidant activities of four extracts from different parts ofC.lansiumwere analyzed for comprehensive development and utilization ofC.lansium, the peels, stems, pulp and pips ofC.lansiumwere used as raw materials, and four extracts were obtained by extracting with 95 % ethanol. The antioxidant activity of the extracts, including the polyphenolic content, scavenging activities on DPPH radical, ABTS radical, hydroxyl radical and hydrogen peroxide, were determined by ultraviolet spectrophotometry. The results showed that the polyphenolic contents in the four extracts were 165.6 μg/mg, 152.6 μg/mg, 131.8 μg/mg and 117.5μg/mg, respectively. And have free radical scavenging activities with dose-effect relationship in the concentration range of 0.05~2.0 mg/mL. The free radical scavenging activities and IC50were as follows: peels >stems >pulp >pips.
Clausenalansium; antioxidant activities; polyphenol
2014-09-01; 2015-04-27修回
中国热带农业科学院海口实验站科研启动项目“蛋黄果等热带优稀水果多酚、多糖的生物学活性研究”(HKZKY140204); 农业部财政项目“热带珍稀野生果树资源调查、收集与评价”
李奕星(1985-),女,研究实习员,硕士,从事天然药物化学研究。E-mail:yixing0221@163.com
*通讯作者:谭 琳(1974-),女,副研究员,博士,从事农产品贮藏与加工研究。E-mail:tanlin7402@126.com
1001-3601(2015)05-0241-0075-04
O657;S38
A

