拟南芥乙酰羟酸合成酶(AHAS)点突变原核表达与活性测定
赵菲佚,焦成瑾,田春芳,王太术,谢尚强,何丽娟
(天水师范学院生物工程与技术学院,甘肃天水 741001)
拟南芥乙酰羟酸合成酶(AHAS)点突变原核表达与活性测定
赵菲佚,焦成瑾,田春芳,王太术,谢尚强,何丽娟
(天水师范学院生物工程与技术学院,甘肃天水 741001)
拟南芥乙酰羟酸合成酶(AHAS)参与支链氨基酸合成。为考察AHAS不同结构域对支链氨基酸合成的影响,分别对其大小亚基上特定位点进行点突变后进行原核表达,体外重组后对其全酶活性进行测定,并对其终端产物之一——缬氨酸对AHAS全酶活性的影响进行探讨。结果显示:AHAS小亚基G88D突变将解除其终端产物的反馈抑制作用,而大亚基E305D与E482D的突变降低AHAS全酶活性,且2种不同突变大亚基对AHAS全酶活性影响存在差异。AHAS大亚基E482D突变较E305D突变影响更大。研究结果表明:AHAS大小亚基间存在着相互作用,且大小亚基不同结构域突变对AHAS全酶活性具有不同的影响。
乙酰羟酸合成酶;点突变;原核表达;全酶活性
缬氨酸、亮氨酸和异亮氨酸由于具有支链碳骨架而被称为支链氨基酸。支链氨基酸参与动物生长与发育诸多代谢过程[1-3]。在动物细胞中,支链氨基酸通过信号蛋白mTOR(mammalian target of rapamycin)进行信号传递,通过促进胞内蛋白合成及降解过程在蛋白质合成中起着重要的作用。此外,支链氨基酸也直接或间接影响兴奋性神经递质谷氨酸的合成与区室化过程[4],对胺类神经递质5-羟色胺、儿茶酚胺类多巴胺和去甲肾上腺素的合成也有影响[2,5]。由于动物不能从头合成支链氨基酸,只能通过饮食获取,使植物成为支链氨基酸的重要来源。
在植物、细菌及真菌中,支链氨基酸通过非常保守的代谢途径进行合成,合成过程受合成酶底物及合成途径终产物的严格调控[6]。乙酰羟酸合成酶(acetohydroxyacid synthase,AHAS)也称乙酰乳酸合成酶(acetolactate synthase),是该代谢途径第一个酶,催化两分子丙酮酸盐生成缬氨酸和亮氨酸的前体物质乙酰乳酸;也能催化丙酮酸盐与α-酮丁酸生成异亮氨酸前体乙酰羟基丁酸盐[7]。由于AHAS可作为一些化学除草剂的靶点,其结构与功能在不同生物中已有较好研究。细菌AHAS全酶为四聚体,由2个较大的催化亚基和2个较小的调节亚基组成,小亚基可稳定并增强催化亚基的活性[8],包含1个保守的ACT结构域,大亚基则介导终产物的反馈抑制作用。对植物AHAS研究表明:植物AHAS大小是细菌的2倍,催化亚基含有2个ACT结构域,推测植物AHAS的构象可能与细菌不同[9]。
基于植物AHAS在支链氨基酸代谢中的关键作用,研究者试图过表达该基因各自的亚基来提高植物体内的支链氨基酸含量,但实验结果均未达到预期目标[10-11]。对细菌AHAS大亚基的研究确定了H132、K155、E213、D217、E221、E389、E393和S414为其关键位点,除E213D外,其余位点的突变使细菌AHAS酶活性完全丧失,E213D的突变使细菌AHAS的酶活性只有野生型酶蛋白的25%[12]。波菜AHAS大亚基体外突变分析结果与细菌相似,大亚基R2598、E311、D315、E319、E488、E492、S518和T520组成AHAS的活性中心,除E488D突变外,其它突变均消除了该酶活性,E488D突变使其酶活性为野生型的48%[13]。对AHAS氨基酸序列在不同物种间的比对分析发现,细菌E213与拟南芥E305对应,而波菜E488与拟南芥E482相对应。细菌AHAS小亚基ilvH中,N11A、G14D、N29H、T34L、A36V及Q59L突变对细菌AHAS全酶活性与对缬氨酸的敏感性有影响,其中G14D突变具有野生型AHAS酶活性的92%,并使细菌具有对缬氨酸最强烈的抗性,比对发现此突变与拟南芥小亚基G88D突变相对应[14]。
近期Chen等[15]通过正向遗传学筛选到拟南芥突变体vat1(valine-tolerant 1),并发现催化亚基的T119L突变可解除终产物抑制,使支链氨基酸含量增加。植物AHAS全酶催化亚基与调节亚基间存在着相互作用,进而影响AHAS催化活性。已有研究多集中于对AHAS各自亚基功能的探讨,对大小亚基上关键结构域同时突变,并从全酶水平进行活性研究未见报道。本研究对拟南芥AHAS两亚基不同位置进行体外突变,然后在原核细胞中分别表达,不同突变亚基蛋白经体外重组后测定AHAS全酶活性变化。研究结果在理论上将为了解AHAS亚基间相互作用提供信息,实践上将为提高支链氨基酸含量的基因操作提供依据。
1 材料和方法
1.1 实验材料
拟南芥野生型(Columbia-0)订购自SALK(http://signal.salk.edu/)。种子用含0.1% TritonX-100的20%次氯酸钠消毒液在EP管中消毒12 min,灭菌ddH2O漂洗5次后,点种于MS固体培养基平板上。置于4 ℃下春化2~3后移至22 ℃连续光照条件下竖直培养。
1.2 AHAS点突变原核表达载体构建
平板上生长7 d的拟南芥整株幼苗,提取其总RNA,采用上海生物工程公司总RNA提取试剂盒进行(Sangon,SK1312),提取的总RNA使用invitrogen公司反转录酶进行cDNA第一链反转录(invitrogen,18080-093),以cDNA为模板,使用高保真酶进行AHAS大小亚基CDS全长PCR扩增(Trans,AP221-01)。野生型AHAS大亚基使用引物ALUF(5′-CCGGAATTCATGGCGGCGGCTA-CTTCATCCATC-3′)和ALUR(5′-CCCAAGCTT-TCAGTTGCTAGATTGACGCAAC-3′);野生型AHAS小亚基使用ASUF(5′-CGCGGATCCATGGCGGCGACGACGACTGCTAC-3′)和ASUR(5′-CCCAAGCTTCTACAAAGGAAGAGAGTATCC-ACG-3′);AHAS大亚基在第305位E305D的正向突变引物为ALU305F(5′-ACTCTTGAACAGGA-TTACAGGAGTGAC-3′),反向突变引物ALU305R(5′-GTCACTCCTGTAATCCTGTTCAAGAGT-3′);AHAS大亚基第482位E482D正向突变引物为ALU482F(5′-CACTCTTACTCAGATATCATC-AACGAG-3′),反向引物为ALU482R(5′-CTCGT-TGATGATATCTGAGT AAGAGTG-3′)。AHAS小亚基第88位G88D正向突变引物ASU88F(5′-GGCGATGAGAGCGATATAATAAATAGA-3′),反向突变引物为ASU88R(5′-TCTATTTATTATATCGCTCTCATCGCC-3′)。引物中下划线标记各酶切位点。PCR扩增产物经胶回收柱(Sangon,SK8132)纯化后双酶切,再次纯化后连接到pET28a表达载体上,所有克隆序列送上海生物工程公司进行测序,确认克隆正确后分别进行AHAS大小亚基蛋白原核表达。
1.3 AHAS突变大小亚基蛋白原核表达
将测序正确的原核表达载体转入BL21(DE3)菌株,按1∶1 000的比例接种至60 mL含50 μg/L卡那霉素的LB液体培养基,37 ℃过夜小量培养。次日将10 mL过夜培养物转入1 L含50 μg/mL Kan的LB培养基中继续培养,当菌液OD600达0.6时收菌,4 000 r/min离心,沉淀加入30 mL裂解液(50 mmol/L NaH2PO4,300 mmol/L NaCl,10 mmol/L imidazole,pH 8.0)重悬,在超声破碎仪上破碎后12 000 r/min离心,上清液中加入Qiagen公司Ni-NTA树脂,重组蛋白提取按Qiagen公司树脂使用方法进行。纯化蛋白保存于4 ℃冰箱备用。
1.4 AHAS突变大小亚基蛋白体外重组与全酶活性测定
AHAS蛋白酶大小亚基体外重组与全酶活性测定按照Maria Vyazmensky的方法进行[8],并依据发表文献进行部分修改[16-17]。野生型及各突变等量AHAS大小亚基蛋白(500 μg)加入500 μL重组缓冲液A(0.1 mmol/L FAD,10 mmol/L EDTA,1 mmol/L DTT,0.1 mol/L磷酸钾缓冲液,pH 7.6)中。37 ℃保温15 min使AHAS大小亚基进行重组,后加入500 μL缓冲液B(80 mmol/L丙酮酸钠,0.2 mmol/L TPP,20 mmol/L MgCl2,0.05 mmol/L FAD,1 mmol/L DTT,10 mmol/L EDTA溶解于0.1 mol/L磷酸钾缓冲液中,pH 7.6),至已保温完全的缓冲液A中开始反应。此反应混合液在37 ℃保温30 min后加入1/10总反应体积的10% H2SO4以终止反应,在60 ℃下加热15 min使乙酰乳酸转变为3-羟基-2-丁酮,再加入120 μL 1.7% 肌酸,使用2.5 mol/L NaOH调节反应液至碱性,后加入140 μL α-奈酚,60 ℃保温15 min使其显色。反应生成的3-羟基-2-丁酮使用CARY 50 Bio分光光度计在525 nm下进行比色测定。在此反应条件下,一个酶活力单位定义为1 μmol乙酰乳酸在1 min内生成的产物。测定重复3次,计算均值与标准差。外源加入缬氨酸对AHAS酶活性影响测定方法除在缓冲液B中加入所需浓度的缬氨酸外,其余步骤与上述标准测定方法相同。
2 结果与分析
2.1 AHAS蛋白结构及其突变位置
拟南芥AHAS全酶由2个相同的大亚基和2个相同的小亚基构成,大亚基为催化亚基,小亚基为调节亚基。AHAS大亚基(ALU)定位于拟南芥第5条染色体上(At5g58610),其CDS共有1 773 bp,编码蛋白含591个氨基酸。蛋白第305位氨基酸由E转变为D,导致第一个大亚基突变蛋白为ALUE305D,第482位氨基酸由E转变为D形成该大亚基第二个突变蛋白ALUE482D(图1,A)。AHAS小亚基(ASU)定位于拟南芥第3条染色体上(At3g16290),其CDS其有1 441 bp,共编码477个氨基酸,属于ACT超家族。小亚基蛋白包含2个ACT结构域,分别位于78~150和309~383氨基酸区域。蛋白第88位氨基酸由G转变为D形成小亚基突变蛋白ASUG88D(图1,B)。
2.2 AHAS原核表达载体构建
ALU野生型与ALU第305位E突变为D的ALUE305D、第482位E突变为D的ALUE482D突变蛋白和ASU野生型及ASU第88位G突变为D的ASUG88D突变蛋白CDS以PCR方式进行扩增,并被克隆到原核表达载体pET28a中(图2)。从图2可看出,PCR扩增产物与AHAS大小亚基片段大小相符合,大亚基片段大小为1.7 kb,小亚基大小约1.4 kb。扩增片段连接到pET28a后经酶切验证克隆正确,用于后续表达试验。

图1 AHAS蛋白大小亚基结构与突变位置示意A.ALU结构与突变位置;B.ASU结构与突变位置;图中数字表示从翻译起点处氨基酸位置;ACT.ACT 结构域
2.3 AHAS突变蛋白原核表达
将构建并测序验证的AHAS大小亚基及其突变形式原核表达载体转入原核表达菌株BL21(DE3)进行大小亚基蛋白分别表达,表达的不同形式蛋白经His标签纯化,经12% SDS-PAGE蛋白胶检测结果见图3。
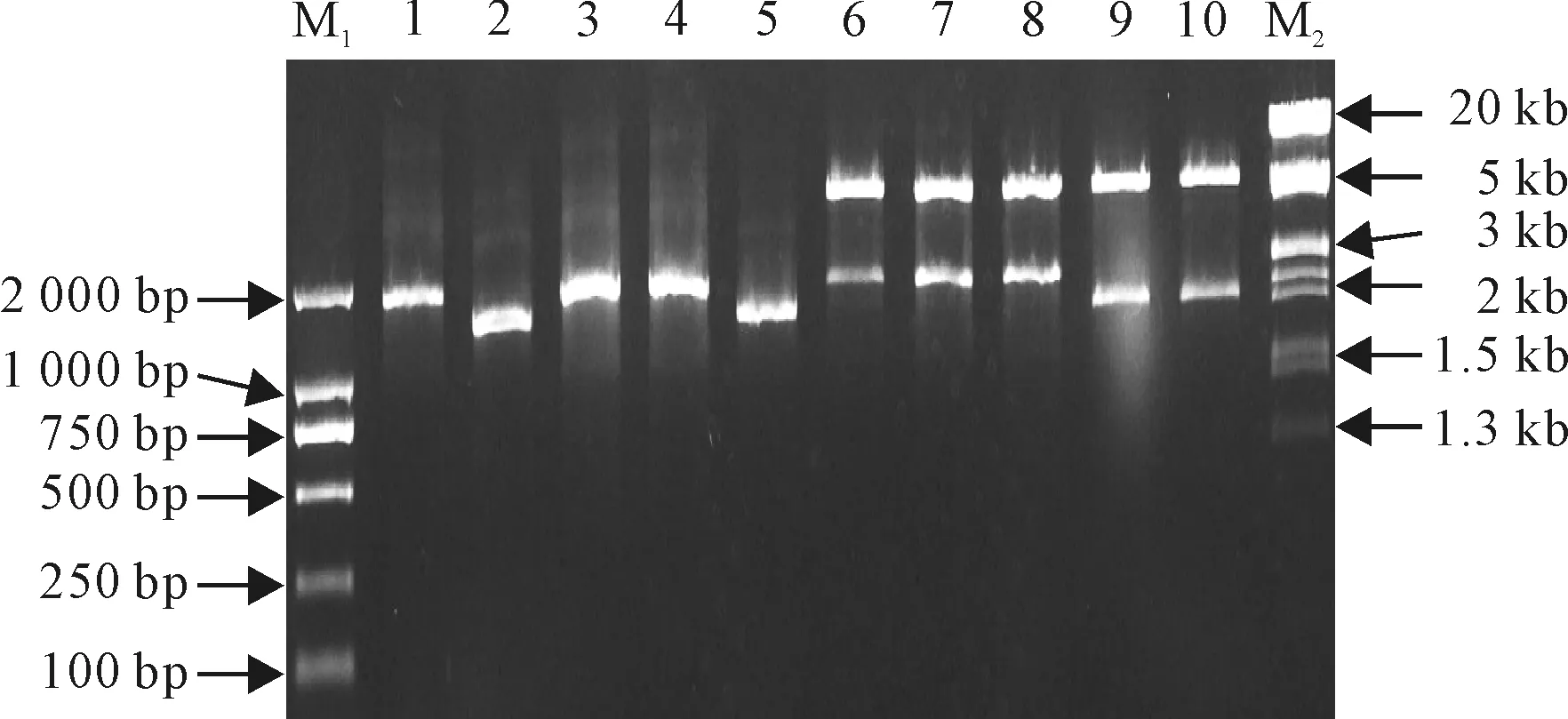
图2 AHAS大小亚基及其突变形式原核表达载体构建M1.DL2000;M2.λDNA/EcoRⅠ+HindⅢ;1~5 分别为ALU、ASU、ALUE305D、ALUE482D及ASUG88D;6~10分别为1~5 PCR产物克隆至原核表达载体pET28a后经BamHⅠ与SalⅠ双酶切鉴定
图3,A显示,ALU及其2种突变形式ALUE305D、ALUE482D均得到正确表达,其大小都在其预测的65 kD。从图3,B可看出,ASU及ASUG88D也得到了表达,预测大小为53 kD,然而小亚基的表达除有一条表达主带外,还有其它非特异性条带存在。为进一步确认AHAS大小亚基表达的正确性及小亚基的正确位置,对所纯化的蛋白使用抗His标签抗体进行Western检测(图3,C)。结果表明,AHAS大小亚基均为His融合蛋白,其与预测大小符合,且AHAS小亚基位于非特异性条带下方。
2.4 AHAS突变蛋白体外重组与全酶活性测定
为考察AHAS各亚基不同点突变形式对其全酶活性的影响,对已在原核中表达的AHAS亚基的不同突变形式在体外进行重组,并对重组的全酶活性及不同缬氨酸浓度对全酶活性影响进行了测定结果见图4。
图4表明,当AHAS大亚基第305位或其第482位由谷氨酸变为天冬氨酸(E突变为D),而小亚基第88位由甘氨酸变为天冬氨酸时(G突变为D),不同的大亚基突变形式与突变的小亚基重组后依然表现出酶活性,但不同的突变大亚基形式与突变小亚基组合对其全酶活性的影响不同。与未突变的野生型全酶相比较,发生点突变后的全酶活性均降低,下降最快的为大亚基发生E482D的突变形式(图4,A,红色柱),说明当AHAS的大小亚基不同结构域突变会对其全酶活性产生影响。为考察缬氨酸对不同突变形式AHAS酶活性的影响,在不同突变形式的重组体系中加入终浓度为1 mmol/L缬氨酸,并对此条件下AHAS酶活性进行了测定(图4,A,绿色柱)。与无缬氨酸加入时不同,测试体系中存在缬氨酸时,AHAS野生型蛋白酶活性受到抑制,而突变形式AHAS酶活性被抑制的程度小于其未突变的酶形式。在大亚基2种不同突变形式中,大亚基E305D突变形式酶活性被抑制的程度最小。此结果一方面说明,当AHAS小亚基发生G88D突变时的确部分解除了其终端产物对全酶的抑制作用,另一方面说明在小亚基与大亚基同时存在突变时,大亚基上的突变又可部分减弱由于小亚基突变导致的其终端产物对酶活性的影响,且在大亚基不同位置的点突变对此减弱的程度存在差异。
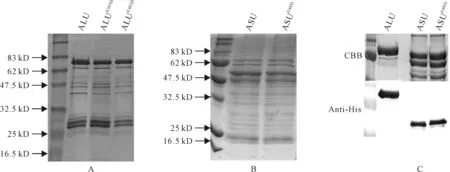
图3 AHAS大小亚基及其突变蛋白表达与纯化A.ALU、ALUE305D和ALUE482DHis标签融合蛋白表达与纯化;B.ASU及ASUG88DHis标签融合蛋白表达与纯化;C.ASU与ASUG88DHis标签融合蛋白Western检测,图中上部为纯化蛋白考马斯亮蓝染色(CBB),下部为His标签抗体杂交结果
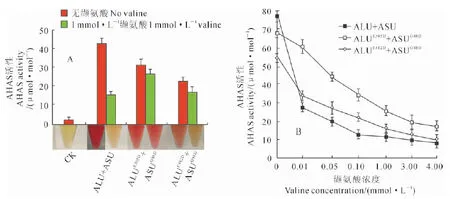
图4 突变ALU与ASU重组酶不同缬氨酸浓度下活性A.突变ALU与ASU重组全酶活性;B.不同浓度缬氨酸处理下突变ALU与ASU重组全酶活性
此外,对不同AHAS突变形式在不同浓度缬氨酸存在时对其活性影响也进行了测定(图4,B),结果表明,在不同缬氨酸浓度下,野生型及突变形式AHAS活性均随着缬氨酸浓度的升高而降低,野生型AHAS的活性降幅最大,在缬氨酸0~0.01 mmol/L区间内,降幅达65%,而突变形式的AHAS在此区间内的降幅与野生型相比则较小,大亚基E482D突变的降幅为38.1%,而E305D的突变降幅仅为11.7%。在缬氨酸从0~4 mmol/L区间内,野生型AHAS活性的降幅平均为87.1%,E305D的平均为70.5%,E482D为80.8%。此结果说明,当存在不同浓度缬氨酸终产物时,其对AHAS活性的抑制由于AHAS在大亚基上不同位置的突变而有差异,与其在1 mmol/L浓度下的测定结果相似,在不同浓度缬氨酸影响下,呈现出突变形式AHAS活性下降较野生型小,而在2种突变形式AHAS中,E305D对终产物的反馈抑制影响又较E482D小,且缬氨酸对AHAS活性的抑制浓度集中于0~0.01 mmol/L的狭窄区间内。
3 讨 论
支链氨基酸是动物的必需氨基酸,植物是这些氨基酸的主要来源。植物AHAS作为支链氨基酸合成途径中的第一个酶,其活性变化与调节在支链氨基酸合成中起着关键性的作用。植物中提高此类氨基酸含量无法以过表达该基因的方式实现[7,11],对AHAS酶蛋白精细结构及活性调控研究成为实现此目标的重要途径。
本研究中,对拟南芥AHAS点突变大小亚基体外表达与活性测定表明:AHAS野生型及不同位置发生突变的大小亚基以融合蛋白方式在原核中均可进行表达,纯化的原核表达大小亚基蛋白在体外可进行重组,且全酶均表现出酶活性,然而在不同的突变方式下其全酶活性存在差异。在无缬氨酸存在时,AHAS大亚基E305D或E482D与小亚基G88D突变组成的全酶与墅生型相比其活性均降低,其中E305D活性为野生型的74.4%,E482D为58.1%。当AHAS大亚基不同结构域特定位置发生点突变时,其活性会降低,此结果与在细菌及波菜中的研究结果一致。然而,在拟南芥中,与细菌或波菜的对应位点突变后,其活性降低程度与细菌与波菜中不同。比对不同物种AHAS蛋白编码序列发现,其序列含有5个保守结构域,E305与E482处于第3与第4个结构域中,在拟南芥中,两个结构域上位点突变均导致酶活性的下降,但下降幅度与其它物种不同,此可能是由于拟南芥AHAS序列及其空间结构上的不同所致。在细菌与波菜中,第3与第4结构域在反应中可结合镁离子,第3结构域介导后续还原反应,而第4结构域介导后续异构化反应过程[12-13]。当在此两个结构域上特定位点发生突变后,对AHAS活性在总趋势为下降的同时,也存在物种特异性。
AHAS小亚具有稳定并调节大亚基活性的作用,也介导了支链氨基酸终端产物对全酶的活性调节,尽管目前未发现小亚基结合支链氨基酸的直接证据,但对酵母AHAS活性体外测定发现,当存在支链氨基酸时,其大亚基活性的确会发生变化[18]。已有研究发现,在支链氨基酸作为终端产物时,在缬氨酸、亮氨酸和异亮氨酸中,对其活性起主要影响的为缬氨酸,而其它两种的影响较小[19]。本研究中,当缬氨酸在体外活性测定体系中达1 mmol/L时,对AHAS全酶活性影响与无缬氨酸时显示出不同的效果,其对大亚基E305D突变酶活性影响较小,而对E482D的影响较大。不同缬氨酸浓度对AHAS野生型及突变形式全酶活性的影响测定中也发现,其活性变化与在1 mmol/L浓度下的趋势相同,在不同缬氨酸浓度下,野生型与突变形式AHAS全酶活性均受到终端缬氨酸的抑制,对突变形式的影响较野生型小,在2种大亚基突变形式中,E305D突变较E482D表现出对终端抑制更具有抗性,且此抑制效应存在于0~0.01 mmol/L狭窄的浓度范围内。此抑制抗性效果显然来源于AHAS小亚基G88D突变。已有研究显示:当此位点突变后可解除终端支链氨酸对AHAS的活性抑制作用,拟南芥AHAS小亚基与细菌不同,含有2个ACT结构域(细菌中仅含有一个),在细菌体内,AHAS更倾向于形成2个大亚基与2个小亚基的四聚体,而介导终端产物抑制位置存在于2个小亚基组成的二聚体界面上[20-22]。拟南芥中,由于小亚基含有两个ACT结构域,其在调节大亚基活性的过程中与其它物种的不同,已有对小亚基不同ACT结构域突变分析表明,其作用方式为在小亚基上的两个ACT结构域存在着分子内的相互作用,2个ACT形成U型结构,且2个ACT在介导大亚基活性抑制中均起作用[15]。本研究结果表明,一方面当小亚基特定位点(G88D)发生突变后消除了其对大亚基活性的反馈抑制作用,另一方面,由于大亚基上同时存在的突变使得其对大亚基活性的抑制影响又存在差异。
本研究中,对AHAS大小亚基同时进行突变,在小亚基上突变可解除终端产物抑制的前提下考察大亚基不同位点对全酶活性的影响。已有研究中,AHAS小亚基可通过与大亚基解离与结合达到调节全酶活性目的。基于本研究结果,可推测AHAS终端支链氨基酸对其活性影响来源于其全酶空间结构变化,一方面,终端产物的结合可使AHAS小亚基空间结构发生变化,且不同浓度终产物对其结构变化影响不同,另一方面结构变化后的小亚基与大亚基的相互作用也将会对大亚基的空间结构产生影响,而AHAS大亚基不同活性位点突变所产生的结构变化也会反映于全酶最终活性上。对AHAS而言,可能存在不同位点突变产生的连续结构变化和阈值效应,当在一定空间变化范围内,该结构变化仅不同程度地影响全酶活性,而超过阈值后将完全消除其酶活性。不能排除在其大小亚基上是否存在已研究位点之外对AHAS活性可产生影响的其它位点,对此推测的验证及AHAS突变后体内功能评估是本研究的下一步工作。
[1] HARRIS R A,JOSHI M,JEOUNG N H,etal.Overview of the molecular and biochemical basis of branched-chain amino acid catabolism[J].J.Nutr.,2005,135(6):1 527-1 530.
[2] NAIR K S,SHORT K R.Hormonal and signaling role of branchedchain amino acids[J].J.Nutr.,2005,135(6):1 547S-1 552S.
[3] BROSNAN J T,BROSNAN M E.Branched-chain amino acids:enzyme and substrate regulation[J].J.Nutr.,2006,136(1):207S-211S.
[4] HUTSON S M,LIETH E,LANOUE K F.Function of leucine in excitatory neurotransmitter metabolism in the central nervous system[J].J.Nutr.,2001,131(3):846S-850S.
[5] FERNSTROM J D.Branched-chain amino acids and brain function[J].J.Nutr.,2005,135(6):1 539-1 546.
[6] DUGGLEBY R G,PANG S S.Acetohydroxyacid synthase[J].J.Biochem.Mol.Biol.,2000,33(1):1-36.
[7] SINGH B K,SHANER D L.Biosynthesis of branched chain amino acids:from test tube to field[J].PlantCell,1995,7(7):935-944.
[8] VYAZMENSY M,SELLA C,BARAK Z,etal.Isolation and characterization of subunits of acetohydroxy acid synthase isozyme III and reconstitution of the holoenzyme[J].Biochemistry,1996,35(32):10 339-10 346.
[9] CHIPMAN D M,DUGGLEBY R G,TITTMANN K.Mechanisms of acetohydroxyacid synthases[J].Curr.Opin.Chem.Biol.,2005,9(5):475-481.
[10] SCHUSTER J,BINDER S.The mitochondrial branched-chain aminotransferase (AtBCAT-1) is capable to initiate degradation of leucine,isoleucine and valine in almost all tissues inArabidopsisthaliana[J].PlantMol.Biol.,2005,57(2):241-254.
[11] LEE Y H,FOSTER J,CHEN J,etal.AAP1 transports uncharged amino acids into roots ofArabidopsis[J].PlantJ.,2007,50(2):305-319.
[12] RAJIV T,LEE Y T,LUKE W,etal.Probing the mechanism of the bifunctional enzyme ketol-acid reductoisomerase by site-directed mutagenesis of the active site[J].FEBSJ.,2005,272(2):593-602.
[13] RENAUD D,MARIE C B,DOMINIQUE J,etal.Evidence for two catalytically different magnesium-binding sites in acetohydroxy acid isomeroreductase by site-directed mutagenesist[J].Biochem.,1995,34(18):6 026-6 036.
[14] MENDEL S,ELKAYAM T,SELLA C,etal.Acetohydroxyacid synthase:a proposed structure for regulatory subunits supported by evidence from mutagenesis[J].J.Mol.Biol.,2001,307(1):465-477.
[15] CHEN H,SAKSA K,ZHAO F Y,etal.Genetic analysis of pathway regulation for enhancing branched-chain amino acid biosynthesis in plants[J].ThePlantJournal,2010,63(4):573-583.
[16] CHANG A K,DUGGLEBY R G.Expression,purification and characterization ofArabidopsisthalianaacetohydroxyacid synthase[J].Biochem.J.,1997,327(1):161-169.
[17] LEE Y T,DUGGLEBY R G.Identification of the regulatory subunit ofArabidopsisthalianaacetohydroxyacid synthase and reconstitution with its catalytic subunit[J].Biochemistry,2001,40(23):6 836-6 844.
[18] SIEW S P,RONALD G D.Regulation of yeast acetohydroxyacid synthase by valine and ATP[J].Biochem.J.,2001,357(3):749-757.
[19] MIFLIN B J,CAVE P R.The control of leucine,isoleucine,and valine biosynthesis in a range of higher plants[J].J.Exp.Bot.,1972,23(2):511-516.
[20] PANG S S,DUGGLEBY R G,GUDDAT L W.Crystal structure of yeast acetohydroxyacid synthase:a target for herbicidal inhibitors[J].J.Mol.Biol.,2002,317(2):249-262.
[21] PANG S S,GUDDAT L W,DUGGLEBY R G.Molecular basis of sulfonylurea herbicide inhibition of acetohydroxyacid synthase[J].J.Biol.Chem.,2003,278(9):7 639-7 644.
[22] DUGGLEBY R G,MCCOURT J A,GUDDAT L W.Structure and mechanism of inhibition of plant acetohydroxyacid synthase[J].PlantPhysiol.Biochem.,2008,46(3):309-324.
(编辑:宋亚珍)
Expression and Determination of Activity of the PointMutatedArabidopsisAcetohydroxyacid Synthase
ZHAO Feiyi,JIAO Chengjin,TIAN Chunfang,WANG Taishu,XIE Shangqiang,HE Lijuan
(School of Bioengineering & Biotechnology,Tianshui Normal University,Tianshui,Gansu 741001,China)
Acetohydroxyacid synthase(AHAS) is involved in the synthesis of branched-chain amino acids(BCAAs) inArabidopsis.To investigate the effects of various domains of AHAS on the BCAAs synthesis,the point mutations harboring in the specific sites of the large and small units of AHAS were introduced by site-directed mutagenesis.The mutagened histidine-tagged units of AHAS were expressed individually in the bacterial hosts and the recombinant proteins were purified using Ni beads.The point mutated large and small units were reconstitutedinvitroand the activities of holoenzymes were determined.Moreover,the effects of valine,which is one of the final end products of AHAS,on the activities of the mutated holoenzymes were also examined.The results showed that the G88D mutation in the small unit of AHAS abolished the final end product inhibition and the E305D or E482D mutation in the large unit decreased the activity of AHAS holoenzyme.The two mutations in the large unit displayed difference in the activity of AHAS and the E482D mutation presents the more effects than the E305D on the activity of AHAS.The results in this study suggest that the large unit interacts with the small unit in the AHAS and the various domains in the units of AHAS exhibit distinct functions.
AHAS;point mutation;bacterial expression;holoenzyme activity
1000-4025(2015)04-0662-07
10.7606/j.issn.1000-4025.2015.04.0662
2014-12-17;修改稿收到日期:2015-02-03
国家自然科学基金(31160060,31260568)
赵菲佚(1972-),男,博士,副教授,主要从事植物分子生物学研究。E-mail:tspaulzhao@163.com
Q786;Q789
A

