玉米胚胎发生后期丰富蛋白基因的启动子克隆与功能验证
邹郁陶,刘 鑫,牟 巍,高学焕,付凤玲,李晚忱
(四川农业大学 玉米研究所,成都 611130)
玉米胚胎发生后期丰富蛋白基因的启动子克隆与功能验证
邹郁陶,刘 鑫,牟 巍,高学焕,付凤玲,李晚忱*
(四川农业大学 玉米研究所,成都 611130)
该研究在生物信息学分析的基础上,克隆玉米胚胎发生后期丰富蛋白基因(MGL3)的启动子序列(pMGL3),进行非生物逆境应答元件分析以及实时定量PCR验证其非生物逆境胁迫响应特性,构建了pMGL3启动子驱动报告基因(GUS)表达载体,基因枪法转化玉米愈伤组织,通过GUS染色验证pMGL3启动子在非生物逆境胁迫下的驱动活性。再根据启动子序列分析结果,去除不同的顺式作用元件,构建不同长度pMGL3启动子驱动报告基因GUS表达载体,农杆菌介导法转化烟草叶盘,以确定pMGL3启动子的最短活性序列。结果显示:pMGL3启动子长1 554 bp,存在多种与非生物逆境胁迫应答相关的调控元件,在干旱、高盐、低温胁迫及脱落酸、乙烯诱导下驱动MGL3基因增量表达,用以驱动GUS基因转化玉米愈伤组织,在高渗、高盐、低温胁迫及脱落酸诱导下具有驱动活性,且截短至325 bp仍可保持驱动活性。研究表明,pMGL3启动子的确有非生物逆境诱导启动活性,进一步验证其作用机理后可运用于玉米抗逆转基因研究。
非生物胁迫;胚胎发生后期丰富蛋白;玉米;启动子
近年来,人类活动和气候变化等引起的非生物胁迫愈加严重,已成为中国及世界许多地区作物生产的主要限制因素[1]。耐旱、耐盐碱等对非生物逆境的抗性一直是常规玉米育种的重要目标性状。虽然不同玉米种质对非生物逆境的抗性存在明显差异,但其遗传性质较为复杂,多年来遗传改良的进展不大,难以满足玉米生产对品种抗逆性的要求[2-4]。转基因技术可转化利用外源抗性基因,是改良玉米非生物逆境抗性的有效途径[5-9]。然而,在以往的转基因研究中,多采用ubiquitin、CaMV35S等组成型强启动子驱动外源基因的表达。虽然抗逆性得以改良提高,但外源抗逆基因的持续表达,过量消耗植物营养和能源,又会阻碍植物的正常生理代谢,致使非胁迫条件下的生长发育受到制约,限制了产量潜力的进一步发挥[10-13]。转而改用诱导型启动子,只在逆境胁迫时才驱动外源抗性基因表达,渡过逆境后又恢复正常,就可降低外源基因过量表达造成的适应性代价[14]。而且还有研究表明,用内源诱导型启动子的驱效率往往比外源诱导型启动子要高[15-17]。
因此,要很好地发挥外源基因在非生物逆境抗性转基因玉米种质培育中的作用,除对外源基因本身的功能选择外,还应注重选择适当的内源诱导型启动子,既可在逆境胁迫条件下适当驱动外源抗逆基因的表达,提高玉米对非生物逆境的抗性,又可在非胁迫条件下降低外源基因过量表达造成的适应性代价。因为玉米功能基因组研究比拟南芥和水稻等模式植物滞后,除发现胚胎发生后期丰富蛋白基因rab17和转录因子基因Vp1(Viviparous1)的启动子响应脱落酸诱导[18-19],磷脂酰乙醇胺N-甲基转移酶基因ZmPEAMT的启动子区域存在高盐、高温应答元件[20],抗病基因ZmRXO1的启动子区域存在茉莉酸、赤霉素和脱落酸应答元件,可在非生物逆境胁迫条件下驱动下游基因的表达而外[21],鲜有关于玉米内源非生物逆境诱导启动子克隆及功能验证方面的报道。
胚胎发生后期丰富蛋白(LEA)可在脱水、高渗和低温等非生物逆境胁迫下保护细胞内其他蛋白的活性[22-30]。其中,尤以第3亚家族的LEA蛋白的这种保护作用最为明显[27-30]。转化利用LEA蛋白的编码基因,可以提高植物对非生物逆境的抗性[8-9]。而且,LEA蛋白编码基因的启动子对各种非生物逆境胁迫也有应答,可在植物转基因操作中用以驱动其他抗逆基因的逆境诱导表达[31-32]。本研究在前人研究的基础上[22,26],先用实时定量PCR(qRT-PCR)验证玉米LEA蛋白第3亚家族一个成员的编码基因MGL3在非生物逆境胁迫下的诱导表达,然后对其上游序列作启动子分析,并克隆其启动子pMGL3,用以构建驱动报告基因GUS的表达载体,基因枪法转化玉米愈伤组织。通过愈伤组织的GUS荧光值与荧光素酶(LUC)发光值的比值GUS/LUC,评价pMGL3启动子在非生物逆境胁迫及激素诱导条件下的驱动活性,以期为抗逆转基因玉米研究提供更多的选择。
1 材料和方法
1.1 实验材料
为验证pMGL3启动子对非生物逆境胁迫的响应,先在各种不同的非生物胁迫及激素诱导条件下,qRT-PCR检测MGL3基因的差异表达。取玉米自交系‘178’种子,10% NaClO消毒后发芽至二叶期,用改良Hoagland营养液培养至四叶期[33],分别用16%聚乙二醇6000(PEG-6000)模拟干旱[34]和高盐(200 mmol·L-1NaCl)处理72 h,低温(4 ℃)和高温(42 ℃)处理24 h,以及100 μmol·L-1脱落酸(ABA)和100 μmol·L-1乙烯利诱导24 h,3次重复。在模拟干旱、高盐处理的0、12、24、48、72 h,以及低温、高温处理和ABA、乙烯利诱导的0、2、6、12、24 h取样,用Trizol试剂盒(TaKaRa,大连)提取总RNA,再用PrimeScriptTM试剂盒(TaKaRa,大连)反转录成cDNA,稀释5倍后作qRT-PCR模板。
1.2 非生物胁迫处理与qRT-PCR检测
根据玉米LEA蛋白第3亚家族成员MGL3(GenBank登录号NP_001105298)对应的mRNA序列(GenBank登录号NM_001111828)[22,26],用Primer 6.0软件(http://www.premierbiosoft.com)设计特异PCR引物(5′-GACCCTGTTTGCTTGTTC-3′/5′-ACACTTGATGACGCAGAA-3′),生工生物工程公司(上海)合成。以玉米18S基因作内参,10 μL反应体系包括:荧光染料SsoFast EvaGreen supermix(Bio-Rad,美国)5.0 μL、上下游引物(10.0 μmol·L-1)各0.5 μL和稀释后的cDNA模板1.0 μL。在 CFX96定量PCR仪(Bio-Rad,美国)进行反应。反应程序为:98 ℃预变性2 min;98 ℃变性2 s,60.2 ℃退火10 s,循环44次。然后,以每步0.5 ℃/0.01 s速度升高至95 ℃,绘制熔解曲线。采用双标准曲线法对MGL3基因的表达水平进行相对定量测定,计算不同胁迫或诱导时间MGL3基因表达量相对于0 h对照的倍数。
1.3 启动子序列分析与克隆
以玉米LEA蛋白第3亚家族成员MGL3对应的mRNA序列为探针[22,26],与玉米自交系‘B73’基因组RefGen_v3版本(http://www.ncbi.nlm.nih.gov/nuccore/)序列比对,定位MGL3基因在基因组中的物理位置。用启动子分析软件PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/),查找编码序列上游1 500 bp以内的CAAT与TATA框等重要启动子序列特征,预测pMGL3启动子序列,并分析其中与非生物胁迫应答相关的顺式作用元件。
根据预测结果,用Primer 6.0软件(http://www.premierbiosoft.com)设计特异PCR引物(5′-AAGCTTGAACTCTCGACCTCAGGATAACTC-3′/5′-GGATCCGGCAGCAGGGTCTCTCAAG-3′),并引入载体构建所需要的限制性内切酶HindⅢ和BamHⅠ的识别位点(括号中下划线部分)。以玉米自交系‘B73’的基因组DNA为模板,用高保真DNA聚合酶PCR扩增pMGL3启动子序列。20 μL反应体系包括:PCR缓冲液SxPrimerSTAR(Mg2+)4 μL,dNTP 1.64 μL,上下游引物各0.5 μL,玉米自交系‘B73’基因组DNA 1 μL,DNA聚合酶PrimerSTAR HS 0.2 μL,ddH2O至20 μL。PCR反应程序为:98 ℃预变性3 min;98 ℃变性10 s,60 ℃退火15 s,72 ℃延伸90 s,35个循环;72 ℃延伸5 min;4 ℃保存。扩增产物用2%琼脂糖凝胶电泳分离,回收纯化1 500 bp左右的目的片段。
1.4 瞬时表达载体构建与玉米愈伤组织转化
用限制性内切HindⅢ和BamHⅠ分别双酶切上述回收纯化的PCR扩增产物和单子叶植物瞬时表达载体pBI221-Ubi-GUS[35],琼脂糖凝胶电泳分离,回收、纯化pMGL3启动子序列和去除组成型启动子Ubi序列的表达载体片段,用T4DNA连接酶(TaKaRa,大连)连接,构建pMGL3启动子驱动报告基因GUS的瞬时表达载体pBI221-pMGL3-GUS(图1),热激法转化大肠杆菌DH5α菌株的感受态细胞,经氨苄青霉素抗性培养基上筛选后扩大培养,菌液PCR和HindⅢ和BamHⅠ双酶检测后,送生工生物工程公司(上海)测序验证。
取浓度为1.0 μg·μL-1瞬时表达载体 pBI221-pMGL3-GUS质粒DNA 3 μL,并以单子叶植物组成型启动子Ubi驱动荧光素酶基因LUC的表达载体pUbi-LUC为内参,以消除愈伤组织间基因枪转化率的差异。加入20 μL 0.5 mol·L-1亚精胺和50 μL 2.5 mol·L-1CaCl2,沉淀到3 mg直径60 μm的金粉(金粉·甘油=60 mg·mL-1)上,用乙醇和无菌蒸馏水反复洗涤,涡旋震荡并用色谱级140 μL 70%乙醇洗涤后,加入60 μL无水乙醇,涡旋震荡1 min并用超声波处理3~5 s使金粉分散悬浮。在DuPont PDS1000/He型基因枪上,以1 100 psi系统压力和70 cm汞柱真空度,每枪1.0 μg·mg-1(质粒/金粉),转化在N6高渗培养基上预培养4 h的玉米胚性愈伤组织各10皿[36],每皿100块愈伤组织。
1.5 GUS染色检测
将转化后的愈伤组织转接到N6继代培养基上,27 ℃黑暗培养2 d后,选大小和形态基本一致的愈伤组织各15皿,每皿60块愈伤组织,分别实施高渗(8%甘露醇)、高盐(200 mmol·L-1NaCl)、低温(4 ℃)处理和ABA(100 μmol·L-1)诱导24 h。每处理3皿,其余3皿作空白对照。处理结束后,用Jefferson等[37]的方法染色,解剖显微镜下观察照像。
1.6 5′-端缺失实验
为确定pMGL3启动子具有启动活性的最短序列,根据启动子序列分析结果设计6对PCR引物F1/R1、F1/R2、F2/R1、F3/R1、F4/R1和F5/R2,以玉米自交系‘B73’基因组DNA为模板,分别扩增pMGL3启动子序列全长的1 554 bp片段、增加5′-端非编码序列(5′-untranslated region,5′-UTR)的1 720 bp片段,以及去除不同非生物胁迫应答元件的1 129、690、429和325 bp片段,通过相应的酶切连接取代包含双子叶植物增强子AtADH5′-UTR的表达载体pRI201-AN-GUS(TaKaRa,大连)中的35S启动子(图2),并以组成型强启动子ubiquitin为对照,构建瞬时表达载体,农杆菌介导法转化大叶烟草品种‘Wisconsin 38’叶盘,经筛选鉴定后分化培养愈伤组织,GUS染色鉴定上述截短片段是否能够驱动GUS基因表达。
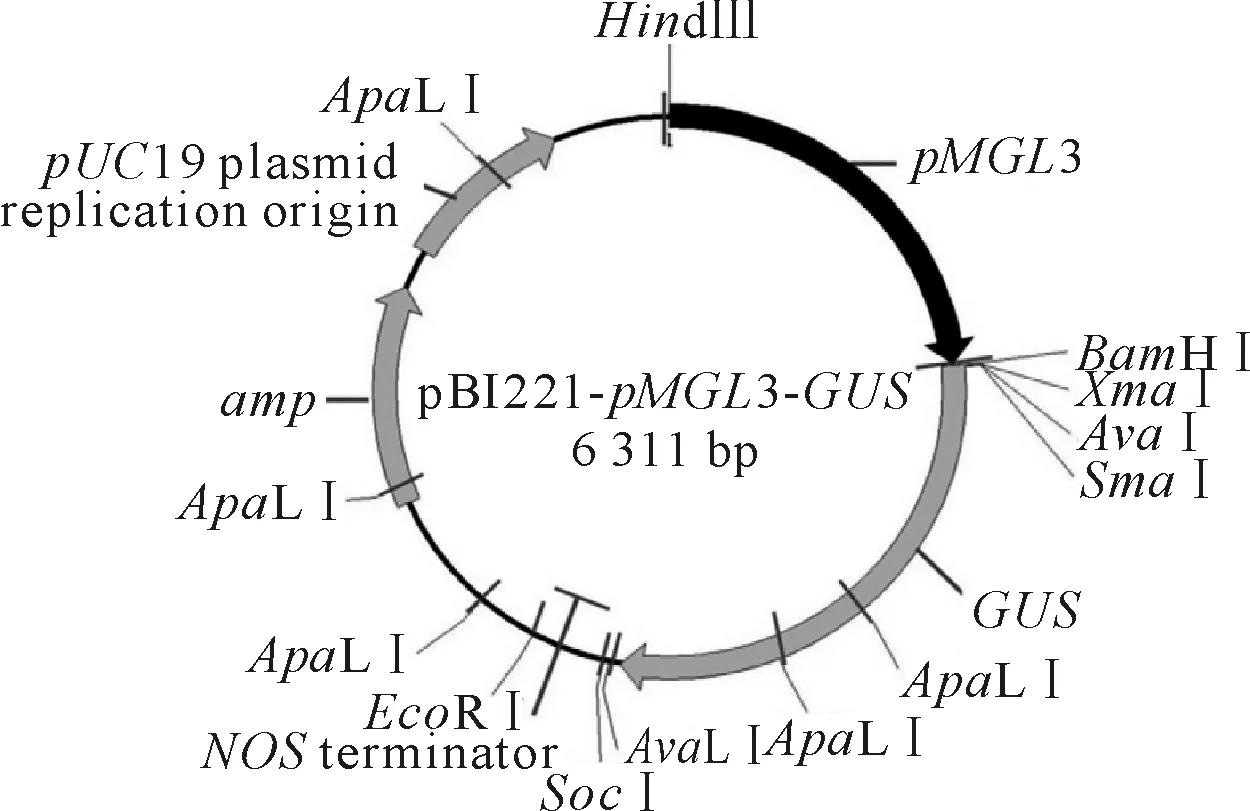
图1 pMGL3启动子驱动报告基因GUS表达载体(pBI221-pMGL3-GUS)
2 结果与分析
2.1 MGL3基因在非生物逆境胁迫下诱导表达
对qRT-PCR结果的方差分析表明,在模拟干旱胁迫初期(0~24 h),MGL3基因表达水平与0 h空白对照无差异,但在48 h时有一表达高峰,72 h后下降(图3)。在高盐胁迫下,MGL3基因的表达从12 h开始上升,24 h达到高峰,随后下降(图3)。在低温胁迫下,MGL3基因表达的高峰出现在6 h,其他时间段与0 h空白对照无显著差异(图4)。MGL3基因表达对高温胁迫的应答不明显,只在24 h后才略有升高(图4)。在ABA和乙烯诱导下,MGL3基因表达的高峰分别出现在6 h和2 h,其余时间段与0 h空白对照的差异不显著(图4)。结果表明,MGL3基因的表达响应多种非生物逆境胁迫,其启动子pMGL3很可能具有非生物逆境启动活性。
2.2 pMGL3启动子序列
以玉米LEA蛋白第3亚家族成员MGL3对应的mRNA序列为探针,与玉米自交系“B73”基因组RefGen_v3版本序列比对,将MGL3基因定位于第6染色体Chr6:162162323~162163588,与此段基因组序列的一致性为100%。用PlantCARE软件对其编码序列上游1 500 bp(Chr6:162160979~162162478)启动子序列分析表明,除TATA框等启动子序列的基本元件外,还包括MYB结合位点MBS、脱水应答元件ABRE及ARE等多种响应非生物逆境胁迫的顺式作用元件(图5、表1)。
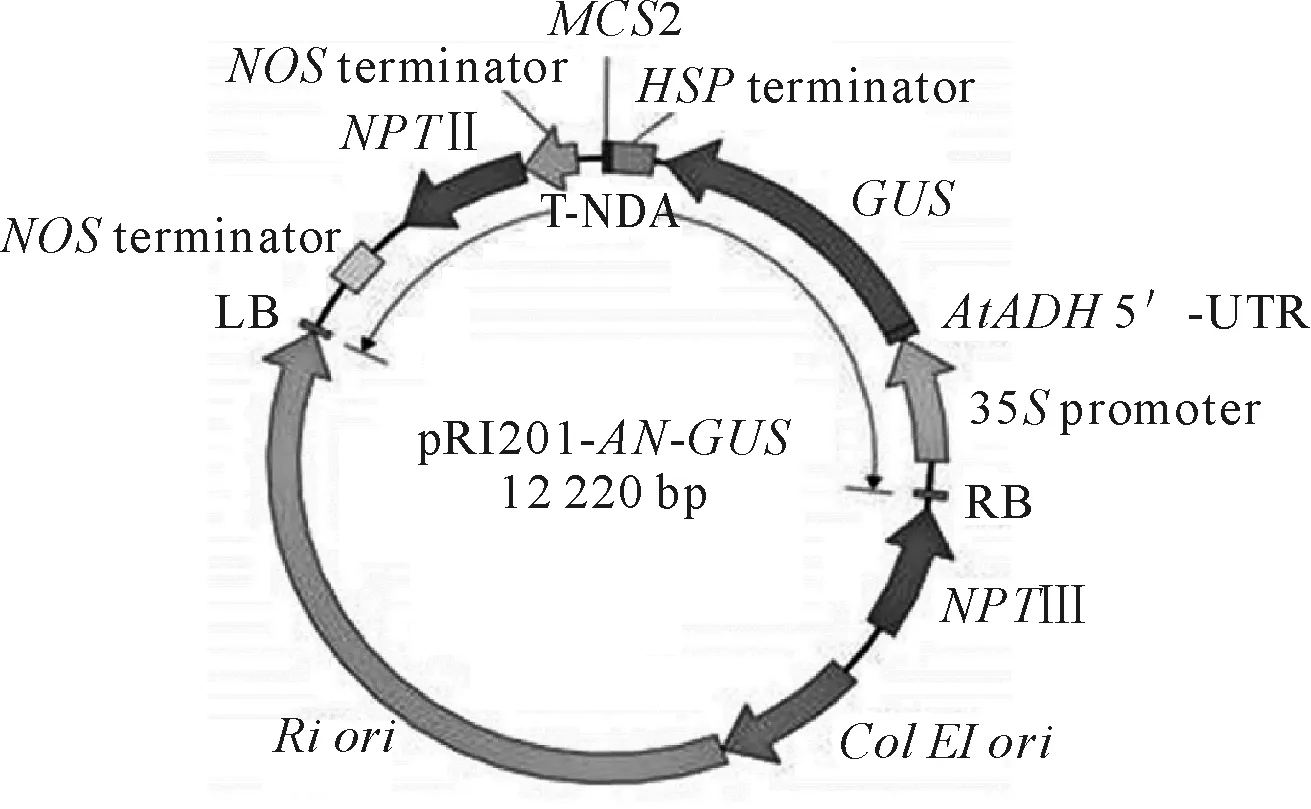
图2 包含双子叶植物增强子AtADH5′-UTR的表达载体(pRI201-AN-GUS)
2.3 逆境胁迫下pMGL3驱动GUS基因瞬时表达
根据启动子序列分析设计的特异PCR引物,以玉米自交系‘B73’基因组DNA为模板,扩增得到的片段约长1 500 bp(图6),实际测序结果为1 554 bp,与预测结果相符合。
扩增片段经HindⅢ和BamHⅠ双酶切后插入单子叶植物表达载体pBI221-Ubi-GUS,构建成MGL3基因启动子驱动GUS基因的表达载体pBI221-pMBL3-GUS,转化大肠杆菌感受态细胞,经菌液PCR检测挑阳性克隆扩大培养,再经HindⅢ和BamHⅠ双酶切鉴定(图7)和测序验证,与预期相符。
用表达载体pBI221-pMGL3-GUS基因枪法转化玉米胚性愈伤组织,在8%甘露醇高渗、200 mmol·L-1NaCl高盐和4 ℃低温胁迫及100 mol·L-1ABA诱导条件下,GUS染色均可显现靛蓝色斑点,而空白对照没有显现(图8),说明pMGL3启动子的确有非生物逆境诱导启动功能。

图3 MGL3基因在干旱和高盐胁迫下的差异表达

图4 MGL3基因在低温、高温胁迫和ABA、乙烯诱导下的差异表达

图5 玉米MGL3基因启动子序列及其非生物逆境胁迫应答元件下划实线表示非生物逆境胁迫应答元件,下划虚线表示截短引物

表1 玉米MGL3基因启动子的非生物逆境胁迫应答元件
2.4 保持启动活性的截短片段
瞬时表达载体转化烟草愈伤组织的GUS染色结果表明,5′端截短不同长度的pMGL3启动子片段,均能驱动GUS的表达,愈伤组织呈现靛蓝色斑点(图9)。一直截短至325 bp仍可保持pMGL3启动子的驱动活性。由此说明,这325 bp上游的非生物逆境胁迫应答元件,虽然可能响应胁迫诱导而增强pMGL3启动子的活性,但并不是保持驱动活性所必需的。

图6 MGL3基因启动子扩增片段M.DL2000;1.pMGL3启动子

图7 表达载体pBI221-pMGL3-GUS酶切鉴定M.DL2000;1.表达载体pBI221-pMGL3-GUS经HindⅢ和BamHⅠ双酶切片段

图8 pBI221-pMGL3-GUS转化玉米愈伤组织GUS染色

图9 pMGL3启动子不同长度截短片段驱动GUS基因转化烟草愈伤组织GUS染色a~f.分别为1 720、1 554、1 129、 690、429和325 bp片段;g.Ubiquitin;h.空白对照
3 讨 论
PlantCARE分析结果表明,pMGL3启动子含有ABRE、ARE、MBS、TC-rich repeat等顺式作用元件。这些元件的非生物逆境应答特性在以往的研究中已有较多的报道。譬如,ABRE元件与高盐胁迫[22-23]、干旱胁迫和ABA诱导相关[38],ARE与厌氧应答相关[39],MBS元件与干旱等多种非生物逆境胁迫相关[38,40],TC-rich repeat与防卫和胁迫有关[41-42],TCA-element参与水杨酸反应[42-43]等等。
在本研究中,根据序列中非生物逆境顺式作用元件分析结果,将pMGL3启动子截短至325 bp仍可保持其驱动活性,还不能说明是否为pMGL3启动子保持驱动活性的最短片段,而只说明那些与非生物逆境胁迫应答相关的顺式作用元件只起基因表达强度的调控作用,而不起开关的决定性作用。棉花胚胎发生后期丰富蛋白基因D113启动子5′端截短实验的结果也表明,保持非生物逆境响应及驱动活性的最短序列在158至574 bp之间[44]。有研究表明,不同来源的胚胎发生后期丰富蛋白基因启动子,对非生物逆境的响应及驱动活性不尽相同。譬如,大麦胚胎发生后期丰富蛋白基因启动子Dhn4s的驱动活性是来自大麦和水稻同源启动子HVA1s和wsi18j的2倍,是来自水稻同源启动子rab16Bj的17倍[45]。要明确这些非生物逆境胁迫应答相关顺式作用元件对基因表达强度的具体调控作用,更需要对其驱动的基因表达做定量分析。本研究的定量PCR分析结果能够从整体上说明这一问题,但截短去除不同顺式作用元件后的pMGL3启动子片段驱动GUS基因转化烟草愈伤的GUS染色,只能定性地说明各种不同长度的截短片段仍保持其驱动活性,不能说明驱动活性的定量变化。
在模式植物上的研究表明,胚胎发生后期丰富蛋白基因的启动子可响应多种非生物逆境胁迫的诱导,驱动抗逆相关基因的表达[46-47]。本研究克隆的玉米胚胎发生后期丰富蛋白基因MGL3的启动子pMGL3,存在多种与非生物逆境胁迫应答相关的调控元件,可响应干旱、高盐、低温等多种非生物逆境胁迫和激素诱导,驱动下游基因的表达。进一步研究验证其作用机理后,可为抗逆转基因玉米研究提供更多的选择。
[1] TAMBO J A,ABDOULAYE T.Climate change and agricultural technology adoption:the case of drought tolerant maize in rural Nigeria[J].MitigationandAdaptionStrategiesforGlobalChange,2012,17(3):277-292.
[2] FU F L,FENG Z L,GAO S B,etal.Evaluation and quantitative inheritance of several drought-relative traits in maize[J].AgriculturalSciencesinChina,2008,7(3):280-290.
[3] LU Y,HAO Z,XIE C,etal.Large-scale screening for maize drought resistance using multiple selection criteria evaluated under water-stressed and well-watered environments[J].FieldCropResearch,2011,124(1):37-45.
[4] NEUMANN P M.Coping mechanisms for crop plants in drought-prone environments[J].AnnalsofBotany,2008,101(7):901-907.
[5] GILMOUR S J,SEBOLT A M,SALAZAR M P,etal.Overexpression of theArabidopsisCBF3 transcriptional activator mimics multiple biochemical changes associated with cold acclimation[J].PlantPhysiology,2000,124(4):1 854-1 865.
[6] KARIM S,ARONSSON H,ERICSON H,etal.Improved drought tolerance without undesired side effects in transgenic plants producing trehalose[J].PlantMolecularBiology,2007,64(4):371-386.
[7] TAO D,MU Y,FU F L,etal.Transformation of maize with trehalose synthase gene cloned fromSaccharomycescerevisiae[J].Biotechnology,2008,7(2):258-265.
[8] GANGULY M,DATTA K,ROYCHOUDHURY A,etal.Overexpression ofRab16Agene inIndicarice variety for generating enhanced salt tolerance[J].PlantSignaling&Behavior,2012,7(4):502-509.
[9] AMARA I,CAPELLADES M,LUDEVID M D,etal.Enhanced water stress tolerance of transgenic maize plants over-expressingLEARab28 gene[J].JournalofPlantPhysiology,2013,170(9):864-873.
[10] VAUCHERET H,BECLIN C,ELMAYAN T,etal.Transgene-induced gene silencing in plants[J].PlantJournal,1998,16(6):651-659.
[11] MALNOY M,REYNOIRD J P,BOREJSZA-WYSOCKA E E,etal.Activation of the pathogen-inducibleGst1 promoter of potato after elicitation byVenturiainaequalisandErwiniaamylovorain transgenic apple (Malus×domestica)[J].TransgenicResearch,2006,15(1):83-93.
[12] KARIM S,ARONSSON H,ERICSON H,etal.Improved drought tolerance without undesired side effects in transgenic plants producing trehalose[J].PlantMolecularBiology,2007,64(4):371-386.
[13] KARABA A,DIXIT S,GRECO R,etal.Improvement of water use efficiency in rice by expression ofHARDY,anArabidopsisdrought and salt tolerance gene[J].TheProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica,2007,104(39):15 270-15 275.
[14] KASUGA M,LIU Q,MIURA S,etal.Improving plant drought,salt and freezing tolerance by gene transfer of a single stress-inducible transcription factor[J].NatureBiotechnology,1999,17(3):287-291.
[15] YAMAGUCHI-SHINOZAKI K,MINO M,MUNDY J,etal.Analysis of an ABA-responsive rice gene promoter in transgenic tobacco[J].PlantMolecularBiology,1990,15(6):905-912.
[16] ONO A,IZAWA T,CHUA NH,etal.Therab16Bpromoter of rice contains two distinct abscisic acid-responsive elements[J].PlantPhysiology,1996,112(2):483-491.
[17] RAI M,HE C,WU R.Comparative functional analysis of three abiotic stress-inducible promoters in transgenic rice[J].TransgenicResearch,2009,18(5):787-799.
[18] BUCHANAN CD,KLEIN PE,MULLET JE.Phylogenetic analysis of 5′-noncoding regions from the ABA-responsiverab16/17 gene family of sorghum,maize and rice provides insight into the composition,organization and function ofcis-regulatory modules[J].Genetics,2004,168(3):1 639-1 654.
[19] CAO X,COSTA LM,BIDERRE-PETIT C,etal.Abscisic acid and stress signals induceViviparous1 expression in seed and vegetative tissues of maize[J].PlantPhysiology,2007,143(2):720-731.
[20] WU S,YU Z,WANG F,etal.Cloning,characterization,and transformation of the phosphoethanolamine N-methyltransferase gene (ZmPEAMT1) in maize (ZeamaysL.)[J].MolecularBiotechnology,2007,36(2):102-112.
[21] TAO Y,WANG F,JIA D,etal.Cloning and functional analysis of the promoter of a stress-inducible gene (ZmRXO1) in maize[J].PlantMolecularBiologyReporter,2015,33(2):200-208.
[22] WHITE CN,RIVIN CJ.Sequence and regulation of a late embryogenesis abundant group 3 protein of maize[J].PlantPhysiology,1995,108(3):1 337-1 338.
[23] HUNDERTMARK M,HINCHA D K.LEA (late embryogenesis abundant) proteins and their encoding genes inArabidopsisthaliana[J].BMCGenomics,2008,9:118.
[24] DALAL M,TAYAL D,CHINNUSAMY V,etal.Abiotic stress and ABA-inducible group 4 LEA fromBrassicanapusplays a key role in salt and drought tolerance[J].JournalofBiotechnology,2009,139(2):137-145.
[25] REDDY P S,REDDY G M,PANDEY P,etal.Cloning and molecular characterization of a gene encoding late embryogenesis abundant protein fromPennisetumglaucum:protection against abiotic stresses[J].MolecularBiologyReporter,2012,39(6):7 163-7 174.
[26] AMARA I,ODENA A,OLIVEIRA E,etal.Insights into maize LEA proteins:from proteomics to functional approaches[J].Plant&CellPhysiology,2012,53(6):312-329.
[27] LIU Y,WANG L,XING X,etal.ZmLEA3,a multifunctional group 3 LEA protein from maize (ZeamaysL.),is involved in biotic and abiotic stresses[J].PlantCellPhysiology,2013,54(6):944-959.
[28] THOMANN E B,SOLLINGER J,WHITE C,etal.Accumulation of group 3 late embryogenesis abundant proteins inZeamaysembryos[J].PlantPhysiology,1992,99(2):607-614.
[29] YU J N,ZHANG J S,SHAN L,etal.Two new group 3LEAgenes of wheat and their functional analysis in yeast[J].JournalofIntegrativePlantBiology,2005,47(11):1 372-1 381.
[30] BATTAGLIA M,OLVERA-CARRILLO Y,GARCIARRUBIO A,etal.The enigmatic LEA proteins and other hydrophilins[J].PlantPhysiology,2008,148(1):6-24.
[31] LUO K M,GUO Y L,XIAO Y H,etal.Cloning and characterozation ofD-113 gene promoter from cotton[J].JournalofGeneticsandGenomics,2002,29(2):161-165.
[32] LIU F(刘 峰),WANG X D(汪小东),ZHAO Y P(赵彦鹏),etal.Isolation and functional characterization of the seed-specific promoter ofLEAgene from cotton (GossypiumhirsutumL.)[J].CottonScience(棉花学报),2014,26(4):310-317(in Chinese)
[33] SMITH G S,JOHNSTON C M,CORNFORTH I S.Comparison of nutrient solutions for growth of plants in sand culture[J].NewPhytologist,1983,94(4):537-548.
[34] MICHEL B E,KAUFMANN M R.The osmotic potential of polyethylene glycol 6000[J].PlantPhysiology,1973,51(5):914-916.
[35] CHEN P Y,WANG C K,SOONG S C,etal.Complete sequence of the binary vector pBI121 and its application in cloning T-DNA insertion from transgenic plants[J].MolecularBreeding,2003,11(4):287-293.
[36] FU F L,HE J,ZHANG Z Y,etal.Further improvement of N6 medium for callus induction an d plant regeneration from maize immature embryos[J].AfricanJournalofBiotechnology,2011,10(14):2 618-2 624.
[37] JEFFERSON R A,BURGESS S M,HIRSEH D.β-glucuronidase fromEscherichiacolias a gene-fusion marker[J].TheProceedingsofNationalAcademyofSciencesintheUnitedStatesofAmerica,1986,83(22):8 447-8 451.
[38] SEKI M,NARUSAKA M,ISHIDA J.,etal.Monitoring the expression profiles of 7000Arabidopsisgenes under drought,cold and high-salinity stresses using a full-length cDNA microarray[J].PlantJournal,2002,31:279-292.
[39] GALLO-EBERT C,DONIGAN M,LIU H Y,etal.The yeast anaerobic response elementAR1bregulates aerobic antifungal drug-dependent sterol gene expression[J].JournalofBiologicalChemistry,2013,288(49):35 466-35 477.
[40] LI PC,YU SW,SHEN J,etal.The transcriptional response of apple alcohol acyltransferase (MdAAT2) to salicylic acid and ethylene is mediated through two apple MYB TFs in transgenic tobacco[J].PlantMolecularBiology,2014,85(6):627-638.
[41] GERMAIN H,LACHANCE D,PELLETIER G,etal.The expression pattern of thePiceaglaucaDefensin1 promoter is maintained inArabidopsisthaliana,indicating the conservation of signaling pathways between angiosperms and gymnosperms[J].JournalofExperimentalBotany,2012,63(2):785-795.
[42] JIANG Y,XIA B,LIANG L,etal.Molecular and analysis of a phenylalanine ammonia-lyase gene (LrPAL2) fromLycorisradiate[J].MolecularBiologyReports,2013,40(3):2 293-2 300.
[43] MOU S,LIU Z,GUAN D,etal.Functional analysis and expressional characterization of rice ankyrin repeat-containing protein,OsPIANK1,in basal defense againstMagnaportheoryzaeattack[J].PublicLibraryofScienceOne,2013,8(3):e59699.
[44] LUO K,ZHANG G,DENG W,etal.Functional characterization of a cotton late embryogenesis-abundantD113 gene promoter in transgenic tobacco[J].SeeCommentinPubMedCommonsbelowPlantCellReports,2008,27(4):707-717.
[45] XIAO F H,XUE G P.Analysis of the promoter activity of late embryogenesis abundant protein genes in barley seedlings under conditions of water deficit[J].PlantCellReports,2001,20(7):667-673.
[46] BATTAGLIA M,OLVERA-CARRILLO Y,GARCIARRUBIO A,etal.The enigmatic LEA proteins and other hydrophilins[J].PlantPhysiology,2008,148(1):6-24.
[47] ZHAO P,LIU F,ZHENG G,etal.Group 3 late embryogenesis abundant protein inArabidopsis:structure,regulation,and function[J].ActaPhysiologiaePlantarum,2011,33(4):1 063-1 073.
(编辑:宋亚珍)
封面植物介绍——秦岭石蝴蝶
秦岭石蝴蝶(PetrocosmeaqinlingensisW.T.Wang),隶属于苦苣苔科,石蝴蝶属,是本属分布最北缘的种,为多年生宿根草本。叶7~12枚,具长或短柄;叶片草质,宽卵形、菱状卵形或近圆形,长0.7~3 cm,宽0.7~2.8 cm,顶端圆形或钝,基部宽楔形,边缘浅波状或有不明显圆齿,两面疏被贴服短柔毛。花序2~6,顶生1花。花萼5裂达基部,外面疏被短柔毛;花冠淡紫色,外面疏被贴服短柔毛,内面在上唇被白色柔毛;花冠筒长约2.8 mm,上唇长约4.8 mm,2深裂,下唇与上唇近等长,3深裂,所有裂片近长圆形,顶端圆形。可育雄蕊2,着生于近花冠基部。雌蕊长约5 mm,子房与花柱被开展的白色柔毛,柱头小,球形。花期8~9月。秦岭石蝴蝶花冠筒内面被毛,与其近缘种中华石蝴蝶(P.sinensisOliv.)的区别是后者花冠筒内面无毛。
秦岭石蝴蝶是由我国著名分类学家王文采教授在20世纪80年代描述并命名的新物种。模式标本产地为陕西省勉县茶店,之后近30年间的调查中,均未发现其野生居群。直到近年,在陕西省第二次野生植物资源调查和汉中市极小种群野生植物秦岭石蝴蝶、庙台槭资源调查中被重新发现。
秦岭石蝴蝶是秦岭地区特有的珍稀濒危野生植物,一般生长于阴湿山谷岩石上,群落上层为落叶阔叶林,郁闭度比较高。由于其野生居群地理分布极为狭窄,个体数量稀少,已经被列入第一批国家二级重点保护野生植物,具有较高的科研价值。
(图文分别由陕西理工学院 王勇、杨培君,略阳县野生动植物保护管理站 李长波和勉县野生动植物保护管理站 樊荣 提供)
Cloning and Functional Validation of Late EmbryogenesisAbundant Protein Gene Promoter from Maize
ZOU Yutao,LIU Xin,MU Wei,GAO Xuehuan,FU Fengling,LI Wanchen*
(Maize Research Institute,Sichuan Agricultural University,Chengdu 611130,China)
It has important significance for transgenic resistance research to clone and validate endogenous inducible promoters in response to abiotic stresses,and use to construct inducible expression vectors.In this study,the sequence of the late embryogenesis abundant late gene (MGL3) promoter (pMGL3) was cloned from maize according to bioinformatics analysis.After analysis for abiotic stress-responsive elements and abiotic response by quantitative real-time PCR,we used this sequence to construct expression vector of the reporter geneGUS,and used to transform maize calli by biolistic method.The promotion activity of thepMGL3 promoter under abiotic stress was validated by GUS staining.In addition,the differentcis-acting elements was removed according to promoter sequence analysis,used to construct expression vectors of the reporter geneGUS,and transform tobacco discs byAgrobacteriummediation,in order to determine the shortest active sequence of thepMGL3 promoter.The results showed that thepMGL3 promoter is 1 554 bp long,containing multiple regulatory elements in response to abiotic stress.The expression of theMGL3 gene is increased under the stress of drought,high salt and low temperature,and induction of abscisic acid and ethylene.The calli transformed by theGUSgene under control of thepMGL3 promoter showed promotion activity under high osmotic,high salt,low temperature stresses,and abscisic acid induction.However,it kept promotion activity when truncated to as short as 325 bp.These results indicated that thepMGL3 promoter has promotion activity in response to abiotic stresses,and can be applied to maize transgenic studies for abiotic tolerance after further validation for its mechanism.
abiotic stress;late embryogenesis abundant protein;maize;promoter
1000-4025(2015)04-0653-09
10.7606/j.issn.1000-4025.2015.04.0653
2014-11-26;修改稿收到日期:2015-01-22
国家自然科学基金(31071433)
邹郁陶(1990-),女,在读硕士研究生,主要从事玉米遗传育种与生物技术研究。E-mail:457510642@qq.com
*通信作者:李晚忱,教授,主要从事玉米遗传育种与生物技术研究。E-mail:aumdyms@sicau.edu.cn
Q789
A

