E型产气荚膜梭菌ι毒素重组质粒的构建与表达
黄 静,王 琳,张括川,刘晓丹,赵宝华(河北师范大学生命科学学院,河北石家庄050024)
E型产气荚膜梭菌ι毒素重组质粒的构建与表达
黄静,王琳,张括川,刘晓丹,赵宝华*
(河北师范大学生命科学学院,河北石家庄050024)
摘 要:ι毒素是是公认的引起羔羊、犊牛和家兔患肠毒血症的主要毒素,为了减小其给畜牧业带来重大损失,论文就ι毒素蛋白的构建与表达进行研究,以期对其所引起疾病的预防及疫苗的研发提供参考。通过E型产气荚膜梭菌基因组,利用PCR方法获得大小为1 377bp的iota a基因和2 640bp的iota b基因;随后将目的基因同pET-28a质粒连接构建重组载体,并将重组载体转化E.coli BL21,用IPTG诱导表达,并通过SDS-PAGE、Western blot进行分析,发现Ia、Ib蛋白均成功进行了可溶性表达;最后利用Ni-NTA层析柱对重组蛋白进行纯化,获得了目的蛋白。
关键词:E型产气荚膜梭菌;ι毒素;构建;表达
产气荚膜梭菌(Clostridium perfringens)分布范围广,在土壤、污水、食品、人类粪便、肠道正常菌群中均有分布。它是动物和人类重要的病原菌之一,能引起食物中毒[1-3]。产气荚膜梭菌共可产生至少16种毒素,根据4种主要致死性毒素(α、β、ε、ι)可将产气荚膜梭菌分成A、B、C、D、E 5种类型[4-5]。产气荚膜梭菌ι毒素只能由E型产气荚膜梭菌产生,是4种致死性毒素中唯一的一种二元毒素,由Ia和Ib两部分组成,能引起羔羊、犊牛和家兔患肠毒血症[6-7]。Ia具有ADP-核糖基转移酶的活性,是其产生毒性的关键部位,进入细胞后能够破坏细胞骨架,从而使细胞发生裂解死亡。Ib是一种绑定组件,能形成七聚体结构,与Ia发生绑定作用,负责将Ia转运到细胞内发挥毒性作用[8-10]。ι毒素主要通过破坏细胞骨架,影响细胞内物质运输、信息交换、能量传递,从而使细胞裂解死亡,肠道发生病灶性出血[11-13]。ι毒素引起的肠毒血症每年给畜牧业带来重大损失,对其防控和治疗方面的研究已刻不容缓。本研究利用基因工程技术构建pET28a-Ia BL21 (DE3)、pET28a-Ib BL21(DE3)重组菌,诱导其克隆性表达获得Ia、Ib蛋白,并对蛋白进行纯化。为今后产气荚膜梭菌ι毒素基因疫苗和分子抗体的研究奠定了基础。
1 材料与方法
1.1材料
1.1.1菌株和质粒 E型产气荚膜梭菌(NCIB10748)为北京伯天达生物科技有限公司产品,由本实验室保存;大肠埃希菌DH5α、大肠埃希菌BL21(DE3)、pET28a质粒载体均由本实验室保存。
1.1.2实验动物 6周龄~8周龄Balb/c小鼠,购自河北医科大学动物中心。
1.1.3主要试剂 高纯度质粒小量提取试剂盒为广州东盛生物科技有限公司产品;DNA Marker DL 2 000、DNA Marker DL 15 000、卡那霉素、IPTG为上海生工生物工程技术服务有限公司产品;SacⅠ、XhoⅠ为宝生物工程(大连)有限公司产品;Ni-NTA Agrose珠子为Qiagen公司产品;丙烯酰胺、Tris Base、Glycine、过硫酸铵、2-巯基乙醇、溴酚蓝、考马斯亮蓝G-250为宝泰克生物科技公司产品;HRP标记羊抗鼠IgG为Promega公司产品;胰蛋白酶为美国Amresco公司产品;细菌基因组提取试剂盒为北京全式金生物科技有限公司产品;其他常规试剂均为国产分析纯级产品。
1.1.4主要仪器设备 梯度PCR仪、台式冷冻离心机为Eppendof公司产品;凝胶成像系统为Bio-Rad公司产品;稳压稳流电泳仪为北京市六一仪器厂产品;超净工作台,全温振荡培养箱为SUKUN公司产品;电热恒温水浴锅;恒温摇床;高压灭菌锅等。
1.2方法
1.2.1设计引物 参照GenBank公布的iota a、iota b基因序列设计引物,由上海生工生物工程技术服务有限公司合成(表1)。
表1 引物序列Table 1 Primer sequences
1.2.2菌株的复苏与基因组提取 将干粉保存的E型产气荚膜梭菌菌株用液体LB培养基活化培养过夜,次日划线LB固体平板,37℃过夜培养,第2天挑阳性克隆,接种于液体LB培养基,37℃、180r/min培养过夜。将上述过夜摇培的菌液收集1mL~5mL于离心管中,12 000r/min离心1min,弃上清,去残留的培养液按照细菌基因组提取试剂盒提取全基因组DNA。
1.2.3目的基因的获取与重组载体的构建 利用提取的全基因组为模板,在低温环境下构建iota a 和iota b基因PCR扩增反应体系:将以上反应体系加入到PCR管中,迅速置入PCR仪中,并设置以下参数进行扩增:94℃2min;94℃10s,65℃45s,72℃60s,30个循环;72℃10min。PCR扩增结束,10g/L琼脂糖凝胶电泳检测扩增的结果,并对目的基因进行切胶回收。
将回收的目的片段与pET28a质粒进行连接,构建pET28a-Ia、pET28a-Ib重组质粒,并将重组质粒转化大肠埃希菌BL21。用含卡那霉素的LB固体平板,37℃过夜培养,第2天挑阳性克隆,接种于液体LB培养基,37℃、180r/min培养过夜。
1.2.4重组克隆质粒鉴定 次日按照质粒小提试剂盒小量提取质粒DNA。用SacⅠ、XhoⅠ双酶切和PCR同时鉴定阳性克隆。并用10g/L的琼脂糖凝胶分别对结果进行检测。随后将PCR产物送往上海生工生物工程技术服务有限公司测序,测序结果用DNA Man软件与GenBank公布的基因序列进行同源性比对。
1.2.5产气荚膜梭菌ι毒素重组菌株的可溶性表达 将验证正确的阳性重组菌过夜培养,次日接种于100mL含卡那霉素素的LB培养基中,37℃,摇培至对数期(OD 600nm=0.5~0.6)加IPTG至终浓度为1mmol/L,16℃诱导过夜表达重组蛋白。收集菌体加入6mL~8mL Lysis buffer溶解,超声破碎30min,功率200 W,超声8s,间歇10s,获得破碎全液。4℃、12 000r/min离心10min,收集上清及沉淀,并进行SDS-PAGE及Western blot分析。
1.2.6产气荚膜梭菌ι毒素重组蛋白纯化 纯化前对Ni-NTA层析柱进行预处理,然后将收集到的菌液破碎后的上清,用0.22μm滤膜过滤,加入到已经平衡好的层析柱内,于4℃低速摇床上结合2h,使毒素重组蛋白结合到Ni-NTA珠子上。打开层析柱下盖,放清液体。用5mL含不同浓度咪唑的Wash buffer对上柱蛋白进行洗涤,4℃摇床结合,10min/次,以除去杂蛋白,收集洗涤液,取少量进行SDS-PAGE检测,并根据结果改变咪唑浓度,直至洗涤液中没有杂蛋白出现为最佳洗涤效果。用1mL含不同浓度咪唑浓度的Elution solution对目的进行洗脱,4℃摇床结合,10 min/次,收集洗脱液,取少量进行SDS-PAGE检测,根据洗脱效果,来逐步提高咪唑浓度加大洗脱力度。用Band Scan 6.0软件分析目的蛋白表达量。
2 结果
2.1目的基因获取结果
以提取全基因组为模板,在低温环境下构建iota a和iota b基因PCR扩增反应体系,10g/L琼脂糖凝胶电泳结果如图1所示。由图1可知分别获得大小1 377bp、和2 640bp的目的片段,并将结果送往上海生工生物工程技术服务有限公司测序,结果与GenBank进行同源性比对。结果显示正确,成功获得目的基因。
2.2重组质粒鉴定结果
2.2.1重组质粒PCR验证 分别以pET28a-Ia重组质粒、pET28a-Ib重组质粒为模板,进行PCR验证,10g/L琼脂糖凝胶电泳结果如图2所示。由图2可知,以2种重组质粒为模板进行的PCR,分别获得大小为1 377bp和2 460bp的条带,与预期结果一致。并且测序结果经比对与GenBank公布的基因序列结果一致。
图1 PCR扩增目的基因结果Fig.1 PCR amplification of target gene
图2 PCR鉴定阳性克隆结果Fig.2 PCR amplification results of positive clones
2.2.2重组质粒双酶切验证 将重组质粒用限制性内切酶SacⅠ、XhoⅠ进行双酶切验证,并设置pET28a空白对照,10g/L琼脂糖凝胶电泳结果如图3所示。由图3可知,pET28a-Ia重组质粒双酶获得2条大小分别为5 369bp和1 377bp的条带,pET28a-Ib重组质粒双酶获得两条大小分别为5 369bp和2 460bp的条带,与预期结果一致。
通过PCR和双酶切验证,同时证明重组质粒构建正确,可以进行诱导表达。
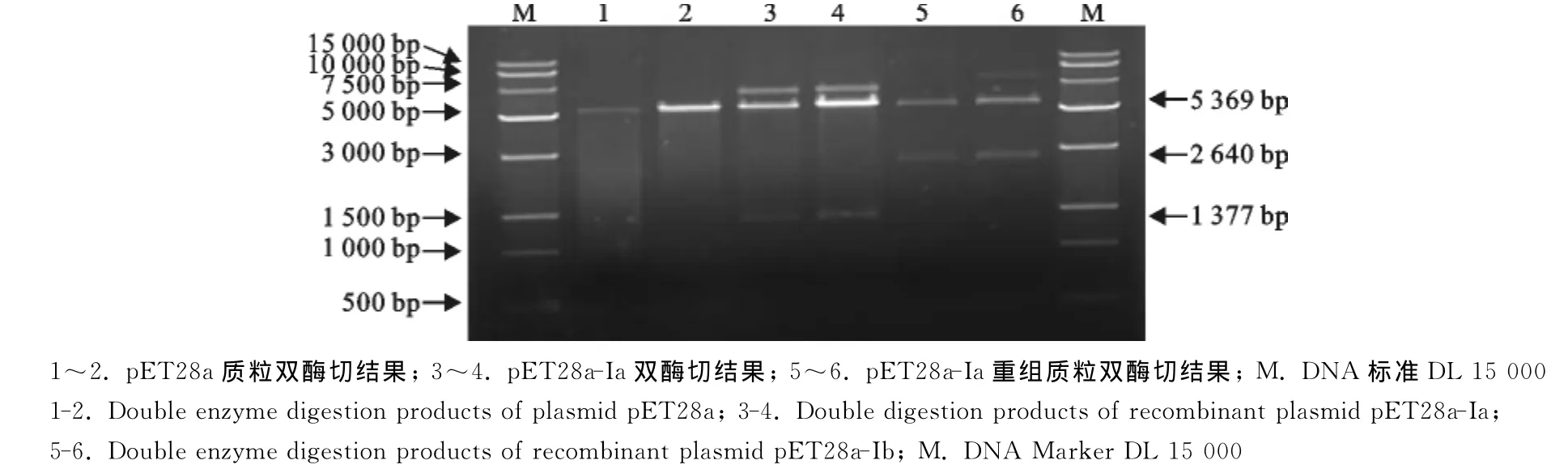
图3 双酶切鉴定阳性克隆结果Fig.3 Double enzyme digestion results of positive clones
2.3重组菌诱导表达结果
利用浓度为1mmol/L的IPTG分别诱导阳性重组菌株pET28a-Ia(DE3)、pET28a-Ib(DE3),超声裂解全液、上清及沉淀SDS-PAGE及Western blot结果如图4所示。由图4可知,与对照组相比,重组菌pET28a-Ia(DE3)、pET28a-Ib(DE3)上清中出现大小分别为47.5ku、94.5ku的目的条带,与预期结果一致。SDS-PAGE及Western blot均证明重组菌pET28a-Ia(DE3)、pET28a-Ib(DE3)成功进行可溶性表达。

图4 重组菌诱导表达SDS-PAGE和Western blot结果Fig.4 SDS-PAGE and Western blot analyses of recombinant bacteria
2.4重组蛋白纯化结果
Ni-NTA层析柱对破碎后的菌液上清进行纯化,5 mL咪唑浓度分别为100 mmol/L、300mmol/L的Wash buffer各洗脱2遍,再用咪唑浓度为500mmol/L的Elution buffer洗脱,取少量洗脱液进行SDS-PAGE分析,得到的检测结果如图5、图6所示。由图5、图6可知,成功获得了纯化结果良好的目的蛋白。
图5 pET28a-Ia(DE3)纯化产物SDS-PAGE结果Fig.5 SDS-PAGE results of the purity of recombant pET28a-Ia(DE3)protein

图6 pET28a-Ib(DE3)纯化产物SDS-PAGE分析结果Fig.6 SDS-PAGE results of the purity of recombant pET28a-Ia(DE3)protein
3 讨论
产气荚膜梭菌毒素是引起家畜猝死的主要毒素之一,因毒素类型多,致病速度快,使得其防治难度特别大。这也使得产气荚膜梭菌毒素成为了近些年科研工作者争相研究的对象。近些年来,国内外对产气荚膜梭菌A、B、C、D、E 5种类型的至少15种毒素进行了研究,特别是对α、β、ε、ι4种主要致死毒素的研究。4种主要致死性毒素中,对于α、β、ε毒素的研究较深入,早在2001年,赵宝华等[14]就对α毒素进行了深入的研究,并建立了抗A型产气荚膜梭菌α噬菌体单链抗体库。韩广伟等[15]对产气荚膜梭菌α毒素和ε毒素进行共表达,并对其免疫原性进行了研究。相对于其他3种主要致死性毒素而言,对ι毒素的研究,尤其是免疫原性的研究几乎处于空白。
为此,本文采用分子技术,获得了产气荚膜梭菌ι毒素两个组成部分的目的基因iota a、iota b,经PCR、双酶切及测序分析证明,目的基因正确。利用基因工程技术成功构建了pET28a-Ia、pET28a-Ib重组质粒,并将重组质粒转入E.coli BL21(DE3)中进行可溶性表达,并对蛋白纯化条件进行优化,最后经SDS-PAGE及Western blot分析证明重组质粒在E.coli中成功进行了可溶性表达。最后利用Ni-NTA层析柱法对目的蛋白进行纯化,SDS-PAGE分析最终获得纯化良好的目的蛋白。这是国内首次对产气荚膜梭菌ι毒素两个组成蛋白Ia、Ib进行表达与纯化,这为今后进一步进行免疫原性分析和产气荚膜梭菌ι毒素基因工程疫苗、小分子抗体的研究奠定了一定的基础。
参考文献:
[1] Garcia J P,Beingesser J,Fisher D J,et al.The effect of Clostridium perfringens type C strain CN3685and its isogenic beta toxin null mutant in goats[J].Vet Microbiol,2012,157:412-419.
[2] Grass J E,Gould L H,Mahon B E.Epidemiology of foodborne disease outbreaks caused by Clostridium perfringens [J].Foodb Pathog,2013,10(2):131-136.
[3] Scharff R L.Economic burden from health losses due to foodborne illness in the United States[J].Food Protect,2012,75 (1):123-131.
[4] 王 琳,赵宇亮,何建龙,等.产气荚膜梭菌ι毒素研究进展[J].动物医学进展,2013,34(11):102-105.
[5] Uzal F A,Vidal J E,McClane B A,et al.Clostridium perfringens toxins involved in mammalian veterinary diseases[J]. Open Toxinol,2010,3:24-42.
[6] Jank T,Aktories K.Strain-alleviation model of ADP-ribosylation[J].PNAS,2013,110(11):4163-4164.
[7] Tsurumura T,Tsumori Y,Qiu H,et al.Arginine ADP-ribosylation mechanism based on structural snapshots of iota-toxin and actin complex[J].PNAS,2013,110(11):4267-4272.
[8] Stiles Bradley G,Wigelsworth Darran J,Popoff Michel R,et al.Clostridial binary toxins:iota and C2family portraits[J]. Front Cell Infect Microbiol,2011,1:1-14.
[9] Nagahama M,Umezaki M,Oda M,et al.Clostridium perfringens iota-toxin binduces rapid cell necrosis[J].Infect Immun,2011,79:4353-4360.
[10] Uzal F A,Vidal J E,McClane B A,et al.Clostridium perfringens toxins involved in mammalian veterinary diseases[J]. Open Toxinol,2010,3:24-42.
[11] Uzal F A,Freedman J C,Shrestha A,et al.Towards an understanding of the role of Clostridium perfringens toxins in human and animal disease[J].Future Microbiol,2014,9(3):361-377.
[12] Stevens D L,Aldape M J,Bryant A E.Life-threatening clostridial infections[J].Anaerobe,2012,18(2):254-259.
[13] Songer J G,Miskimmins D W.Clostridium perfringens type E enteritis in calves:two cases and a brief review of the literature[J].Anaerobe,2004,10:239-242.
[14] 赵宝华,许崇波.抗A型产气荚膜梭菌α毒素单链抗体基因的克隆和表达[J].生物工程学报,2001,17(5):543-547.
[15] 韩广伟,李兆才,宫晓炜,等.产气荚膜梭菌α毒素和ε毒素的共表达及其免疫原性的研究[J].中国兽医科学,2014,4(6):630-635.
Construction and Expression of Iota Toxin Recombinant Plasmid of Clostridium perfringens Type E
HUANG Jing,WANG Lin,ZHANG Kuo-chuan,LIU Xiao-dan,ZHAO Bao-hua
(College of Life Science,Hebei Normal University,Shijiazhuang,Hebei,050024,China)
Abstract:Being known as the major cause of enterotoxaemia,Iota-toxin has caused great losses to animal husbandry yearly.To bring down the loss and to figure out the prevention and the vaccine of such disease,the expression and purification of Iota-toxin was recorded in this study.Clostridium perfringens type E genome was used as template for the PCR.The genetic engineering methods were used to construct the recombinant vector,the iota a gene(1 377bp)and iota b gene(2 640bp)were amplified fromC.perfringens type E genomc DNA by PCR.The genes were cloned into pET-28avector and expressed in E.coli BL21. The SDS-PAGE and Western blot analyses showed that the recombinant proteins were mainly in the form of soluble expressiors.The results indicated that the recombinant proteins possessed strong antigenicity which could be used as gene engineering vaccine and small molecular antibody.
Key words:Clostridium perfringens type E;iota toxin;construction;expression
作者简介:黄 静(1992-),女,山西大同人,学士,主要从事微生物学研究。*通讯作者
基金项目:河北省自然科学基金项目(2009000290)
收稿日期:2014-12-10
中图分类号:S852.6163;Q786
文献标识码:A
文章编号:1007-5038(2015)07-0062-05

