超声波协同酶法提取茶多酚工艺的研究
熊志勇,陈惠君,蔡阳伦,肖 洋
(1.北京理工大学珠海学院化工与材料学院,广东珠海519000;2.华南理工大学轻工与食品学院,广东广州510641)
茶多酚是一类存在于茶树中的多羟基酚类化合物的混合物,占茶叶质量的20% ~30%,安全性好且来源丰富,是一种天然无毒的食品添加剂,具有良好的抗氧化性能和药理作用[1]。茶多酚具有抗氧化、抗突变、抗癌变[2]、抗衰老、清除自由基、降血压与胆固醇等生物学功能。因此,茶多酚在食品、油脂、保健、医药、日化等行业都有广泛的应用[3]。
超声波提取是基于超声波的空化作用来加速物质分子盈动的频率和速度,增加溶剂穿透能力,以提高药物溶出速度和次数,从而有利于植物有效成分的提取,而它的次级效应,如机械振动、乳化、扩散、击碎、化学效应等也能加速欲提取成分的扩散释放并充分与溶剂混合,有利于植物中有效成分的提取,超声波提取还避免了高温加热对有效成分的破坏[4-5]。
纤维素酶是一组能够降解纤维素生成葡萄糖的酶的总称。在分解纤维素时起生物催化作用,可以将纤维素分解成寡糖或单糖的蛋白质或RNA[6-7]。在自然界的生物体中,细菌、真菌、动物体内等都能产生纤维素酶。一般用于生产的纤维素酶来自于真菌,真菌产量高、活性大,种类繁多,来源很广。并且,纤维素酶只是破坏茶叶的细胞壁,对非纤维素类物质无影响,所以对茶多酚无影响。
从茶叶中提取茶多酚的传统工艺存在许多缺点[8],如溶剂消耗量大、毒性强、成本高、提取物收率低等。为了克服上述方法的弊端,笔者对其提取工艺进行改进,利用正交设计试验研究超声波协同酶法[9],去除茶多酚提取量的影响(由于乙醇对纤维素酶活力有抑制作用,所以试验时在酶液作用之后再加入乙醇溶液保温一段时间后再进行测量茶多酚含量,正文不再进行详细说明),优化最佳提取条件与工艺方法[10],从而最大限度地提取茶多酚,为其在各个领域上的应用做出一定的贡献。
1 材料与方法
1.1 材料 原料:茶叶,山东日照鑫辉百货。主要试剂:乙酸铵、磷酸、乙酰丙酮、液体石蜡、冰乙酸,天津市大茂化学试剂厂;福林酚试剂,上海荔达生物科技有限公司(江苏锐阳);纤维素酶,江苏锐阳生物科技有限公司;试剂均为分析纯。主要仪器:HWS28型电热恒温水浴锅,上海一恒科技有限公司;EL204电子天平,梅特勒-托利多仪器(上海)有限公司;SB-25-12DT超声波清洗机,宁波新芝生物科技股份有限公司;722S722见分光光度计,上海欣茂仪器有限公司。
1.2 方法
1.2.1 纤维素酶活力。
1.2.1.1 纤维素酶标准溶液的配制。准确称取5 g纤维素酶,置于烧杯中溶解,倒入1 000 ml容量瓶中,定容至刻度,摇匀,此纤维素酶标准溶液浓度为5 mg/ml。
1.2.1.2 滤纸酶活力。滤纸酶活力(U/g)依据公式:滤纸酶活力(U/g)=葡萄糖生成量(mg)×酶液定容体积×5.56/[反应液中酶液加入量(ml)×样品重(g)×时间(h)],由滤纸酶活力计算公式得,滤纸酶活力=547.104 U/g。
1.2.2 茶多酚含量的测定。原理:茶叶磨碎样中的茶多酚用70%的甲醇在70℃水浴上提取,福林酚试剂氧化茶多酚中-OH基团并显蓝色,最大吸收波长λ为765 mm,用没食子酸作校正标准定量茶多酚。结果计算公式如下:

式中,A为样品测试液吸光度;V为样品提取液体积,10 ml;d为稀释因子(为1 ml稀释成100 ml,故其稀释因子为100);SLOPEstd为没食子酸标准曲线的斜率;m为样品干物质含量(%);m1为样品质量(g)。没食子酸标准曲线如图1所示。

图1 没食子酸标准曲线
拟合曲线方程:A=0.008 6c+0.478 6;拟合参数情况:SSE为2.56e-05;R2为0.999 7;R2adj为0.999 5;RMSE为0.002 921。
1.2.3 单因素试验考察。在保持其他因素不变的条件下,以茶多酚含量为指标,进行单因素试验,分别研究了水浴温度、水浴超声时间、加酶量、茶多酚与纤维素酶的料液比、乙醇浓度和pH对茶多酚提取的影响。
准确称取干燥的茶叶粉末5 g用于试验。水浴温度采用的水平为:30、40、50、60 ℃;水浴超声时间采用的水平为:30、40、50、60、70 min;加酶量采用的水平为:5、10、15、20、25 ml;料液比采用的水平为:5∶40、5∶50、5∶60、5∶70、5∶80 g/ml;乙醇浓度采用的水平为:15%、35%、55%、75%、95%;pH采用水平为 3、4、5、6、7。
1.2.4 正交试验设计。在单因素试验的基础上,根据茶叶中茶多酚的提取条件,选定水浴温度(A)、水浴超声时间(B)、加酶量(C)、料液比(D)和pH(E)为考察因素,以正交试验设计系统进行试验,因素水平见表1。

表1 因素及水平
1.2.5 统计分析。采用正交试验软件对正交结果进行统计分析,确定最佳提取工艺条件。
1.2.6 超声波与纤维素酶对茶多酚提取率的影响。选取相同原料,采用相同测定方法,分别采用超声波不加酶、加酶不超声法和超声波协同酶法试验,并对试验结果进行比较。
2 结果与分析
2.1 单因素试验
2.1.1 水浴温度的确定。称取干燥的茶叶粉末5 g,分别于30、40、50、60 ℃时加入 5 ml酶液和 50 ml 75%乙醇,作用 1h,结果如图2所示,在50℃时茶多酚的提取量比较高。

图2 水浴温度与茶多酚含量的关系
2.1.2 水浴超声时间的确定。称取干燥的茶叶粉末5 g,于50℃时加入20 ml酶液和50 ml 75%乙醇,分别作用30、40、50、60、70 min,结果由图3可见,水浴时间为60 min时茶多酚提取量为最高。

图3 水浴超声时间与茶多酚含量的关系
2.1.3 加酶量的确定。称取干燥的茶叶粉末5 g,于50℃时以料液比为5∶50 g/ml加入酶液5、10、15、20、25 ml及75%乙醇分别作用50 min,结果由图4可见,加酶量为15 ml时茶多酚的提取量比较高。
2.1.4 料液比的确定。称取干燥的茶叶粉末5 g,于50℃时加入 20 ml酶液和 40、50、60、70、80 ml 75%乙醇溶液作用 50min,结果由图5可见,料液比为5∶60 g/ml时茶多酚的提取量为最高。

图4 加酶量与茶多酚含量的关系
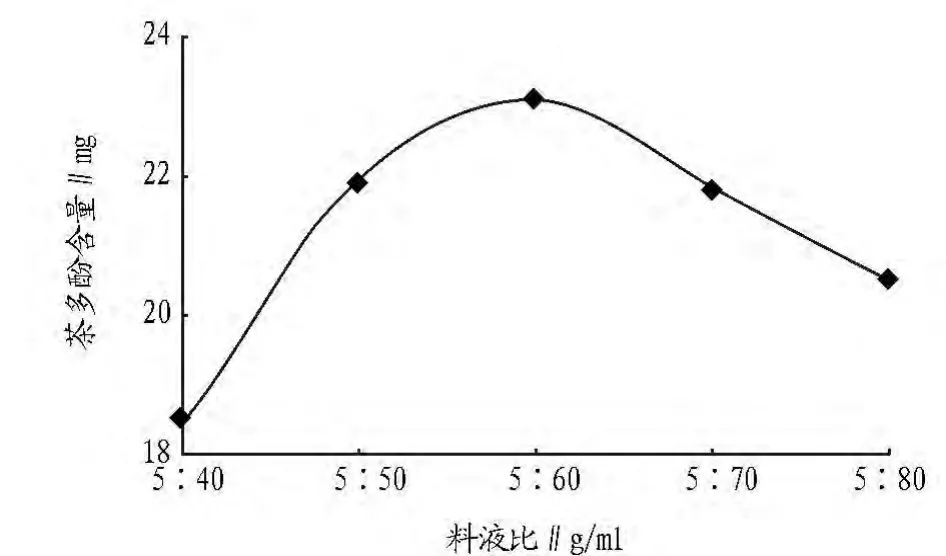
图5 料液比与茶多酚含量的关系
2.1.5 乙醇浓度的确定。称取干燥的茶叶粉末5 g,于50℃时加入20 ml酶液和50 ml,15% 、35%、55% 、75%、95%乙醇,分别作用50 min,结果由图6可见,乙醇浓度为55%时茶多酚的提取量比较高。
2.1.6 pH的确定。称取干燥的茶叶粉末5 g,于50℃时加入20 ml酶液和50 ml 75%乙醇,分别作用50 min,结果由图7可见,pH为4的时候茶多酚的提取率最高。
从试验数据中可以看出,超声波协同酶法提取茶多酚确实比普通的提取方法所提取的含量有所提高,但增幅不是很明显。经过分析研究,可能的原因是由于茶多酚的分子结构导致其跟蛋白质有很强的络合作用,所以容易导致活性酶的失活。
2.2 正交试验 根据单因素试验结果得知各因素对提取结果的影响,确定正交试验水平,正交试验结果见表2。由表2可见,各因素对试验指标(茶多酚含量)的影响按大小次序来说依次是:提取时间、pH、温度、料液比、加酶量。
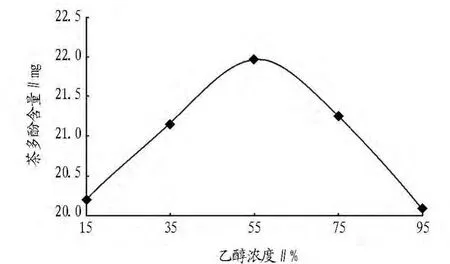
图6 乙醇浓度与茶多酚含量的关系
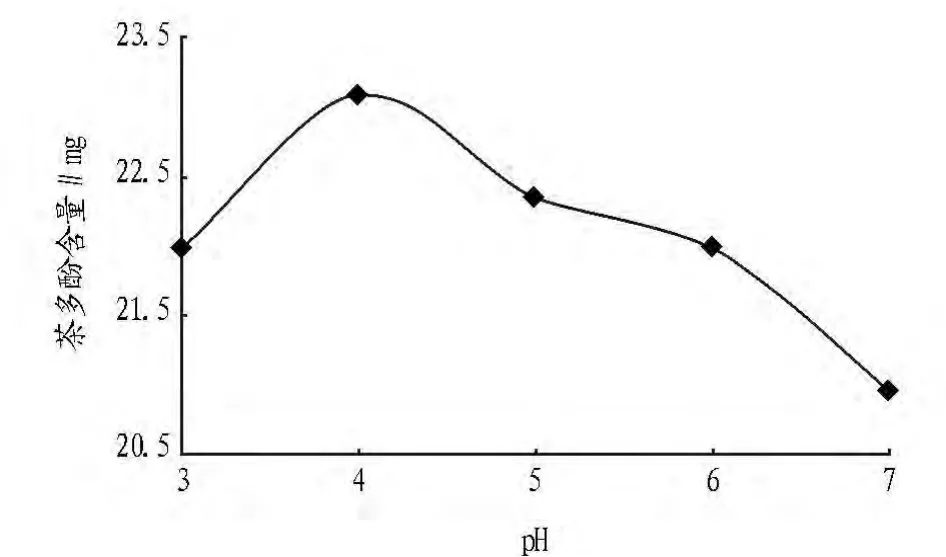
图7 pH与茶多酚含量的关系
最好的试验提取条件为A4B2C2D2E3,即水浴时间40 min,加酶量 10 ml,水浴温度 60 ℃,料液比为 5∶50 g/ml,pH为5。茶多酚提取方差分析显示,F温度=0.607,F时间=3.380,F加酶量=0.174,F料液比=0.233,FpH=0.606,F临界=3.29。

表2 正交试验结果
由此可得,时间这个因素对茶多酚的提取有较显著的影响,说明时间对茶多酚的提取起主要作用,温度、加酶量、料液比和pH则没有显著性差异,即这些因素对茶多酚的提取影响较小。
2.3 超声波与纤维素酶对茶多酚提取率的影响 试验得出,超声波协同纤维素酶法提取茶多酚的提取量最高,5 g茶叶粉中茶多酚提取量为23.216 4 mg,其提取效果明显高于单一的超声波(21.164 8 g)和加酶法(22.845 7 g)。
3 结论与讨论
纤维素酶是一种能够将维生素降解成葡萄糖的酶的总称,其作用主要是破坏茶叶细胞的细胞壁,使其内部物质从细胞中释放出来,由于茶多酚并不是纤维素类物质,故对提取出来的茶多酚的成分不会有影响。超声波提取法是基于超声波的空化作用来加速物质分子运动的频率和速度,增加溶剂的穿透能力,以提高药物溶出速度和溶出次数,从而有利于植物有效成分的浸出提取,而他的次级效应也能加速提取成分的扩散释放并充分与溶剂混合,有利于绝大部分植物有效成分的提取,还可避免高温加热对有效成分的破坏。
通过超声波与酶间不同组合试验方法的比较,可知纤维素酶的提取效率高于超声波的提取效率,而且超声波与纤维素酶具有协同作用,共同增进茶多酚的提取效率;通过5因素4水平正交试验的优化工艺研究,得出水浴时间40 min,加酶量10 ml,水浴温度60℃,料液比为5∶50 g/ml,pH为5时茶多酚的提取效率最高,其中影响因素以时间、pH和温度为主。
[1]蒋丽,王雪梅,全学军,等.不同提取方法对茶多酚理化性质的影响[J].食品科学,2010,31(14):136-139.
[2]YANG C S,LI G X,YANG Z H,et al.Cancer prevention by tocopherols and tea polyphenols[J].Cancer Letters,2013,334(1):79-85.
[3]THAKUR V S,GUPTA K,GUPTA S.The chemopreventive and chemotherapeutic potentials of Tea polyphenols[J].Current Pharmaceutical Biotechnology,2012,13(1):191-199.
[4]吴昊,宗志敏,石金龙.超声波协同酶法提取银杏黄酮的工艺研究[J].中国资源综合利用,2012,30(11):26-29.
[5]陈红,崔海月,李玉扩,等.超声波协同酶法提取大豆多糖工艺的研究[J].吉林农业大学学报,2011,33(5):581-586.
[6]LI C Z,YOSHIMOTO M,FUKUNAGA K,et al.Characterization and immobilization of liposome-bound cellulase for hydrolysis of insoluble cellulose[J].Bioresource Technology,2006,98(7):1366-1372.
[7]TÉBÉKA I R M,SILVA A G L,PETRI D F S.Hydrolytic activity of free and immobilized cellulase[J].Langmuir,2009,25(3):1582-1587.
[8]刘军海,杨海涛,刁宇清.复合酶法提取茶多酚工艺条件研究[J].食品与机械,2008,24(3):74-77.
[9]陶涛,李立祥,张芳,等.超声波协同纤维素酶对黄精多糖和皂苷的提取研究[J].食品工业科技,2012,33(9):271-275.
[10]陈红,崔海月,李玉扩,等.超声波协同酶法提取大豆多糖工艺的研究[J].吉林农业大学学报,2011,33(5):581-586.

