HPLC法测定注射用倍他米松磷酸钠的含量和有关物质
徐 岩
(天津市儿童医院,天津 300074)
1.倍他米松磷酸钠 2.倍他米松 3.碱破坏杂质
1.倍他米松磷酸钠 2.倍他米松
HPLC法测定注射用倍他米松磷酸钠的含量和有关物质
徐 岩
(天津市儿童医院,天津 300074)
目的:建立HPLC法测定不同厂家注射用倍他米松磷酸钠的有关物质及含量,考查了2个规格6批产品的质量差异。方法:采用反相高效液相色谱法,色谱柱为C18柱(250 mm×4.6 mm,5 μm),流动相为甲醇-0.05 mol/L磷酸二氢钾溶液(1∶1),流速为1.0 ml/min,检测波长为254 nm和241 nm。结果:倍他米松磷酸钠在0.66~66.0 μg/ml (0.05%~5.0%)的浓度范围内与其峰面积呈良好线性关系(r=0.999 9),倍他米松在0.5~50.0 μg/ml (0.05%~5.0%)的浓度范围内与其峰面积呈良好线性关系(r=0.999 9)。平均回收率为100.2%,RSD为0.4%(n=9)。结论:本方法结果准确,重复性好,能有效控制产品质量。
注射用倍他米松磷酸钠,有关物质,质量控制,高效液相色谱法
倍他米松磷酸钠为肾上腺皮质激素类药物,具有抗炎、抗过敏和抑制免疫等多种药理作用。其原料及注射液均在《中国药典》2010年版二部中收载[1],目前注射用倍他米松磷酸钠仅在国家药品标准中收载,国外药典均无收载。本文采用HPLC法对注射用倍他米松磷酸钠的有关物质和含量测定进行了考查,以完善现有标准,保证产品安全、有效和质量可控。
1 仪器与试药
Aglient 1260 Infinity 高效液相色谱仪,倍他米松磷酸钠对照品(中国食品药品检定研究院化学药品检定所,批号100180-200902,按倍他米松磷酸钠计,含量为89.7%);倍他米松对照品(中国食品药品检定研究院化学药品检定所,批号100118-200403,含量为100.0%);注射用倍他米松磷酸钠供试品1#、2#(规格:5.26 mg,A药厂提供,批号110314-1、110314-2);注射用倍他米松磷酸钠供试品3#、4#(规格:2.63 mg,B药厂提供,批号10090701、11041501);注射用倍他米松磷酸钠供试品5#、6#(规格:5.26 mg,B药厂提供,批号10072001、110120001);甲醇(色谱纯,天津市康科德科技有限公司),磷酸二氢钾(分析纯,天津市赢达稀贵化学试剂厂),水为纯化水。
2 方法与结果
2.1 色谱条件与系统适用性试验 采用Agilent Eclipse XDB-C18色谱柱(250 mm×4.6 mm,5 μm);流动相为甲醇-0.05 mol/L磷酸二氢钾溶液(1∶1);流速为1.0 ml/min;含量测定的检测波长为254 nm,有关物质检测波长为241 nm;柱温为40 ℃;进样量为20 μl。理论板数按倍他米松磷酸钠峰计算大于2 000,倍他米松磷酸钠峰与倍他米松峰的分离度为4.5。
2.2 溶液的制备
2.2.1 含量测定用溶液 取样品10支,分别加水适量使内容物溶解,并转移至50 ml(规格:2.63 mg)或100 ml(规格:5.26 mg)量瓶中,用水分次洗涤容器,洗液并入量瓶中,用水稀释至刻度,摇匀,作为供试品溶液。另取倍他米松磷酸钠对照品适量,同法配制对照品溶液。
2.2.2 有关物质检查用溶液 取本品适量(相当于倍他米松磷酸钠13.2 mg),置10 ml量瓶中,加流动相溶解并稀释至刻度,摇匀,作为供试品溶液;另取倍他米松对照品10 mg,精密称定,置10 ml量瓶中,加流动相适量使溶解并稀释至刻度,摇匀;精密量取该溶液和供试品溶液各1 ml,置100 ml量瓶中,用流动相稀释至刻度,摇匀,作为对照溶液;精密量取对照溶液1 ml置50 ml量瓶中,用流动相稀释至刻度,摇匀,作为灵敏度测试溶液。
2.3 专属性试验 分别取样品适量(相当于倍他米松磷酸钠13.15 mg),置5个10 ml量瓶中,加水适量振摇使溶解,前3个量瓶分别加1 mol/L盐酸溶液1 ml、1 mol/L氢氧化钠溶液1 ml和30%过氧化氢溶液1 ml,摇匀,60 ℃水浴加热1 h,放冷,调节pH值至中性后用水稀释至刻度,摇匀,分别作为酸破坏、碱破坏和氧化破坏溶液;将第4个量瓶置100 ℃水浴中加热6 h,放冷,加水稀释至刻度,摇匀,作为高温破坏溶液;将第5个量瓶用水稀释至刻度,摇匀,日光下放置1周,作为光照破坏溶液。分别量取20 μl注入液相色谱仪,记录色谱图,见图1。试验表明,样品在酸性及氧化条件下比较稳定;在碱性条件下杂质显著增加;在高温条件下倍他米松峰显著增加;在光照条件下主峰明显下降。在该色谱条件下,倍他米松磷酸钠峰与相邻杂质峰均可以达到良好分离,表明该方法的专属性良好,适宜有关物质检查。
2.4 线性关系试验 精密称取倍他米松磷酸钠对照品13.2 mg和倍他米松对照品10 mg,置同一100 ml量瓶中,加流动相适量使溶解并稀释至刻度,摇匀,作为对照品储备液;精密量取适量,加流动相稀释制成浓度为0.66、1.32、6.6、13.2和66.0 μg/ml(按倍他米松磷酸钠计)的系列溶液。分别精密量取上述溶液20 μl注入液相色谱仪,记录色谱图,以浓度为横坐标(X),峰面积为纵坐标(Y),进行线性回归。结果表明,倍他米松磷酸钠线性方程为:Y=12.83X+18.60(r=0.999 9,n=5),在0.66~66.0 μg/ml浓度范围内与其峰面积呈良好的线性关系(对应杂质限度为0.05%~5.0%);倍他米松线性方程为Y=10.51X+13.92(r=0.999 9,n=5),在0.5~50.0 μg/ml浓度范围内与其峰面积呈良好的线性关系(对应杂质限度为0.05%~5.0%)。
2.5 溶液稳定性试验 将“2.2.2”项下的对照溶液及供试品溶液在室温下分别放置0、2、4、8、12和24 h后依法进样20 μl测定,观察主峰及各杂质峰面积的变化,RSD分别为0.6%和0.4%。试验结果表明对照品溶液及供试品溶液在24 h内基本稳定。


1.倍他米松磷酸钠 2.倍他米松 3.碱破坏杂质
图1 酸破坏(A)碱破坏(B)氧化破坏(C)
高温破坏(D)和光照破坏(E)HPLC色谱图
2.6 重复性试验 取5#样品6份,按“2.2.1”项下方法配制供试品溶液,依法测定,倍他米松磷酸钠的平均含量为101.8%,RSD为0.42%。
2.7 回收率试验 精密称取倍他米松对照品10 mg置100 ml量瓶中,加流动相稀释至刻度,摇匀,作为杂质对照品储备液;分别精密称取空白辅料9份,置50 ml量瓶中,加流动相适量,分别精密加入对照品储备液4、5和6 ml各3份,用流动相稀释至刻度,摇匀,精密量取20 μl注入液相色谱仪,记录色谱图。平均回收率为99.8%,RSD为0.4%(n=9),结果见表1。

表1 回收率试验结果
2.8 样品的测定
2.8.1 含量测定 精密量取“2.2.1”项下供试品溶液和对照品溶液各20 μl注入液相色谱仪,记录色谱图;按外标法以峰面积计算每瓶的含量,并计算10支的平均含量,即得。按上述方法对6批样品进行含量测定,结果分别为92.9%、93.7%、94.9%、92.9%、101.8%和99.9%。
2.8.2 有关物质检查 照含量测定项下的色谱条件,检测波长为241 nm。精密量取“2.2.2”项下灵敏度测试溶液20 μl注入液相色谱仪,调节检测灵敏度,使主成分色谱峰的信噪比不小于10,再精密量取“2.2.2”项下供试品溶液与对照溶液各20 μl,分别注入液相色谱仪,记录供试品溶液色谱图至主成分峰保留时间的3倍,色谱图见图2,结果见表2。

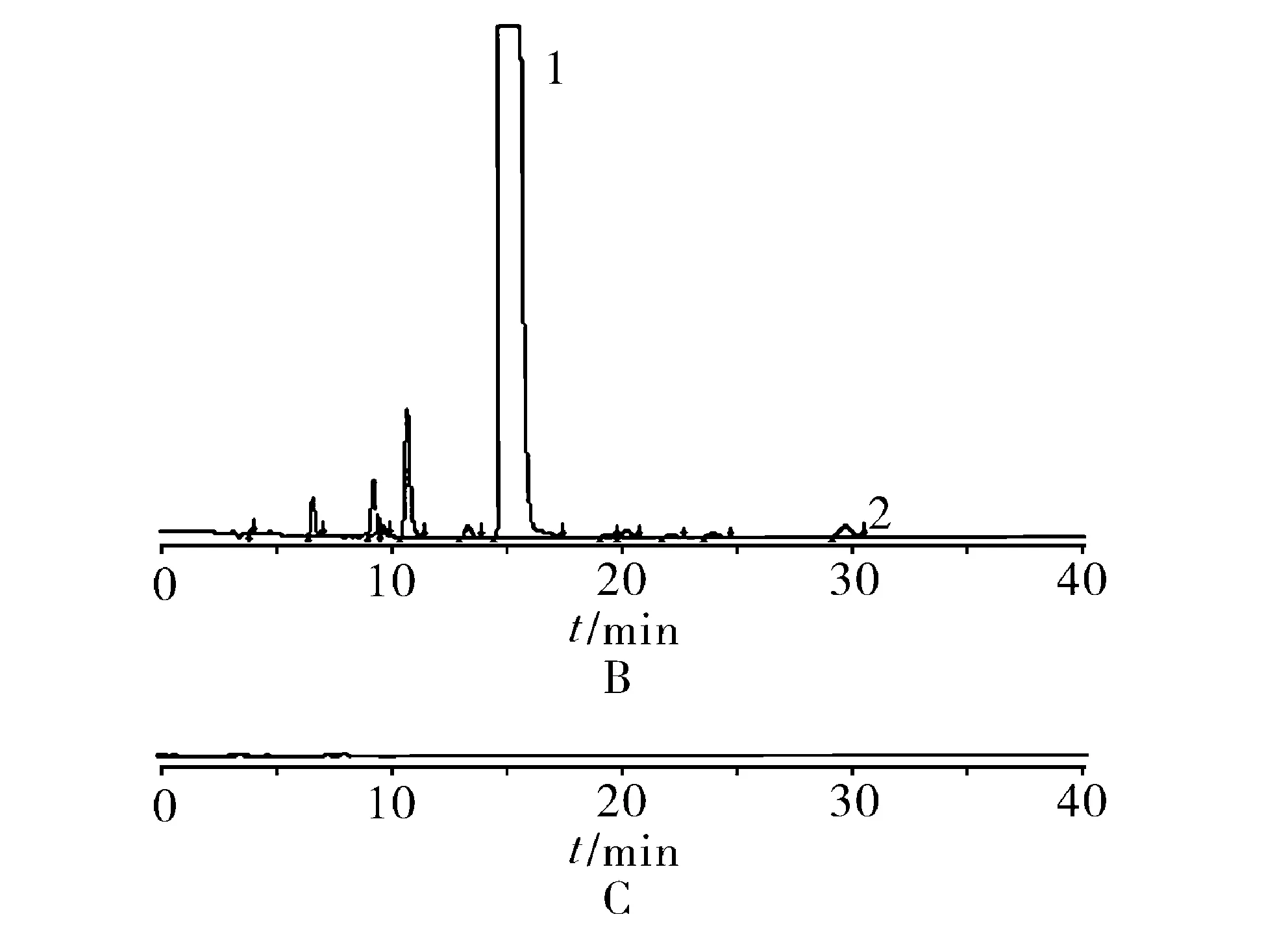
1.倍他米松磷酸钠 2.倍他米松

图2 对照品(A)
3 讨论
本方法在同一色谱系统中测定样品的含量及有关物质,但检测波长不同。含量测定的检测波长为254 nm,沿用《中国药典》2010年版二部倍他米松磷酸钠注射液的方法。有关物质检测波长为241 nm,在该波长下杂质检出的个数和杂质量最大。
1 中国药典[].二部.2010:844
欢迎订阅《天津药学》杂志
本刊主要栏目:专论、实验研究、药品质量与检验、药物与临床、药物经济学、综述、医药工业、中药、药物制剂、安全用药、医药管理等。
《天津药学》杂志为双月刊,双月28日出版,全年6期,每册定价10元,全年60元。《天津药学》杂志国内外公开发行,国内统一刊号CN12-1230/R,国际标准刊号ISSN1006-568,国内邮发代号6-175,欢迎医药卫生单位及个人到当地邮局订阅。如漏订可通过邮局汇款至杂志社(定价不变),由编辑部负责邮寄。
《天津药学》杂志社地址:天津市和平区沙市道同康里3-502
邮政编码:300051 电话:(022)23346705
电子邮箱:tjyaoxue@126.com
欢迎广大医药卫生科技人员踊跃投稿!
Determination of betamethasone sodium phosphate for injection and its related substances by HPLC
Xu Yan
(Tianjin Children' Hospital,Tianjin 300074)
Objective: To establish an HPLC method for determination of the related substances and the content in betamethasone sodium phosphate for injection and evaluate the quality variations. Methods: An RP-HPLC system,including a C18column (250 mm×4.6 mm,5 μm) and the solution of methanol-0.05 mol/L potassium dihydrogen phosphate(1∶1)(mobile phase), was used. The flow rate of mobile phase was 1.0 ml/min, and detecting wavelengths were 254 nm and 241 nm. Results: The assay displayed a good linearity of betamethasone sodium phosphate over the concentration range of 0.66~66.0 μg/ml(r=0.999 9),and a good linearity of betamethasone over the concentration range of 0.5~50.0 μg/ml(r=0.999 9).The average recoveries were 100.2% and RSD was 0.4% (n=9). Conclusion: The established method is accurate and simple,and is a guarantee for quality control of betamethasone sodium phosphate for injection.
betamethasone sodium phosphate for injection,related substances,quality control,HPLC
2015-04-07
R927.2
A
1006-5687(2015)05-0012-03

