重症急性胰腺炎并发感染患者的免疫状况研究*
罗少媚,钟 智,叶 营,陈虾妹
(广东省廉江市人民医院消化内科,广东 廉江 524400)
急性胰腺炎(AP)是一种消化系统中十分常见的急腹症,分为轻症急性胰腺炎(MAP)与重症急性胰腺炎(SAP)[1]。SAP发病急骤,死亡率高,尤其是在并发感染时,容易发生感染性休克、器官功能衰竭等,死亡率高达 20%~30%[2]。据报道[3],67%的 SAP 患者死亡与继发性感染相关,降低感染的发生已成为降低SAP死亡率的关键。近些年来研究发现免疫引发急性胰腺炎的关键发病机制,但是免疫在重症急性胰腺炎并发感染患者中的报道较为罕见[4]。本研究针对重症急性胰腺炎并发感染的患者的免疫状况进行分析,旨在为重症急性胰腺炎并发感染患者的治疗提供依据。
1 资料与方法
1.1 一般资料:研究对象为2012年6月至2014年10月本院住院治疗的SAP患者90例,其中男性51例,女性39例;平均年龄52.3±7.2岁;根据患者是否并发感染将患者分为感染组和对照组,其中感染组患者49例,包括男性 27例,女性 22例;平均年龄 52.9±7.5岁;对照组患者41例,包括男性24例,女性17例;平均年龄52.0±7.1岁。两组患者性别和年龄经比较差异无统计学意义(P>0.05)。本研究中所有患者均知情同意,并签署知情同意书。
1.2 患者纳入、排除标准和继发性感染判断标准:患者纳入标准:①符合中华医学会消化病学分会2004年制订的关于急性胰腺炎诊断指南中的诊断标准[5],确诊为重症急性胰腺炎;②纳入本研究前未经过任何治疗;③知情同意。患者排除标准:①伴有恶性肿瘤的患者;②严重肝肾功能不全的患者;③血液和免疫系统疾病的患者;④妊娠或哺乳期妇女;⑤无法执行治疗方案的患者。继发性感染判断标准[5]:当患者的体温超过38℃,白细胞计数超过20×109L-1时在B超或增强CT的指引下实施细针穿刺术,以判断是否发生胰腺感染,如果患者合并以下中的一种时则判定为坏死感染:①腹部有2个以上的象限出现腹膜刺激;②CT扫描显示胰腺和周围出现小且不规则气泡;③细针穿刺进行涂片或细菌培养呈现阳性。
1.3 方法:所有患者均于入院后24h内和第28d抽取空腹肘静脉血3mL,静置30min之后以1000r/min的转速离心15min,然后取上清,放于-80℃的冰箱中冷冻保存,白介素-4(IL-4)、白介素-6(IL-6)、白介素-10(IL-10)、肿瘤坏死因子-α(TNF-α)等细胞因子的检测采用酶联免疫吸附法进行检测,检测试剂为美国R&D公司生产,按说明书进行操作。所有患者均于入院后24h内和第28d抽取4mL新鲜抗凝血加入淋巴细胞分离液,在进行梯度密度离心之后得到淋巴细胞,将获得的淋巴细胞调整浓度为1×106个/mL,然后吸取100μL,加入15μL异硫氰酸荧光素标记的CD4单克隆抗体或CD8单克隆抗体。采用牛血清白蛋白代替特异性单克隆抗体作为阴性对照组,在4℃的温度下进行30min的避光孵育,最后采用流式细胞仪对CD4+或CD8+T细胞进行检测。
1.4 统计学分析:采用SPSS17.0统计软件进行数据分析,计量数据以±s的形式进行表示,采用t检验;计数资料采用χ2检验,P<0.05为差异具有统计学意义。
2 结果
2.1 两组患者一般资料比较:两组患者的性别、年龄、文化程度和有无配偶之间的差异无统计学意义(P>0.05),见表 1。
表1 两组患者之间的一般资料比较
2.2 两组患者炎性细胞因子比较:如表2所示,在发病24h内,感染组患者的白介素-4、白介素-6、白介素-10和肿瘤坏死因子-α水平显著高于对照组,差异均具有统计学意义(P<0.05);在发病28d,感染组患者的白介素-4、白介素-6、白介素-10和肿瘤坏死因子-α水平显著低于对照组,差异均具有统计学意义(P<0.05)。

表2 两组患者之间的炎性细胞因子比较
2.3 两组患者之间的T淋巴细胞比较:发病24h内,感染组患者的CD4+/CD8+水平显著高于对照组,差异均具有统计学意义(P<0.05);在发病28d,感染组患者的CD4+/CD8+水平显著低于对照组,差异均具有统计学意义(P<0.05)。见表 3。
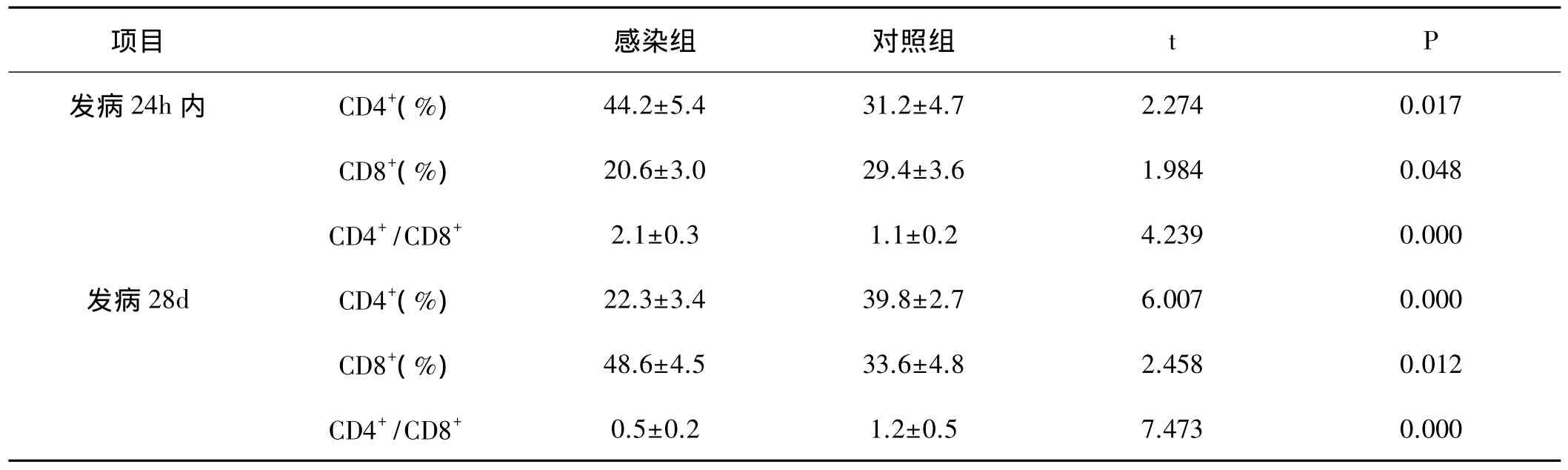
表3 两组患者之间的T淋巴细胞比较
3 讨论
重症急性胰腺炎是目前十分常见的一种急腹症,主要是因为胰管阻塞、血液淋巴循环障碍所引发的胰腺消化酶消化自身的一种急性炎症,具有并发症多,死亡率高的特点[6-7]。据报道[8],80%的 SAP 患者死于感染所引发的并发症,而继发性感染的主要原因是由于炎性介质的过度释放引起的。本研究旨在对重症急性胰腺炎并发感染的患者的免疫状况进行分析,为重症急性胰腺炎并发感染患者的治疗提供依据。
本研究对入院后24h内和第28d的炎性因子进行分析发现,在发病24h内,感染组患者的白介素-4、白介素-6、白介素-10和肿瘤坏死因子-α水平显著高于对照组。与文献报道的重度急性胰腺炎发生时存在过度释放炎性介质的现象的结果相一致。白介素-6和肿瘤坏死因子-α为促炎性反应介质,白介素-4、白介素-10为抗炎性反应介质,它们的升高提示了过度炎性反应的存在。此外,有研究报道[9],过度的炎性反应后出现免疫抑制的现象,本研究结果显示在发病28d,感染组患者的白介素-4、白介素-6、白介素-10和肿瘤坏死因子-α水平显著低于对照组,该结果表明重症急性胰腺炎并发感染患者在晚期出现了免疫抑制的现象。
人体内正常的免疫功能是由T细胞的CD4+和CD8+细胞亚群相互作用而维持,CD4+和CD8+细胞的百分率和CD4+/CD8+的值对于评估患者机体的免疫状态具有重要意义[10]。本研究对两组患者之间的T淋巴细胞研究显示,在发病24h内,感染组患者的CD4+/CD8+水平显著高于对照组;在发病28d,感染组患者的CD4+/CD8+水平显著低于对照组,该结果与两组患者之间的炎性细胞因子之间的变化趋势一致,CD4+/CD8+水平的异常提示患者的免疫功能状态异常。此外,后期CD4+/CD8+水平的降低导致了细胞免疫应答的衰退,B淋巴细胞得以大量繁殖,进而引发患者的继发性损伤,最终引发多器官损害。本研究对重症急性胰腺炎并发感染患者的免疫特点已有一定的了解,但是对于其发生机理尚不清楚,仍需要进一步的研究。
[1] 肖建萍.重症急性胰腺炎早期胰腺感染的相关因素分析[J].河北医学,2012,18(10):1402~1405.
[2] 孙学童,刘牧林.重症急性胰腺炎64例治疗疗效分析[J].中华全科医学,2011,09(6):860~862.
[3] 余杨梓,傅强,李静,等.免疫失衡在重症急性胰腺炎患者继发全身感染中的作用[J].天津医药,2012,40(7):672~674.
[4] 曾杰.重症急性胰腺炎患者免疫细胞因子改变及调控的研究进展[J].中国综合临床,2011,27(4):447~448.
[5] 中华医学会消化病学分会胰腺疾病学组.中国急性胰腺炎诊治指南(草案)[J].解放军医学杂志,2004,29:646~648.
[6] Shen Y F,Cui N Q,Miao B,et al.Immune dysregulation in patients with severe acute pancreatitis[J].Inflammation,2011,34(1):36~42.
[7] 杜时雨,陶永康,段军,等.老年重症急性胰腺炎患者继发性感染的免疫状态分析[J].中华老年医学杂志,2014,33(6):610~612.
[8] 罗荣.降钙素原与C反应蛋白在重症急性胰腺炎并发感染临床诊断的对比分析[J].临床医学工程,2013,20(2):177~178.
[9] Gulcubuk A,Haktanir D,Cakiris A,et al.Effects of curcumin on proinflammatory cytokines and tissue injury in the early and late phases of experimental acute pancreatitis[J].Pancreatology,2013,13(4):347~354.
[10] 邓明明,王烜,夏国栋,等.重症急性胰腺炎患者血清PCT与IL-6的动态变化及临床意义[J].四川医学,2009,30(11):1704~1705.

