延胡索乙素对小鼠坐骨神经CCI模型背根神经节Cav1.2表达的影响
姜海波,王 军,苏建华,房铭铭,杨 楠,杨家伟,万 芬,肖 杭,唐金荣
(1.南京医科大学第一附属医院神经内科,江苏南京 210029;2.南京医科大学公共卫生学院神经毒理系,江苏南京 211100;3.江苏大学附属金坛市人民医院神经内科,江苏金坛 213200;4.江苏省中西医结合医院神经内科,江苏南京 210028)
延胡索乙素对小鼠坐骨神经CCI模型背根神经节Cav1.2表达的影响
姜海波1,王 军2,苏建华3,房铭铭4,杨 楠1,杨家伟1,万 芬1,肖 杭2,唐金荣1
(1.南京医科大学第一附属医院神经内科,江苏南京 210029;2.南京医科大学公共卫生学院神经毒理系,江苏南京 211100;3.江苏大学附属金坛市人民医院神经内科,江苏金坛 213200;4.江苏省中西医结合医院神经内科,江苏南京 210028)
中国图书分类号:R-332;R284.1;R322.85;R441.1;R745.022
摘要:目的 探讨延胡索乙素对小鼠坐骨神经慢性压迫性损伤(CCI)所致神经病理性疼痛的镇痛作用以及对背根神经节Cav1.2表达的影响。方法 ♂C57BL/6小鼠40只,随机分为5组,分别为假手术组(S组)、CCI组(C组)、延胡索乙素组(L组)。建立稳定的小鼠坐骨神经慢性压迫性损伤致神经病理性疼痛模型。按照神经病理性疼痛的诱发和持续时间,又将L组分为诱导期组、诱导维持期组、长程低剂量组。诱导期组于疼痛诱导期(0~5 d)、诱导维持期组于疼痛诱导期及维持期(0~5 d、14~19 d)腹腔给予延胡索乙素45 mg·kg-1,每日1次;长程低剂量组从术后即刻开始腹腔给予延胡索乙素15 mg·kg-1,每日1次,给予19 d。监测小鼠行为学变化,检测小鼠机械痛阈和热痛阈,Western blot及免疫组织化学方法测定背根神经节中Cav1.2表达。结果 脊髓背根神经节Cav1.2在C组表达水平最低,S组表达水平最高,在诱导期组、诱导维持期组及长程低剂量组表达明显上调,差异具有统计学意义(P<0.05,P<0.01)。与C组比较,诱导期组、诱导维持期组高剂量以及长程低剂量组长程低剂量给予延胡索乙素可以明显缓解神经病理性疼痛诱导的机械痛敏和热痛敏(P<0.05,P<0.01)。高剂量延胡索乙素可以缓解诱导期、维持期的机械痛敏及维持期的热痛敏(P<0.05),低剂量延胡索乙素对诱导期机械痛敏和热痛敏均无明显作用(P>0.05)。结论 小鼠CCI模型疼痛的诱导期、诱导维持期应用高剂量以及长程应用低剂量延胡索乙素可明显缓解坐骨神经慢性压迫性损伤所致神经病理性疼痛,其可能机制之一是延胡索乙素通过上调脊髓背根经节Cav1.2亚基的表达来发挥镇痛作用。
关键词:延胡索乙素;Cav1.2;坐骨神经慢性压迫性损伤;神经病理性疼痛;背根神经节;小鼠
网络出版时间:2015-10-16 9:52 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20151016.0952.046.html
延胡索乙素(tetrahydropalmatine,THP)是中药延胡索的主要活性成分,研究证实它可缓解头痛、胸痛、关节痛以及外伤导致的疼痛[1],但对于延胡索乙素治疗神经病理性疼痛则鲜有报道[2-3],涉及到的机制包括延胡索乙素激活多巴胺D1受体以及抑制脂肪酸酰胺水解酶(FAAH)水平。然而,延胡索乙素是否通过调节Cav1.2水平来缓解神经病理性疼痛,目前尚未见报道。近年来研究发现电压门控钙通道(voltage-gated calcium channels,VGCC)与神经病理性疼痛密切相关,L型VGCC,尤其是Cav1.2亚基参与了神经病理性疼痛的发生发展[4-5]。另外有研究发现,在豚鼠单个心肌细胞中,延胡索乙素可有效阻滞L型钙电流[6-7],表明延胡索乙素和L型VGCC密切相关。延胡索乙素是否通过影响L型VGCC Cav1.2亚基来缓解神经病理性疼痛是本实验研究的主要任务。
本实验主要通过观察坐骨神经慢性压迫性损伤模型(chronic constriction injury,CCI)下,延胡索乙素对小鼠背根神经节(dorsal root ganglia,DRG)Cav1.2表达的影响,探讨延胡索乙素对小鼠神经病理性疼痛的影响及其可能的机制。
1 材料与方法
1.1动物分组 ♂C57BL/6小鼠,清洁级,40只,7 ~8周龄,体质量22~27 g,由南京大学模式动物中心提供(批号:J000664)。将小鼠随机分为5组:假手术组(S组)、坐骨神经结扎组(C组)、延胡索乙素组(L组)。按照神经病理性疼痛诱发和持续的时间,又将L组分为诱导期组(induction)、诱导维持期组(induction with maintenance)、长程低剂量组(long-term low-dose)。S组小鼠分离坐骨神经但不结扎,C组和L组建立CCI模型。
1.2实验材料 左旋延胡索乙素(dl-THP)
(A007452,上海将来实业股份有限公司),兔抗Cav1.2抗体(ACC-003,以色列Alomone公司),正常兔血清(AR1010,Boster公司),免疫组化试剂盒DAB显色液(K5007,丹麦DAKO公司),Von Frey(美国Stoelting公司),冷热测痛仪(YIS-21A,济南益延科技发展有限公司)。
1.3CCI模型的建立 按照Bennett等[8]所述的方法制备小鼠CCI模型。用1%戊巴比妥(10 mg· kg-1,ip)麻醉小鼠并固定于手术台上,剪毛消毒后切开小鼠右下肢股中部皮肤,钝性分离肌肉暴露坐骨神经,在接近其分叉处用4-0丝线结扎3道,间隔约1 mm,结扎强度以引起小腿肌肉轻度颤动、减慢,但不阻断通过表层血管的循环为宜。生理盐水冲洗创面,逐层缝合切口,左侧作为自身对照,术毕分笼,常规饲养。
1.4给药方法 参考Choi等[9]和徐叔云教授主编的《药理实验方法学》[10]以及预实验结果,确定给药方法及给药剂量。诱导期组于疼痛诱导期(0~5 d)、诱导维持期组于疼痛诱导期及维持期(0~5 d、14~19 d)给予延胡索乙素(45 mg·kg-1,ip),每日1次;长程低剂量组从术后即刻开始至实验终止给予延胡索乙素(15 mg·kg-1,ip),每日1次。
1.5测定小鼠机械痛阈和热痛阈 各组小鼠分别于术前1 d,术后5、14、19 d测定机械痛阈和热痛阈。机械痛阈用机械刺激回缩阈(MWT)表示,热痛阈用热刺激缩足反应潜伏期(PWL)表示。
1.5.1机械痛阈测定 测定前,将小鼠放入一置于金属筛网上的19×15×12(cm3)塑料箱内适应15 min,测定时用Von Frey垂直刺激小鼠右足底中部皮肤,以强度渐升的顺序进行刺激,纤维丝的压力值依次为0.07、0.16、0.4、0.6、1.0、1.4、2.0、4.0、6.0、8.0、10.0、15.0 g。刺激持续时间≤4秒,每个时间点重复5次,每次间隔时间5 min,小鼠出现抬足或舔足行为为阳性反应,如超过10.0 g仍未出现机械刺激引起的阳性反应,则记为10.0 g。5次重复实验中有3次出现上述反应,则认为该点为机械刺激回缩阈(mechanical withdrawal threshold,MWT)[11]。
1.5.2热痛阈的测定 将冷热测痛仪预热在(55 ±0.3)℃范围,将小鼠置于热板上,以出现抬足或舔足行为为阳性反应,此时测痛仪上的值为热刺激缩足反应潜伏期(thermal paw withdrawal latency,PWL)。刺激持续时间不超过30 s,每次间隔时间15 min,重复3次,取其平均值[12]。
1.6组织取材及固定 小鼠于术后d 19给药2 h后,以(10 mg·kg-1,ip)水合氯醛麻醉致死。沿背部正中线剪开背部皮肤,剪断与脊柱相连的肋骨,取出腰段脊柱。沿椎管将脊柱剪成两半,挑出同侧L4 -6脊髓节段背根神经节。每组随机选取5只小鼠背根神经节放入-80℃冰箱,用于Western blot分析,3只小鼠取背根神经节用4%多聚甲醛固定12 h,常规石蜡包埋,制成厚5 μm石蜡切片,用于免疫组织化学染色。
1.7Western blot检测Cav1.2蛋白的表达 取背根神经节,加入RIPA裂解液和cocktail蛋白酶抑制剂的混合液(体积比500∶1),超声匀浆后低温高速离心(5℃,12 000 r·min-1,15 min),取上清液,BCA试剂盒进行蛋白浓度测定。取20 μg蛋白上样电泳(8%分离胶,5%浓缩胶),电泳(浓缩胶电压60 V,分离胶电压90 V)后转印至PVDF膜(200 mA,3 h),5%脱脂奶粉室温封闭2 h,加入Cav1.2一抗(1 ∶200)或β-actin(1∶5 000),4℃冰箱孵育过夜。次日洗膜,加入二抗(1∶50 000),室温孵育2 h。采用ECL化学发光法显色曝光。
1.8免疫组织化学检测Cav1.2的表达及结果判定 采用即用型Envision快速酶免疫组化二步法进行背根神经节Cav1.2检测。切片常规脱蜡至水后,置于盛满EDTA抗原修复缓冲液(pH 9.0)的修复盒中,于微波炉内进行抗原修复,自然冷却后PBS冲洗3次,每次5 min;3%过氧化氢室温避光孵育25 min,灭活过氧化物酶活性;滴加3%BSA室温封闭30 min后,滴加适当稀释的一抗(1∶200),4℃冰箱孵育过夜;PBS冲洗3次,滴加辣根过氧化物酶HRP标记的二抗,4℃冰箱孵育50 min;PBS洗3次后滴加DAB溶液,显微镜控制显色;苏木精复染,自来水冲洗,1%盐酸酒精分化数秒,氨水返蓝,自来水冲洗;梯度酒精脱水,二甲苯透明,中性树胶封片。阴性对照实验中,用0.01 mol·L-1PBS(pH=7.4)代替一抗,结果为阴性。每只小鼠随机选取背根神经节切片3张,在400倍的视野下,每张切片随机选取2个视野进行观察,以胞质内出现棕黄色颗粒分布计为阳性细胞。由两名操作者分别用Image-Pro Plus 6.0图像分析软件观察并计数细胞总数及阳性细胞个数,结果取平均值,计算阳性细胞百分率。
1.9统计学分析 所有数据均用SPSS 19.0软件完成统计分析,正态分布的资料用±s表示,组间比较用单因素方差分析;非正态分布的数据(机械痛阈、热痛阈)以中位数(四分位数间距,interquartile range,IQR)表示,组间差异比较采用非参数检验。
2 结果
2.1动物模型行为学表现 造模后,C组小鼠出现跛行、舔舐伤口、避免伤侧肢体负重、悬足等行为学变化,且机械痛阈和热痛阈于术后d 5~19均明显降低。S组无上述变化,L组出现上述轻微表现。
2.2机械痛阈、热痛阈的变化 各组小鼠术前基础机械痛阈、热痛阈差异无显著性,S组小鼠术前与术后差异无显著性。与术前比较,C组与L组小鼠机械痛阈、热痛阈均明显降低(P<0.05),且C组术后d 14阈值降至最低,以后逐渐恢复,至术后d 19仍明显低于术前。与C组比较:L组术后d 5,诱导期组、诱导维持期组机械痛阈明显增高(P<0.01),热痛阈无明显改变(P>0.05);长程低剂量组机械痛阈、热痛阈均无明显改变(P>0.05)。与C组相比较:L组术后d 14,诱导期组、诱导维持期组以及长程低剂量组机械痛阈明显增高(P<0.01),诱导期组及诱导维持期组的热痛阈未见明显改变(P>0.05),长程低剂量组热痛阈明显增高(P<0.01)。与C组比较:术后d 19,诱导维持期组(P<0.01)与长程低剂量组(P<0.01)机械痛阈、热痛阈均明显增高;诱导期组机械痛阈明显增高(P<0.05),热痛阈没有明显改变(P>0.05);且与诱导期组相比,长程低剂量组机械痛阈、热痛阈明显增高,差别具有显著性(P<0.01)(Tab 1)。
2.3Western blot免疫印迹 在预期的240 ku、43 ku处检测出Cav1.2、β-actin相应的蛋白条带(Fig 1A)。半定量分析发现,Cav1.2在S组表达最高,C组表达最低,在诱导期组(P<0.05)、诱导维持期组(P<0.01)给予延胡索乙素45 mg·kg-1以及长程低剂量给予延胡索乙素15 mg·kg-1(P<0.01)明显上调了Cav1.2水平(Fig 1B)。
2.4免疫组化背根神经节中Cav1.2的表达变化免疫组化结果显示,背根神经节中Cav1.2阳性细胞胞质有棕黄色颗粒,少部分胞核、胞膜着色(Fig 2A)。Cav1.2阳性细胞在对照组(32.78%± 16.58%)表达最高,在CCI组(10.29%±6.17%)表达最低。诱导期组(20.09%±9.25%)、诱导维持期组(25.00%±6.20%)以及长程低剂量组(27.79.%±12.23%)Cav1.2阳性细胞表达率明显高于C组(P<0.01)(Fig 2B)。
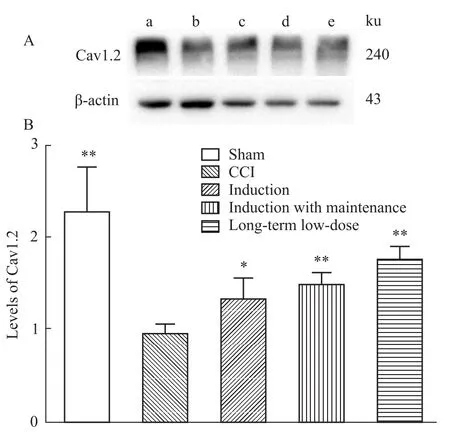
Fig 1 Expression of Cav1.2 in DRG after CCI(±s)

Tab 1 Comparison of MWT,PWL of mice at different time points after CCI[M(Q)]
3 讨论
本实验中,C组和L组小鼠均出现跛行、舔爪、足悬空等疼痛行为学表现,C组小鼠机械痛阈和热痛阈术后d 5~19均明显降低,表明小鼠神经病理性疼痛模型制备成功。本实验Western blot以及免疫组化结果发现,脊髓背根神经节Cav1.2在C组表
达水平最低,S组表达水平最高,在诱导期组、诱导维持期组及长程低剂量组表达明显上调,差异具有统计学意义(P<0.05,P<0.01),与行为学检测结果延胡索乙素可以明显缓解神经病理性疼痛诱发的机械痛敏和热痛敏同步,这提示了延胡索乙素可能是通过上调脊髓背根神经节神经元Cav1.2亚基来发挥镇痛作用的。本实验发现,高剂量延胡索乙素可以缓解诱导期、维持期的机械痛敏以及维持期的热痛敏,低剂量延胡索乙素对诱导期的机械痛敏和热痛敏均无明显作用,这与Choi等[9]报道的结果相符。本研究还发现,和诱导期应用高剂量延胡索乙素相比,长程低剂量延胡索乙素可以更有效缓解神经病理性疼痛诱导的机械痛敏和热痛敏(P<0.01),且Cav1.2表达水平也明显高于诱导期应用高剂量延胡索乙素(P<0.05),提示了长程低剂量应用延胡索乙素优于诱导期应用高剂量延胡索乙素。

Fig 2 Expression of Cav1.2 in dorsal root ganglia in different groups(±s)
延胡索乙素作为镇痛镇静药与Cav1.2的相互作用机制目前尚不明确。本实验中,脊髓背根神经节Cav1.2在C组表达水平最低,这与Kim等[13]的报道一致。Kim等认为,损伤的背根神经节神经元Cav1.2表达下调的原因可能与周围神经损伤后,背根神经节神经元细胞体的神经肽Y(NPY)增加以及背根神经节神经元交感芽生所致的去甲肾上腺素的释放有关。而有研究[14-15]发现,延胡索乙素可作为单胺耗竭剂降低中枢及外周组织去甲肾上腺素浓度。此外,延胡索在缓解创伤性应激引起的焦虑和抑郁的同时,抑制了下丘脑NPY的降低[16]。因此,可以推断延胡索乙素与去甲肾上腺素及NPY有密切关系。延胡索乙素可能通过与NPY相互作用或者通过与NPY及去甲肾上腺素共同作用,调节Cav1.2的表达来缓解神经病理性疼痛。
本实验首次探究了延胡索乙素可以通过上调L型电压门控钙通道Cav1.2亚基的水平来发挥镇痛作用,为延胡索乙素临床治疗神经病理性疼痛提出了一个新的可能机制。同时,根据神经病理性疼痛的发生及维持情况,通过设置不同的组别来探讨延胡索乙素治疗神经病理性疼痛的可能最佳方式,为应用延胡索乙素治疗神经病理性疼痛提供了临床参考。
参考文献:
[1] Cao F L,Shang G W,Wang Y,et al.Antinociceptive effects of intragastric DL-tetrahydropalmatine on visceral and somatic persi-stent nociception and pain hypersensitivity in rats[J].Pharmacol Biochem Behav,2011,100(1):199-204.
[2] Guo Z,Man Y,Wang X,et al.Levo-tetrahydropalmatine attenu-ates oxaliplatin-induced mechanical hyperalgesia in mice[J].Sci Rep,2014,4:3905.
[3] 王殊秀,冷玉芳,高向梅,邢艳红.延胡索乙素对大鼠慢性神经病理性疼痛的影响[J].临床麻醉学杂志,2012,28(7):705-7.
[3] Wang S X,Leng Y F,Gao X M,Xing Y H.Analgesic effect of levo-tetrahydropalmatine in a rat model of neuropathic pain[J].J Clin Anesthesiol,2012,28(7):705-7.
[4] Fossat P,Dobremez E,Bouali-Benazzouz R,et al.Knockdown of L calcium channel subtypes:differential effects in neuropathic pain[J].J Neurosci,2010,30(3):1073-85.
[5] Favereaux A,Thoumine O,Bouali-Benazzouz R,et al.Bidirecti-onal integrative regulation of Cav1.2 calcium channel by micro-RNA miR-103:role in pain[J].EMBO J,2011,30(18):3830 -41.
[6] Huang K,Dai G Z,Li X H,et al.Blocking L-calcium current by
l-tetrahydropalmatine in single ventricular myocyte of guinea pigs [J].Acta Pharmacol Sin,1999,20(10):907-11.
[7] 徐 春,孙明智,高金池,等.左旋四氢巴马汀对豚鼠单个心室肌细胞Ca2+通道的阻滞作用[J].中国药理学通报,1996,12(6):570-1.
[7] Xu C,Sun M Z,Gao J C,et al.Blocking calcium channel by l-tetrahydropalmatine in single ventricular myocyte of guinea pigs [J].Chin Pharmacal Bull,1996,12(6):570-1.
[8] Bennett G J,Xie Y K.A peripheral mononeuropathy in rat that produces disorders of pain sensation like those seen in man[J].Pain,1988,33(1):87-107.
[9] Choi J G,Kang S Y,Kim J M,et al.Antinociceptive effect of Cyperirhizoma and Corydalis tuber extracts on neuropathic pain in rats[J].Korean J Physiol Pharmacol,2012,16(6):387-92.
[10]徐叔云,卞如濂,陈 修,主编.药理实验方法学[M].3版.北京:人民卫生出版社,2001:202-4.
[10]Xu S Y,Bian R L,Chen X.Experimental methodology of pharma-cology[M].third edition.Beijing:People′s Medical Publishing House,2001:202-4.
[11]Yalcin I,Choucair-Jaafar N,Benbouzid M,et al.beta(2)-adre-noceptors are critical for antidepressant treatment of neuropathic pain[J].Ann Neurol,2009,65(2):218-25.
[12]Zhao X,Xu Y,Zhao Q,et al.Curcumin exerts antinociceptive effects in a mouse model of neuropathic pain:descending mono-amine system and opioid receptors are differentially involved[J].Neuropharmacology,2012,62(2):843-54.
[13]Kim D S,Yoon C H,Lee S J,et al.Changes in voltage-gated cal-cium channel alpha(1)gene expression in rat dorsal root ganglia following peripheral nerve injury[J].Brain Res Mol Brain Res,2001,96(1-2):151-6.
[14]Liu G Q,Algeri S,Garattini S.D-L-tetrahydropalmatine as mono-amine depletor[J].Arch Int Pharmacodyn Ther,1982,258(1):39-50.
[15]吴建华,金国章.(-)SPD和(-)THP对蓝斑核去甲肾上腺素能神经元自发放电的影响[J].生理学报,1995,47(6):601-4.
[15]Wu J H,Jin G Z.Effects of(-)SPD and(-)THP on the fir-ing of noradrenergic neurons in locus coeruleus[J].Acta Physiol Sin,1995,47(6):601-4.
[16]Lee B,Sur B,Yeom M,et al.L-tetrahydropalmatine ameliorates development of anxiety and depression-related symptoms induced by single prolonged stress in rats[J].Biomol Ther(Seoul),2014,22(3):213-22.
Effect of tetrahydropalmatine on expression of Cav1.2 in dorsal root ganglion neurons in mice with sciatic nerve chronic constriction injury
JIANG Hai-bo1,WANG Jun2,SU Jian-hua3,FANG Ming-ming4,YANG Nan1,YANG Jia-wei1,WAN Fen1,XIAO Hang2,TANG Jin-rong1
(1.Dept of Neurology,the First Affiliated Hospital of Nanjing Medical University,Nanjing 210029,China;2.Dept of Neurotoxicology,Nanjing Medical University,Nanjing 211100,China;3.Dept of Neurology,the Affiliated Jintan Hospital of Medical College of Jiangsu University,Jintan Jiangsu 213200,China;4.Dept of Neurology,Jiangsu Hospital of Traditional Chinese and Western Medicine,Nanjing 210028,China)
Abstract:Aim To investigate the analgesic effect of tetrahydropalmatine on Cav1.2 expression in the dorsal root ganglion(DRG)of mice with sciatic nerve chronic constriction injury(CCI)-induced neuropathic pain.Methods Forty male C57BL/6 mice were randomly divided into 5 groups(n=5):sham group(group S),CCI group(group C)and L-THP group(group L).Steady mice models of neuropathic pain were es-tablished by inducing CCI of sciatic nerve.According to development of neuropathic pain in mice,L group was divided into induction period,induction with ma-intenance period and long-term low-dose group.The mice were intraperitoneally administered with 45 mg· kg-1tetrahydropalmatine in induction(day 0~5),in-duction with maintenance(day 0~5,14~19)period of neuropathic pain state.From the instant after opera-tion,15 mg·kg-1tetrahydropalmatine was injected into the long-term low-dose group once per day for 19 days.Then,the behavior changes of mice were moni-tored.Moreover,the threshold of mechanical and ther-mal stimuli was tested.In addition,the expression of Cav1.2 protein was detected by Western blot and im-munohistochemical staining.Results The lowest ex-pression of Cav1.2 was observed in group C and the highest expression level of Cav1.2 was found in group S.Cav1.2 expression was significantly up-regulated in induction period group,induction with maintenance period group and long-term low-dose group(P<0.05,P<0.01).Compared with group C,high dose of tet-rahydropalmatine in induction period group,induction
with maintenance period group and long-term low-dose group showed reduced mechanical allodynia and ther-mal hyperalgesia induced by nerve injury(P<0.05,P<0.01).Meanwhile,high dose of tetrahydropalma-tine significantly relieved the mechanical allodynia in induction period group,induction with maintenance period group and thermal hyperalgesia in maintenance period group(P<0.05).However,there was no ob-vious effect on mechanical allodynia and thermal hyper-algesia induced by nerve injury(P>0.05)in long-term low-dose group.Conclusions High dose of tet- rahydropalmatine in induction period group,induction with maintenance period group and low-dose among the whole experiment process obviously relieves the neuro-pathic pain induced by nerve injury.The analgesic effect of tetrahydropalmatine on neuropathic pain may be due to the increased expression of Cav1.2 protein in DRG neurons.
Key words:tetrahydropalmatine;Cav1.2;sciatic nerve chronic constriction injury;neuropathic pain;dorsal root ganglion;mice
作者简介:姜海波(1984-),女,硕士,研究方向:周围神经病,E-mail:jianghaibo30@126.com;唐金荣(1964-),男,博士,副教授,硕士生导师,研究方向:周围神经病,通讯作者,E-mail:zdgaoyang@medmail.com.cn
基金项目:江苏省自然科学基金资助项目(No BK 2001116);江苏省常州市卫生局项目(No 2004-182-01)
收稿日期:2015-07-31,修回日期:2015-09-07
文献标志码:A
文章编号:1001-1978(2015)11-1598-06
doi:10.3969/j.issn.1001-1978.2015.11.023