黄连生物碱降糖作用研究及构效关系初探
马 航,胡然,邹宗尧,王德珍,叶小利,李学刚,3,4
(西南大学1.药学院、2.生命科学学院、3.重庆市药效评价工程技术研究中心、4.重庆市药物过程与质量控制工程技术研究中心,重庆 400716)
黄连生物碱降糖作用研究及构效关系初探
马 航1,胡然1,邹宗尧1,王德珍1,叶小利2,李学刚1,3,4
(西南大学1.药学院、2.生命科学学院、3.重庆市药效评价工程技术研究中心、4.重庆市药物过程与质量控制工程技术研究中心,重庆 400716)
中国图书分类号:R-332;R284.1;R587.105.31;R977.15
摘要:目的 研究黄连治疗糖尿病的物质基础。方法 考察了黄连生物碱(小檗碱、黄连碱、巴马汀、表小檗碱和药根碱)对自发性糖尿病小鼠KK-Ay的降糖活性。结果 连续给予生物碱(225 mg·kg-1·d-1,灌胃)40 d后,小檗碱和黄连碱能明显降低小鼠空腹血糖值并改善糖耐量;表小檗碱控制体重增长作用最强;小檗碱减缓了胰岛素(INS)抵抗;药根碱明显提高肝脏超氧化物歧化酶(SOD)含量,降低丙二醛(MDA)水平。结论 黄连生物碱中起降糖作用的主要是小檗碱和黄连碱,巴马汀、表小檗碱和药根碱在治疗糖尿病方面发挥不同的协同作用。推测生物碱母核中A环C2、C3位的亚甲二氧基和D环C9、C10位的甲氧基同时存在时,降糖作用最强。
关键词:黄连生物碱;糖尿病;KK-Ay小鼠;氧化应激;糖耐量;胰岛素
网络出版时间:2015-10-16 9:52 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20151016.0952.038.html
黄连(Coptidis Rhizoma,RC)用于治疗消渴症已有上千年的历史(数千年来糖尿病在中国被称为消渴病),主要活性成分为小檗碱,此外尚含丰富的黄连碱、巴马汀、表小檗碱和药根碱[1],并作为2010年版《中国药典》黄连含量测定的标准[2](药根碱除外)。其中小檗碱降糖活性明显,被认为是黄连降糖活性成分[3]。近几年研究报道,黄连煎剂降糖效果优于小檗碱[4],说明黄连除小檗碱外,还有其它成分在发挥降糖作用,因此,需进一步研究寻找黄连治疗糖尿病的更多有效成分。
黄连生物碱具有相同的二苯并[a,g]喹嗪环母核,差异表现在A环C2、C3位,D环C9、C10的取代基[5],同属于异喹啉类生物碱(结构式见Fig 1)。研究表明,黄连生物碱具有相似的调节血脂、抗氧化、抑制醛糖还原酶等药理活性[6-9],预示5种生物碱具有相近的药理作用。此外,文献还报道黄连碱胃黏膜保护作用强于小檗碱[10],而小檗碱清除自由基能力不如药根碱[11],说明5种生物碱的药理作用存在差异。有关5种生物碱治疗糖尿病的报道很少,因此,有必要评价5种生物碱的降糖作用,研究其治疗糖尿病的特点。
结合小檗碱降糖作用机制[12-13],以及黄连碱、巴马汀、表小檗碱和药根碱药理作用研究现状,我们以空腹血糖值、糖耐量、血清胰岛素水平及抗氧化指标评价5种生物碱对2型糖尿病的降糖作用,并初
步探讨生物碱降糖作用与结构的关系。
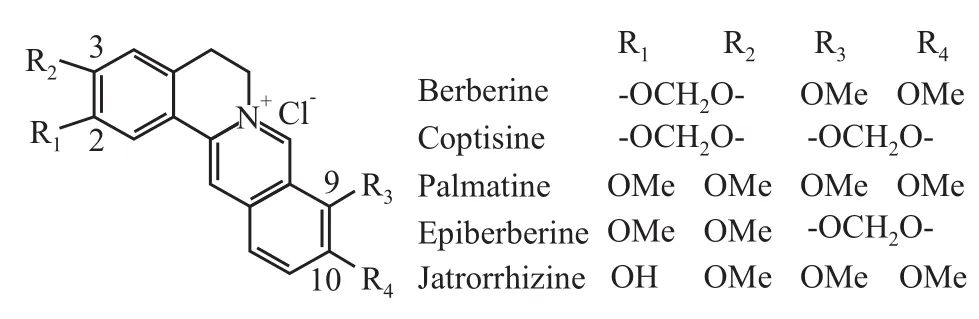
Fig 1 Chemical structure of berberine,coptisine,palmatine,epiberberine and jatrorrhizine
1 材料与方法
1.1动物 KK-Ay小鼠(KK/UPJ-Ay/J),♂,8周龄,体质量(40±5)g,购自北京华阜康生物技术有限公司,许可证号SCXK(京)2009-0004。KK-Ay小鼠高脂饲料购自北京华阜康生物技术有限公司。
1.2仪器 Elx808型台式酶标仪(Bio-Tek有限公司),UV-2550紫外分光光度计(日本岛津公司),Milli-Q Biocel型超纯水系统(美国Millipore公司),Auanti J-301高速冷冻离心机(美国贝克曼库尔特公司),血糖仪(长沙三诺生物传感技术有限公司)。
1.3药品与试剂 小檗碱、巴马汀、黄连碱、表小檗碱、药根碱(纯度>0.95)由西南大学药学院黄连研究课题组提供;盐酸二甲双胍片购自北京中慧药业有限公司(批号:20120510);SOD试剂盒(批号:20121217)、MDA测试盒(批号:20121217)购自南京建成生物工程有限公司;BCA蛋白定量测定试剂盒(批号:27F00750)购自北京鼎国生物技术有限公司;胰岛素(INS)酶联免疫试剂盒(批号:130100801)购自北京博奥森生物技术有限公司。
1.4实验动物分组 KK-Ay小鼠自由饮食、饮水2周后,空腹12 h,尾静脉取血,测定血糖值。根据血糖值和体重,将KK-Ay小鼠随机分为7组:高糖空白对照组(CON)、阳性药物二甲双胍组(MET)、小檗碱组(BBR)、黄连碱组(COP)、巴马汀组(PAL)、表小檗碱组(EPI)和药根碱组(JAT),每组6只,单笼喂养。每天分别灌胃给药225 mg·kg-1,试验周期为40 d。每10天记录1次空腹血糖值和体重变化,实验的d 18、36分别进行糖耐量实验。
1.5糖耐量实验(OGTT) 小鼠连续灌胃给药18 d后,空腹12 h,称重,按每天的灌胃剂量给小鼠灌胃药物,30 min后,给小鼠口服2 g·kg-1的葡萄糖溶液,尾静脉取血,分别测定0、30、60、90、120 min时的血糖值。小鼠连续灌胃给药36 d后,重复1次糖耐量实验。
1.6血清胰岛素,肝脏SOD、MDA含量测定 连续灌胃40 d后,小鼠空腹12 h,称重,从小鼠眼眶后静脉取血,室温下放置20 min,离心(4℃,1800×g,15 min),取血清,按照试剂盒说明测定胰岛素含量(FINS)。胰岛素敏感指数计算公式:胰岛素敏感指数(ISI)=Ln[1/(空腹血糖×空腹胰岛素)],其中血糖单位为mmol·L-1,胰岛素单位为IU·L-1。
小鼠脱颈处死后,剖取肝脏,用生理盐水冲洗表面血迹,滤纸吸干。称取肝脏200.0 mg,加入生理盐水2.0 mL,冰浴条件下,机械匀浆2 min,离心(4℃,3 600×g,15min),取上清液,按BCA蛋白法测定肝脏中蛋白质含量,然后测定组织中SOD酶活力和MDA含量,酶活力以组织中每毫克蛋白当量计算。
2 结果
2.1KK-Ay小鼠体重变化 Fig 2为各实验组KK-Ay小鼠体重增量的变化图。结果显示,给药期间,除表小檗碱组外,各组小鼠的体重均保持比较平稳的增长趋势,增长趋势药物组小于对照组。表小檗碱组体重增量与对照组相比,d 20时差异有显著性,d 30时差异有显著性;黄连碱组在d 40时达到差异显著性。实验结束后,与d 0相比,对照组、二甲双胍组、小檗碱组、黄连碱组、巴马汀组、药根碱组的体重分别增加11.8%、6.2%、2.9%、5.7%、8.6%和6.7%。

Fig 2 Effects of five RC alkaloids on body weight gain(±s,n=6)
2.2KK-Ay小鼠的空腹血糖值变化 各实验组对KK-Ay小鼠空腹血糖值(FBG)的影响见Fig 3。5种生物碱中小檗碱降糖作用最强,与二甲双胍相当,黄连碱作用次之。从d 30开始,小檗碱组和黄连碱组小鼠空腹血糖值与对照组相比,差异有显著性。实验结束时,二甲双胍组、小檗碱组、黄连碱组、巴马汀组、表小檗碱组和药根碱组的空腹血糖值与d 0相比,分别降低了46.5%、42.3%、36.5%、26.3%、
31.4%、23.2%,对照组升高了6.8%。5种生物碱的降血糖作用:小檗碱>黄连碱>表小檗碱>巴马汀>药根碱。

Fig 3 Effects of days′oral administration of five RC alkaloids on FBG level(±s,n=6)
2.3KK-Ay小鼠的糖耐量变化 Fig 4中,A图为d 18进行的糖耐量实验结果,从图中可以看出,各组小鼠餐后血糖在30 min时达到最高,30 min之后,血糖开始下降,120 min后,餐后血糖值仍未恢复到正常水平。从30 min时的餐后血糖值可以看出,经过18 d的连续给药,小檗碱组KK-Ay小鼠对葡萄糖的耐受程度与空白组相比,差异有显著性,黄连碱对KK-Ay小鼠的耐受程度有一定的改善。
B图为d 36进行的糖耐量实验结果,0 min时阳性对照组、小檗碱组和黄连碱组的餐后血糖与对照组相比,差异有显著性,说明经过36 d的连续给药后,小檗碱和黄连碱对KK-Ay小鼠糖耐量的改善作用增加。30 min时的餐后血糖值表明,表小檗碱对KK-Ay小鼠糖耐量的改善作用也趋于明显,巴马汀和药根碱的改善作用不明显。
2.4血清胰岛素和胰岛素敏感指数 黄连生物碱对KK-Ay小鼠空腹血清胰岛素水平的影响见Tab 1。给药40 d后,各组KK-Ay小鼠血清胰岛素含量都比空白组低,胰岛素敏感指数提高。与对照组相比,小檗碱组的胰岛素含量降低最明显,达到了48.1%,且敏感指数升高了18.6%。
Tab 1 FBG,FINS and ISI levels in each group(±s)
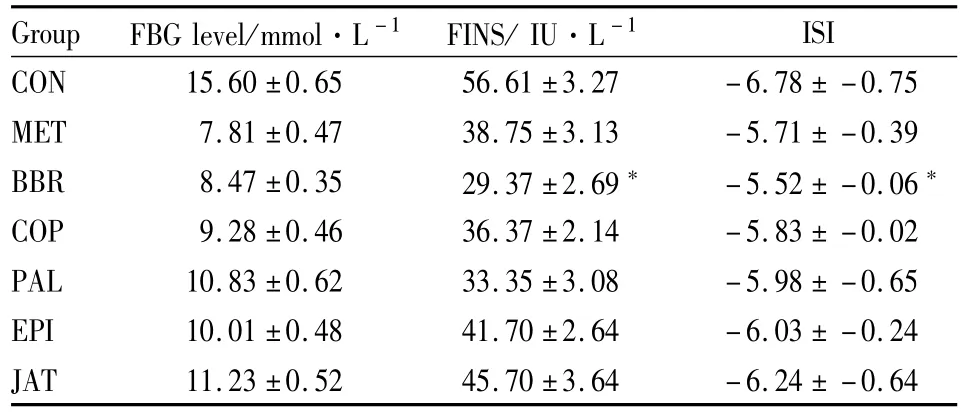
Tab 1 FBG,FINS and ISI levels in each group(±s)
*P<0.05 vs diabetic control group
Group FBG level/mmol·L-1 FINS/IU·L-1ISI CON 15.60±0.65 56.61±3.27 -6.78±-0.75 MET 7.81±0.47 38.75±3.13 -5.71±-0.39 BBR 8.47±0.35 29.37±2.69 -5.52±-0.06*COP 9.28±0.46 36.37±2.14 -5.83±-0.02 PAL 10.83±0.62 33.35±3.08 -5.98±-0.65 EPI 10.01±0.48 41.70±2.64 -6.03±-0.24 JAT 11.23±0.52 45.70±3.64 -6.24±-0.64

Fig 4 Oral glucose tolerance tests in diabetic KK-Ay mice(±s,n=6)
Tab 2 Levels of SOD and MDA in liver(±s)
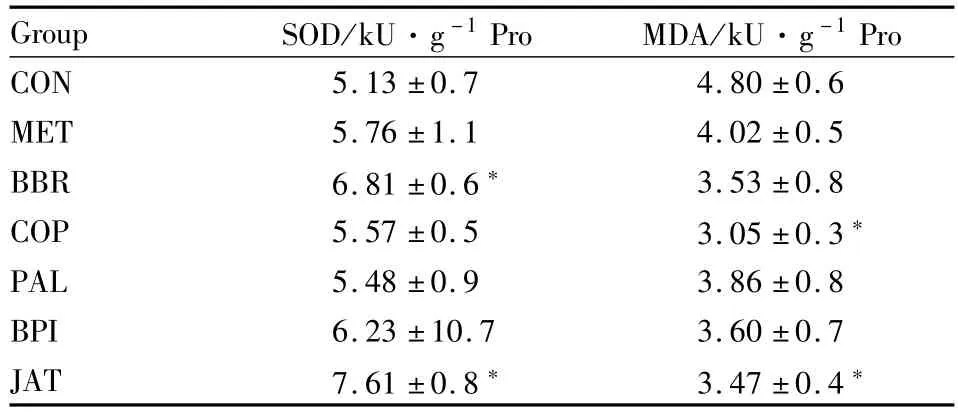
Tab 2 Levels of SOD and MDA in liver(±s)
*P<0.05 vs diabetic control group
Group SOD/kU·g-1Pro MDA/kU·g-1Pro CON 5.13±0.7 4.80±0.6 MET 5.76±1.1 4.02±0.5 BBR 6.81±0.6 3.53±0.8 COP 5.57±0.5 3.05±0.3*PAL 5.48±0.9 3.86±0.8 BPI 6.23±10.7 3.60±0.7 JAT 7.61±0.8 3.47±0.4*
2.5肝脏SOD、MDA含量 BCA法测定的蛋白质在0~1.4 g·L-1范围内线性良好,线性方程为:Y=0.487X+0.255(R2=0.993),各组肝脏中蛋白质含量未列出。肝脏中SOD酶活性是反映机体抗氧化能力的指标之一,MDA的含量反映机体脏器的受损程度,脏器的受损程度又与糖尿病并发症的发生有关。从Tab 2中看出,5种生物碱都能提高KK-Ay
小鼠SOD酶活性,降低MDA含量,药根碱、小檗碱组与空白组相比,差异有显著性,抗氧化能力:药根碱>小檗碱>黄连碱。
3 讨论
胰岛素抵抗是2型糖尿病的一个重要发病机制,与糖尿病脂代谢紊乱、胰岛β细胞损伤、胰岛功能衰竭存在密切关系[14]。据文献报道,PI3K途径是胰岛素信号转导的主要通路之一,胰岛素刺激包括脂肪和骨骼肌在内的靶组织摄取利用葡萄糖是通过胰岛素受体(InsR)→胰岛素受体底物-1(IRS-1)→磷脂酰肌醇-3激酶(PI3K)→葡萄糖糖转运蛋白(GLUT4)等一系列信号转导过程完成的[15]。在此信号转导过程中,任意一环节出现障碍,均可引起胰岛素抵抗,从而导致2型糖尿病。空腹血糖值是评价降血糖药物疗效的重要指标,而糖耐量实验则是临床上诊断糖尿病的一种辅助手段[16]。氧化应激与糖尿病并发症的发生密切相关,其作用十分复杂,除直接损伤胰岛β细胞外,还可作为信号分子激活一些应激敏感通路,调节相关因子的表达,引起β细胞凋亡或坏死,抑制胰岛素分泌,诱发胰岛素抵抗,最终引发或加重糖尿病[17]。氧化应激是引发糖尿病慢性并发症的主要原因之一。MDA是反映体内氧化应激状态较可靠、稳定的指标,MDA含量可反映机体脂质过氧化的程度,间接反映出细胞损伤的程度。SOD为抗氧化系统的主要成分,在氧化-抗氧化平衡中起重要作用[18]。
本研究中采用的KK-Ay小鼠是经典的2型糖尿病动物模型,其模拟了人类2型糖尿病的发病进程,8周龄时出现肥胖、高血糖、高胰岛素、葡萄糖耐受不良等症状。实验结果显示,连续给药40 d后,表小檗碱和黄连碱能有效控制糖尿病小鼠的体重增加,减轻KK-Ay小鼠肥胖症状;小檗碱和黄连碱明显降低空腹血糖值并改善糖耐量;小檗碱降低小鼠空腹血清胰岛素水平,小鼠胰岛素抵抗指数明显升高,胰岛素敏感指数明显降低;5种生物碱均能提高肝脏SOD酶活力,降低MDA含量。实验结果显示,黄连生物碱中起降糖作用的主要是小檗碱和黄连碱,巴马汀、表小檗碱和药根碱在治疗糖尿病方面发挥不同的作用,对黄连的降糖具有辅助作用,其中药根碱的抗氧化作用可能与预防糖尿病并发症有关,这些因素的综合结果可能是黄连煎剂对糖尿病的治疗效果优于小檗碱的原因。
5种生物碱的结构差异表现在A环C2、C3位,D环C9、C10的取代基(亚甲二氧基、甲氧基或酚羟基)。Diculescu等[19]报道,小檗碱的氧化电位实验中,在施加外电压时,小檗碱C2、C3位上的亚甲二氧基团性质活泼,易发生氧化反应,生产两个亚甲基。Bian等[20]研究表明,小檗碱结构中C2、C3位的亚甲二氧基是小檗碱与β细胞膜结合的必不可少的部位,当亚甲二氧基环被氧化打开后,小檗碱与β细胞膜的结合作用消失。更多文献显示[21-22],生物碱分子结构中A和D环中的取代基是生物碱表现抑制醛糖还原酶、ONOO的损伤作用及清除自由基的关键基团。本研究结果证明小檗碱和黄连碱是主要降糖生物碱,小檗碱作用强于黄连碱,从结构式中可以看出,只有小檗碱和黄连碱C2、C3位上有亚甲二氧基,黄连碱C9、C10位上为亚甲二氧基,小檗碱则氧化为两个甲氧基,推测生物碱母核中A环C2、C3位的亚甲二氧基和D环C9、C10位的甲氧基同时存在时,降糖作用最强,可能与亚甲二氧基的氧化性有关,其潜在的机制还有待进一步研究验证。
(致谢:本实验完成于西南大学药学院黄连研究课题组,作者在实验过程中得到了导师李学刚教授和叶小利教授的技术指导,以及所有同门的大力支持,在此表示感谢。)
参考文献:
[1] 邹晨辉,申竹芳.黄连生物碱抗糖尿病机制的研究进展[J].中草药,2004,35(11):2-5.
[1] Zou C H,Shen Z F.Anti-diabetic mechanism of alkaloids in Cop-tis Chinensis[J].Chin Tradit Herbal Drugs,2004,35(11):2-5.
[2] 中国药典委员会.中国药典[M].2010版.北京:中国医学科学出版社,2010:285.
[2] Chinese Pharmacopoeia Commission.Pharmacopoeia of the People′s Republic of China[M].2010 ed.Beijing:China Medi-cal Science Press,2010:285.
[3] 李彩虹,周克元.黄连活性成分的作用及机制研究进展[J].时珍国医国药,2010,21(2):466-8.
[3] Li C H,Zhou K Y.Study advances on the effects and mechanisms of active constituents of Coptidis Rhizoma[J].Lishizhen Med Mater Med Res,2010,21(2):466-8.
[4] 付 燕,胡本容,汤 强,等.药根碱、小檗碱、黄连煎剂及模拟方对小鼠血糖的影响[J].中草药,2005,36(4):548-51.
[4] Fu Y,Hu B R,Tang Q,et al.Effect of jatrorrhizine,berberine,Huanglian Decoction and compound-mimic prescription on blood glucose in mice[J].Chin Tradit Herbal Drugs,2005,36(4):548-51.
[5] Yu S,Pang X,Deng Y,et al.A sensitive and specific liquid chromatography mass spectrometry method for simultaneous deter-mination of berberine,palmatine,coptisine,epiberberine and ja-trorrhizine from Coptidis Rhizoma in rat plasma[J].Int J Mass Spectrom,2007,268(1):30-7.
[6] Jung H A,Yoon N Y,Bae H J,et al.Inhibitory activities of the alkaloids from Coptidis Rhizoma against aldose reductase[J].Arch Pharmacal Res,2008,31(11):1405-12.
[7] Yuan L,Tu D,Ye X,et al.Hypoglycemic and hypocholester-olemic effects of Coptis chinensis franch inflorescence[J].Plant Foods Hum Nutr,2006,61(3):139-44.
[8] Tanabe H,Suzuki H,Mizukami H,et al.Double blockade of cell cycle progression by coptisine in vascular smooth muscle cells[J].Biochem Pharmacol,2005,70(8):1176-84.
[9] 刘慰华,刘世明,林双峰,等.黄连素通过S1P2-MAPK信号通路抗糖尿病肾纤维化作用机制研究[J].中国药理学通报,2013,29(5):723-8.
[9] Liu W H,Liu S M,Lin S F,et al.Role of berberine in fibronec-tin expression via S1P2-MAPK signaling pathway in diabetic ne-phropathy[J].Chin Pharmacol Bull,2013,29(5):723-8.
[10]李 峰,张 浩,华 桦,等.黄连碱对应激所致小鼠胃黏膜损伤的保护作用[J].华西药学杂志,2007,22(6):713-4.
[10]Li F,Zhang H,Hua Y,et al.Protective effect of gastric mucosal injury induced by coptisine[J].West China J Pharm,2007,22 (6):713-4.
[11]Rackova L,Majekova M,Kostalova D,et al.Antiradical and an-tioxidant activities of alkaloids isolated from Mahonia aquifolium [J].Bioorg Med Chem,2004,12(17):4709-15.
[12]Tang L Q,Wei W,Chen L M,et al.Effects of berberine on dia-betes induced by alloxan and a high-fat/high-cholesterol diet in rats[J].J Ethnopharmacol,2006,108(1):109-15.
[13]Wang Y,Campbell T,Perry B,et al.Hypoglycemic and insulin-sensitizing effects of berberine in high-fat diet-and streptozotocin-induced diabetic rats[J].Metabolism,2010,60(2):298-305.
[14]Panunti B,Jawa A A,Fonseca V A.Mechanisms and therapeutic targets in type 2 diabetes mellitus[J].Drug Discov Today,2004,1(2):151-7.
[15]Wojtaszewski J F P,Hansen B F,Kien B,et al.Insulin signaling in human skeletal muscle:time course and effect of exercise[J].Diabetes,1997,46(11):1775-81.
[16]Guo F X,Zeng Y,Li J P,et al.Effects of Hippophae rhamnoides L.subsp.chinensis Rousi polysaccharide on alpha-glucosidase en-zyme activity and level of blood glucose[J].Acta Pharm Sin,2013,48(4):604-8.
[17]Forbes J M,Coughlan M T.Oxidative stress as a major culprit in kidney diabetes[J].Diabetes,2008,57(6):1446-54.
[18]王月芬,叶山东,邢 燕.吡格列酮对STZ糖尿病大鼠肾组织氧化应激的影响[J].中国药理学通报,2013,29(1):85-8.
[18]Wang Y F,Ye S D,Xing Y.Effect of different dosages of piogti-tazone on the oxidative stress in the kidney of STZ-induced diabetic rats[J].Chin Pharmacol Bull,2013,29(1):85-8.
[19]Diculescu V C,Enache T A,Oliveira P J,et al.Electrochemical oxidation of berberine and of its oxidation products at a glassy car-bon electrode[J].Electroanalysis,2009,21(9):1027-34.
[20]Bian X,He L,Yang G.Synthesis and antihyperglycemic evalua-tion of various protoberberine derivatives[J].Bioorg Med Chem Lett,2009,16(5):1380-3.
[21]Yokozawa T,Satoh A,Cho E J,et al.Protective role of Coptidis Rhizoma alkaloids against peroxynitrite-induced damage to renal tubular epithelial cells[J].J Pharm Pharmacol,2005,57(3):367-74.
[22]Rackova L,Oblozinsky M,Kostalova D,et al.Free radical scav-enging activity and lipoxygenase inhibition of Mahonia aquifolium extract and isoquinoline alkaloids[J].J Inflam,2007,4:15-21.
Preliminary evaluation of antihyperglycemic effect of Rhizoma Coptidis alkaloids and their structure-activity relationships
MA Hang1,HU Yin-ran1,ZOU Zong-yao1,WANG De-zhen1,YE Xiao-li2,LI Xue-gang1,3,4
(1.School of Pharmacy,2.School of Life Science,3.Chongqing Engineering Research Center for Pharmacodynamics Evaluation,4.Chongqing Engineering Research Center for Pharmaceutical Process and Quality Control,Southwest University,Chongqing 400716,China)
Abstract:Aim To find the material foundation of treatment for diabetes in Coptidis Rhizoma(RC).Methods The antihyperglycemic effect of RC alka-loids(berberine,coptisine,palmatine,epiberberine,and jatrorrhizine)was evaluated in spontaneity diabe-tes KK-Ay mice.Results After 40 days′oral admin-istration(225 mg·kg-1·d-1,ig),berberine and coptisine significantly suppressed the elevated fasting blood glucose level and ameliorated the glucose toler-ance.Body weight gain of KK-Ay mice was significant-ly decreased in the epiberberine-treated group.Berber-ine improved insulin resistance and jatrorrhizine in- creased the SOD activity,decreased the MDA level.Conclusions These results indicate that the main an-tihypoglycemic effect constituents are berberine and coptisine,while they show different mechanisms.Pal-matine,epiberberine and jatrorrhizine display different potential roles in the treatment of diabetes.The meth-ylene-dioxy groups at the C-2,C-3,C-9 and C-10 po-sitions are indispensable for antihyperglycemic effect of RC alkaloids.
Key words:Rhizoma Coptidis alkaloid;diabetes;KK-Ay mice;oxidative stress;glucose tolerance;insulin
作者简介:马 航(1993-),男,硕士生,研究方向:中药药理学,E-mail:20116806@cqu.edu.cn;李学刚(1964-),男,博士,教授,博士生导师,研究方向:天然产物的开发利用及其药理作用,通讯作者,Tel/Fax:023-68250728,E-mail:xuegangli@swu.edu.cn
基金项目:科技部十二五科技支撑计划项目(No 2011BAI13B02-1);2013年重庆市“百名工程技术高端人才培养计划”;教育部博士点基金(No 20130182110023);西南大学校地合作基金(No Sz201312、Sz201401)
收稿日期:2015-08-07,修回日期:2015-09-07
文献标志码:A
文章编号:1001-1978(2015)11-1575-05
doi:10.3969/j.issn.1001-1978.2015.11.019

