大黄素激活AMPK、PPARγ对3T3-L1脂肪细胞葡萄糖摄取的影响
洪海棉,谢秀利,洪桂祝,赖文芳
(福建中医药大学药学院,福建福州 350122)
大黄素激活AMPK、PPARγ对3T3-L1脂肪细胞葡萄糖摄取的影响
洪海棉,谢秀利,洪桂祝,赖文芳
(福建中医药大学药学院,福建福州 350122)
中国图书分类号:R-332;R284.1;R329.24;R343.23;R587.1
摘要:目的 研究大黄素对3T3-L1脂肪细胞葡萄糖摄取的影响,并探讨其作用机制。方法 诱导分化成熟的3T3-L1脂肪细胞经LPS干预后分为Control组、大黄素给药组(1、10、50 μmol·L-1),检测6-NBDG摄取情况及GLUT4、PPARγ、AMPKα1/2、p-AMPKα1/2、IRS-1、p-IRS-1、Adiponec-tin、chREBP-α和chREBP-β的表达。用AMPK和PPARγ抑制剂分别干预后,检测6-NBDG的摄取情况。同时,以STZ诱导大鼠2型糖尿病模型,分为Control组和大黄素给药组,检测大鼠内脏脂肪组织的Adiponectin的mRNA表达及GLUT4、AMPKα1/2、p-AMPKα1/2蛋白表达。结果 与Con-trol组相比,大黄素可促进GLUT4、Adiponectin、chREBP-α、chREBP-β的mRNA表达及GLUT4、PPARγ、IRS-1、p-IRS-1、AMPKα1/2和p-AMPKα1/2的蛋白表达(P<0.05),可提高3T3-L1脂肪细胞对6-NBDG的摄取,经AMPK及PPARγ抑制剂分别干预后,大黄素对6-NBDG的摄取降低(P<0.05)。同时,大黄素可促进T2DM大鼠内脏脂肪组织Adiponectin的mRNA表达及GLUT4、AMPKα1/2和p-AMPKα1/2的蛋白表达(P<0.05)。结论 大黄素可促进3T3-L1脂肪细胞的葡萄糖摄取功能,其作用机制与激活Adiponectin及IRS-1,进而激活AMPK和PPARγ的信号通路有关。
关键词:大黄素;2型糖尿病;葡萄糖摄取;3T3-L1细胞;葡萄糖转运体4;AMPK;PPARγ
网络出版时间:2015-10-16 9:52 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20151016.0952.036.html
大黄是蓼科植物掌叶大黄Rheum palmatum L.、唐古特大黄Rheum tanguticum’Maxim.ex Balf.或药用大黄Rheum officinale Baill.的干燥根和根茎,2010版中国药典介绍大黄具有泻下攻积、清热泻火、凉血解毒、逐瘀通经、利湿退黄的功效。大黄素(emodin)是大黄的主要有效成分之一,有研究发现大黄素具有抗炎、降糖、降脂等作用,并能改善胰岛素抵抗,具有治疗2型糖尿病(type 2 diabetes melli-tus,T2DM)的潜在价值[1-3]。
葡萄糖转运体4(glucose transporter type 4,GLUT4)是脂肪细胞和肌细胞摄取葡萄糖的重要转运体[4],并受AMP依赖的蛋白激酶[adenosine 5’-monophosphate(AMP)-activated protein kinase,AMPK]和过氧化物酶体增殖物激活受体(peroxi-some proliferator-activated receptor γ,PPARγ)的调控。激活AMPK或PPARγ均可促进细胞编码GLUT4基因和GLUT4蛋白向细胞膜转位,是治疗T2DM的重要靶点[5-7]。课题组前期发现,大黄素对链脲佐菌素(STZ)诱导T2DM大鼠的胰岛素有增敏作用,并明显上调T2DM大鼠皮下脂肪组织细胞膜上GLUT4蛋白的表达[8],但对其药理作用的分子机制尚不明确。本研究进一步从AMPK和PPARγ途径探讨大黄素对脂肪细胞葡萄糖摄取的作用机制。
1 材料
1.1实验动物与细胞株 ♂Wistar大鼠[上海斯莱克实验动物有限责任公司,许可证号:SCXK(沪)2012-0002],由福建中医药大学实验动物中心饲养;小鼠3T3-L1成纤维细胞(中国科学院上海生命科学研究院)。
1.2药品与试剂 大黄素(纯度≥98%,陕西森弗生物技术有限公司,货号:20111120006);Rever-taid First Strand cDNA Synthesis Kit(美国Fermentas公司);RNeasyMini Kit(德国Qiagen公司,货号:74104);6-NBDG(Sigma-Aldrich,货号:72987);SDS-PAGE凝胶配制试剂盒(上海碧云天生物技术研究所);GW9662(Sigma-Aldrich公司,货号:M6191);Compound C(Sigma-Aldrich公司,货号:P5499);抗体AMPKα1/2(Santa Cruz公司,货号:sc-25792)、p-AMPKα1/2(Santa Cruz公司,货号:sc-33524)、PPARγ(Santa Cruz公司,货号:sc-7273)、GLUT4 (Santa Cruz公司,货号:sc-7938)、IRS-1(Santa Cruz公司,货号:sc-559)和p-IRS-1(Santa Cruz公司,货号:sc-33956);小鼠18S rRNA探针引物(货号:4319413E,Applied Biosystems)。
1.3仪器 凝胶成像分析系统(Bio-Rad,型号:ChemiDoc XRS+),PCR仪(Bio-Rad,型号:C1000),荧光定量PCR仪(Applied Biosystems,型号:7900HT),高速台式冷冻离心机(Thermo Fisher,型号:Primo R)。
2 方法
2.1细胞诱导及处理方法 3T3-L1前脂肪细胞接种到24孔板中,培养于37℃、5%CO2培养箱中。用第1诱导液(10%胎牛血清和1%双抗的高糖DMEM,0.5 mmol·L-1异丁基甲基黄嘌呤,1.0 mg ·L-1胰岛素和1.0 μmol·L-1地塞米松)培养细胞48 h,更换为第2诱导液(10%胎牛血清和1%双抗的高糖DMEM,1 mg·L-1胰岛素)培养16 d,采用油红O染色法染色观察细胞内有油滴聚集,即表示3T3-L1细胞已诱导分化为成熟的脂肪细胞。经10 μg·L-1LPS干预24 h后,实验分为Control组、Emodin给药组(1、10、50 μmol·L-1),收集细胞检测各项指标。同时,3T3-L1脂肪细胞经10 μg·L-1LPS干预24 h,分为Control组、Emodin组、GW9662 (5 μmol·L-1)+Emodin组、Compound C(10 μmol ·L-1)+Emodin组。各组加入20 μmol·L-1葡萄糖类似物6-NBDG培养30 min。吸去培养液,用PBS洗涤细胞3遍,加入含1%曲通X-100的0.1 mol·L-1pH 10磷酸钾缓冲液70 μL,避光裂解细胞10 min后,加入30 μL DMSO,轻轻摇动,使其与裂解液充分混匀后,用激发波长466 nm和发射波长540 nm荧光检测每孔荧光强度。
2.2动物造模及处理方法 STZ诱导T2DM模型的方法参照Lai等[9]的报道。♂Wistar大鼠(200± 20)g经适应性喂养后,改换高脂饲料饲养6周。经腹腔注射25 mg·kg-1STZ,4周后检查大鼠空腹血糖(FBG)水平,FBG>7.8 mmol·L-1的大鼠视为T2DM模型。实验大鼠随机分为Control组和大黄素给药组,给药组每天灌胃大黄素100 mg·kg-1,Control组灌胃等体积的0.5%Na-CMC,连续灌胃21 d,并观察大鼠每天的体重变化和进食情况。d 21取内脏脂肪组织进行后续实验。
2.3Real-time PCR检测mRNA的表达 按照QIAGEN RNeasyMini Kit试剂盒的操作步骤提取动物组织或细胞总RNA,用Revertaid First Strand cDNA Synthesis Kit试剂盒进行逆转录为cDNA。PCR反应以cDNA为模板,反应条件为50℃2 min,95℃预变性15 s,退火60℃30 s,40个循环。每个实验重复处理3批样品,每批样品分别以同一批样品的内参计算ΔΔCt,以2-ΔΔCt计算各组mRNA的表达量。ΔΔCt=各组(Ct目的基因-Ct内参)-对照组(Ct目的基因-Ct内参)。PCR引物由上海捷瑞生物工程有限公司参照GenBank合成。引物序列详见Tab 1。
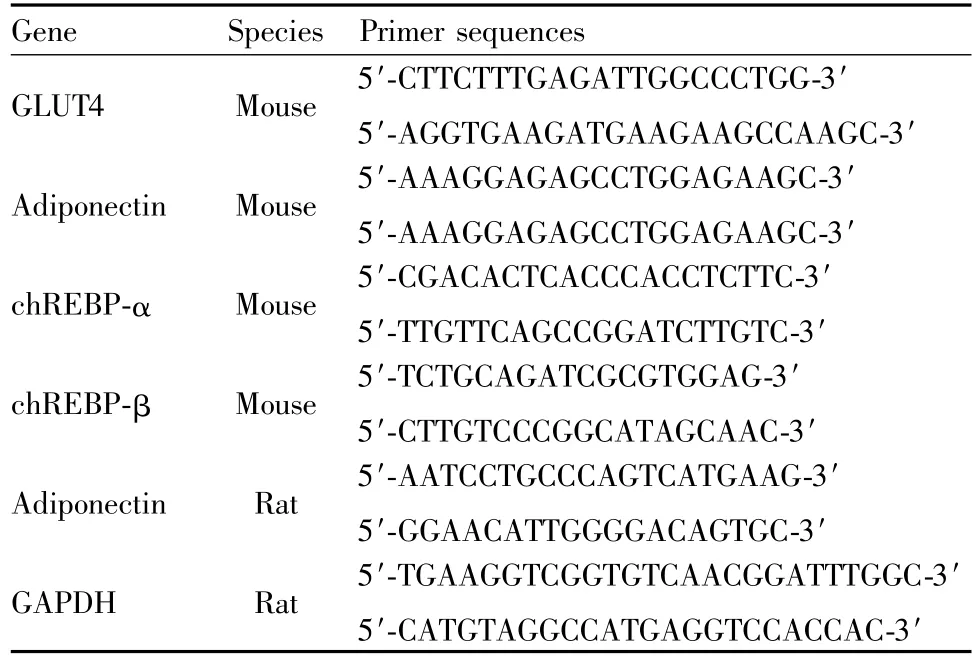
Tab 1 Sequences of primers for Real-time PCR
2.4Western blot法检测蛋白的表达 用含1% PMSF的RIPA裂解液裂解动物组织或细胞,离心取上清液,用BCA法检测蛋白浓度,加1×上样缓冲液,100℃变性10 min。用SDS-PAGE凝胶进行电泳、转膜、封闭、4℃孵育一抗过夜,TBST洗膜3遍后,孵育二抗2 h,用Bio-Rad凝胶成像系统进行ECL显影。
2.5统计学处理 实验数据用SPSS 20.0软件进行统计分析,所有结果以±s表示,组间比较采用Student-t检验或one-way ANOVA进行统计。
3 结果
3.1油红O染色观察诱导分化的3T3-L1脂肪细胞 诱导分化后的3T3-L1细胞,体积变大,多呈圆形,胞质内容丰富,用油红O染色可见红色脂滴富集细胞核周(Fig 1)。表明3T3-L1脂肪细胞已经诱导分化成熟。
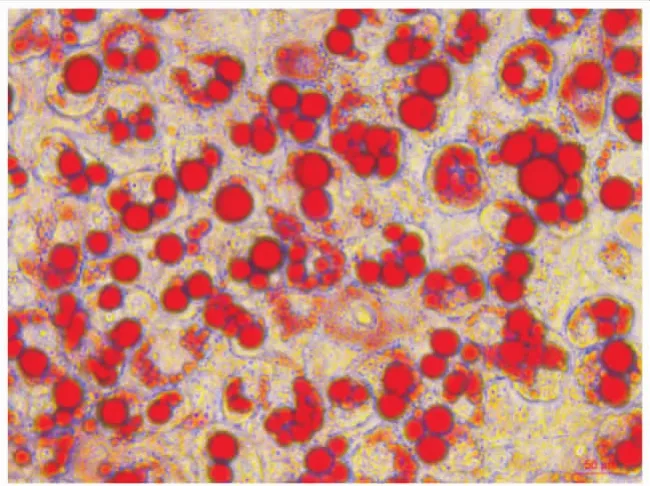
Fig 1 Differentiated 3T3-L1 adipocytes strained by oil red O(scale bar=50 μm)
3.2大黄素对3T3-L1脂肪细胞的细胞膜GLUT4
及细胞摄取6-NBDG的影响 与Control组相比,大黄素给药组明显提高3T3-L1脂肪细胞对6-NBDG的摄取,并提高细胞膜上GLUT4的mRNA及蛋白表达水平,且差异有显著性(P<0.05)(Fig 2)。
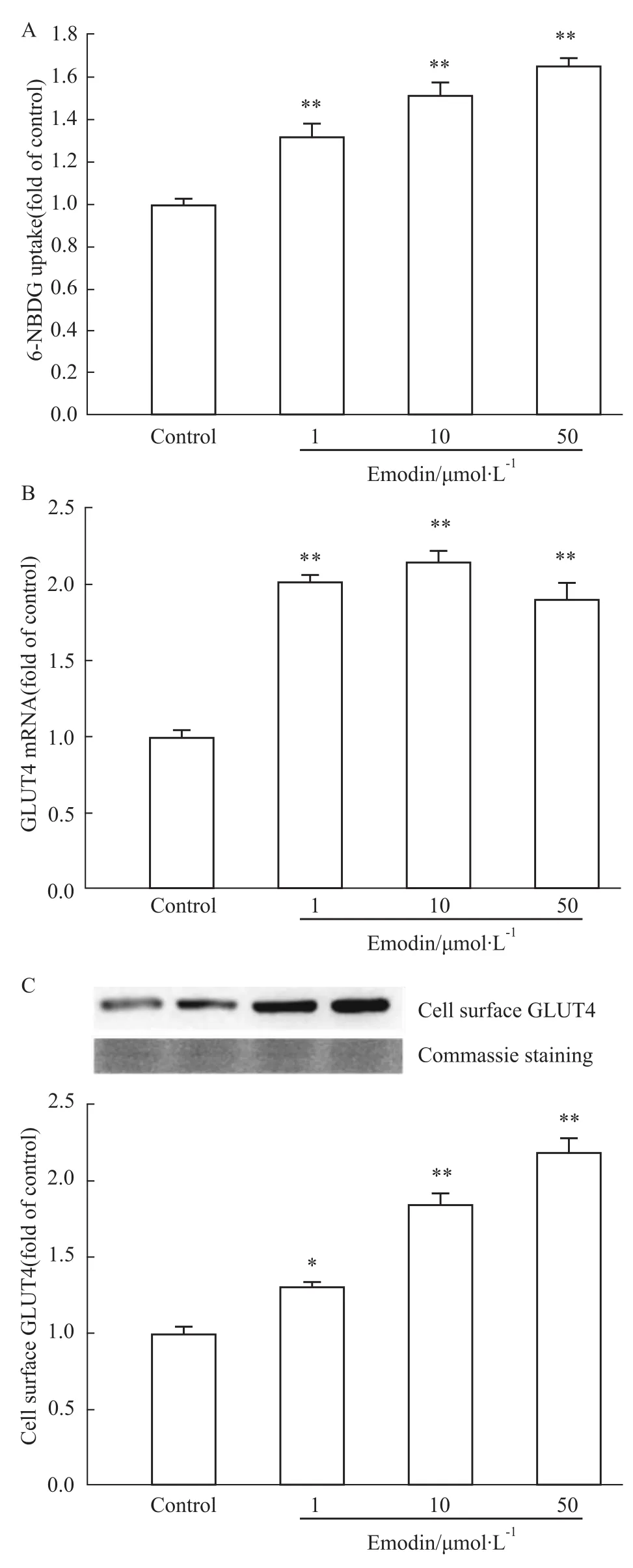
Fig 2 Emodin enhanced 6-NBDG uptake(A)and mRNA(B)and protein(C)expression of cell surface GLUT4 in 3T3-L1 adipocytes(n=3)
3.3大黄素对3T3-L1脂肪细胞Adiponectin、chREBP-α和chREBP-β的mRNA表达及IRS-1、p-IRS-1蛋白表达的影响 与Control组相比,大黄素给药组可提高3T3-L1脂肪细胞Adiponectin、chREBP-α和chREBP-β的mRNA表达(P<0.05)。同时,大黄素给药组也提高了3T3-L1细胞IRS-1蛋白磷酸化水平,且差异有显著性(P<0.05),见Fig 3。
3.4大黄素对3T3-L1脂肪细胞AMPKα1/2、p-AMPKα1/2蛋白表达的影响,及经AMPK抑制剂作用后对6-NBDG摄取的影响 与Control组相比,大黄素给药组可提高3T3-L1脂肪细胞AMPKα1/2蛋白磷酸化水平,且差异有显著性(P<0.05)。同时,与Control组相比,大黄素给药组可提高3T3-L1脂肪细胞对6-NBDG的摄取。与Emodin组相比,Compound C组降低细胞对6-NBDG的摄取,而Com-pound C+Emodin组3T3-L1脂肪细胞对6-NBDG的摄取也降低(P<0.05),见Fig 4。
3.5大黄素对3T3-L1脂肪细胞PPARγ蛋白表达的影响,及经PPARγ抑制剂作用后对6-NBDG摄取的影响 与Control组相比,大黄素给药组可提高3T3-L1脂肪细胞PPARγ蛋白表达水平,且差异有显著性(P<0.05)。同时,与Control组相比,大黄素给药组可提高3T3-L1脂肪细胞对6-NBDG的摄取。与Emodin组相比,GW9662组降低细胞对6-NBDG的摄取,而GW9662+Emodin组3T3-L1脂肪细胞对6-NBDG的摄取也降低(P<0.05),见Fig 5。
3.6大黄素对T2DM大鼠脂肪组织细胞膜GLUT4蛋白及Adiponectin的mRNA表达的影响与Control组相比,Emodin组可提高T2DM大鼠脂肪组织细胞膜上GLUT4的蛋白表达和Adiponectin 的mRNA表达,且差异有显著性(P<0.01),见Fig 6。
3.7大黄素对T2DM大鼠脂肪组织AMPKα1/2、p-AMPKα1/2的蛋白表达的影响 与Control组相比,Emodin组可提高T2DM大鼠的AMPKα1/2的蛋白磷酸化水平,且差异有显著性(P<0.01),见Fig 7。
4 讨论
脂肪细胞是全身能量与代谢的关键调节者[10]。当血糖浓度升高时,胰岛素诱导脂肪细胞摄取葡萄糖转化为脂质。T2DM患者由于肝脏、脂肪和肌肉等组织的胰岛素抵抗,导致血糖持续升高[11]。因此,增加脂肪细胞的胰岛素敏感度和葡萄糖摄取是治疗T2DM的手段之一。

Fig 3 Emodin enhanced mRNA expression of Adiponectin(A),chREBP-α(C),chREBP-β(D)and protein expression of p-IRS-1/total IRS-1(B)in 3T3-L1 adipocytes(n=3)
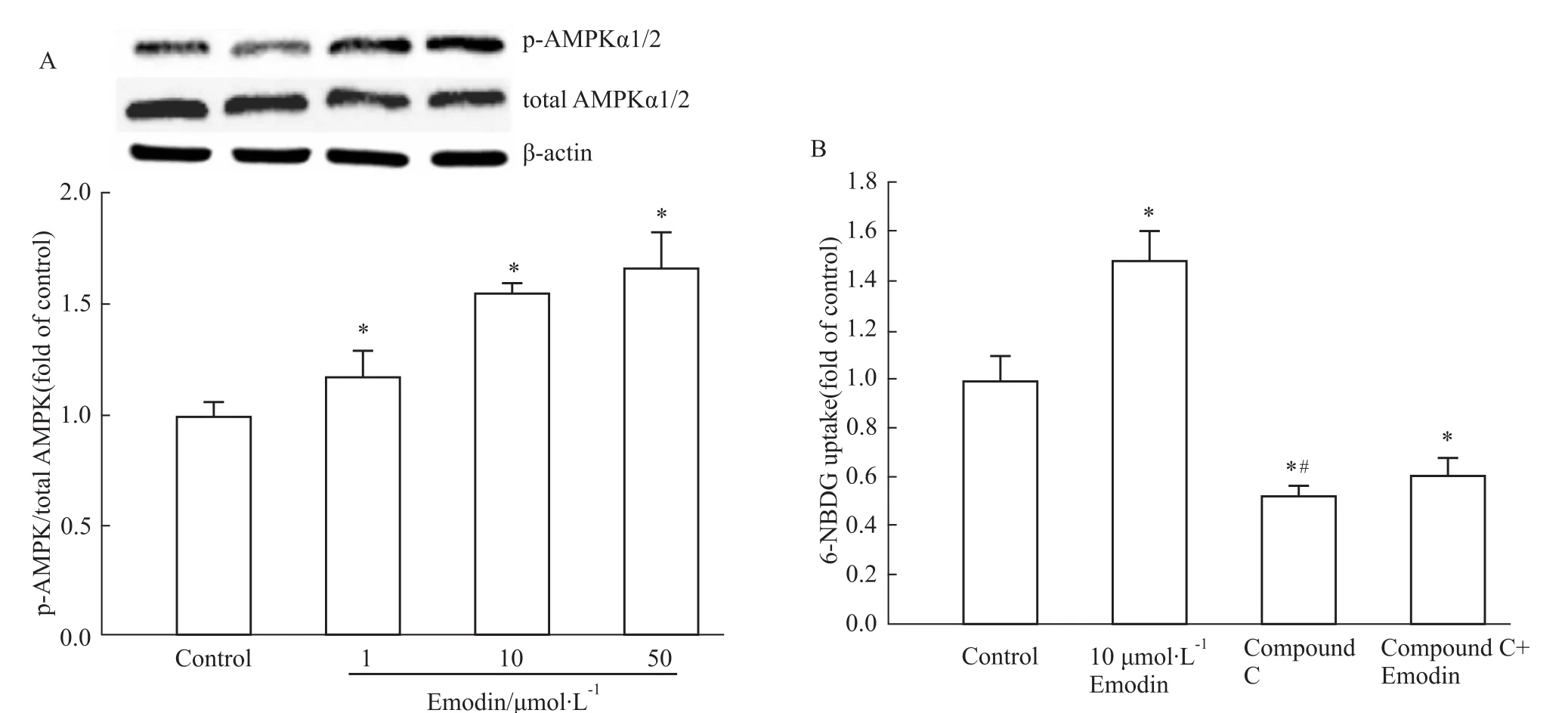
Fig 4 Emodin enhanced protein expression of p-AMPK/total AMPK(A)and enhanced 6-NBDG uptake and uptake was inhibited by compound C(B)in 3T3-L1 adipocytes(n=3)

Fig 5 Emodin enhanced protein expression of PPARγ(A)and enhanced 6-NBDG uptake and uptake was inhibited by GW9662(B)in 3T3-L1 adipocytes(n=3)
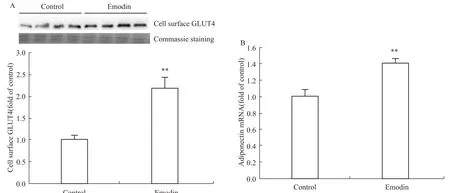
Fig 6 Emodin enhanced protein expression of cell surface GLUT4(A)and mRNA expression of Adiponectin(B)in adipose tissue of T2DM rats(n=4)
Adiponectin是内源性胰岛素增敏激素[12],IRS-1是胰岛素受体的底物之一[13],大黄素能够促进二者的表达,提示大黄素可通过激活Adiponectin和IRS-1,提高3T3-L1脂肪细胞对胰岛素的敏感度。chREBP-α和chREBP-β是体内脂肪生成和糖分解的转录调控因子[10],chREBP的激活可促进葡萄糖向脂质转化。本实验研究结果显示,大黄素的降糖作用可能通过激活脂肪细胞chREBP的转录和促进脂肪细胞表面葡萄糖转运体GLUT4的葡萄糖转运实现的。同时,大黄素可激活3T3-L1脂肪细胞AMPKα1/2和PPARγ的表达,并且经AMPK和PPARγ抑制后,大黄素对3T3-L1脂肪细胞的葡萄糖摄取作用的影响明显减弱,表明大黄素促进3T3-L1脂肪细胞对葡萄糖的摄取与AMPK和PPARγ的信号通路有关。
综上所述,大黄素可增加3T3-L1脂肪细胞的胰岛素敏感度,促进3T3-L1脂肪细胞的葡萄糖摄取功能,发挥降血糖作用,其作用机制与激活Adiponectin 及IRS-1,进而激活AMPK和PPARγ的信号通路有关。

Fig 7 Emodin enhanced protein expression of p-AMPK/total AMPK in adipose tissue of T2DM rats(n=4)
(致谢:本实验在福建省中药学重点实验室完成,感谢实验室的老师对本实验的帮助与指导。)
参考文献:
[1] 刘 晗,高 云.大黄素药理作用的分子机制研究进展[J].中国药理学通报,2009,25(12):1552-5.
[1] Liu H,Gao Y.Research progress in molecular mechanism of the pharmacological actions of emodin[J].Chin Pharmacol Bull,2009,25(12):1552-5.
[2] 张 蓉,朱榕峰,徐 俊,等.大黄素改善脂多糖引起的胰岛素抵抗机制研究[J].上海中医药杂志,2010,44(8):71-3.
[2] Zhang R,Zhu R F,Xu J,et al.Molecular mechanisms of emodin in inhibiting insulin resistance induced by lipopolysacchide[J].Shanghai J Tradit Chin Med,2010,44(8):71-3.
[3] 张喜平,李宗芳.大黄素的药理作用研究概况[J].中国药理学通报,2003,19(8):851-4.
[3] Zhang X P,Li Z F.General situation in pharmacological studies on emodin[J].Chin Pharmacol Bull,2003,19(8):851-4.
[4] Govers R.Cellular regulation of glucose uptake by glucose trans-porter GLUT4[J].Adv Clin Chem,2014,66:173-240.
[5] 葛 斌,谢梅林,顾振纶,等.AMPK作为治疗2型糖尿病新靶点的研究进展[J].中国药理学通报,2008,24(5):580-3.
[5] Ge B,Xie M L,Gu Z L,et al.AMPK acts as a new target for the treatment of type 2 diabetes[J].Chin Pharmacol Bull,2008,24 (5):580-3.
[6] Wu Z,Xie Y,Morrison R F,et al.PPARgamma induces the in-sulin-dependent glucose transporter GLUT4 in the absence of C/EBPalpha during the conversion of 3T3 fibroblasts into adipocytes [J].J Clin Invest,1998,101(1):22-32.
[7] Zhang B B,Zhou G,Li C.AMPK:an emerging drug target for diabetes and the metabolic syndrome[J].Cell Metab,2009,9 (5):407-16.
[8] 向 青,赖文芳,许 文,张小琴.大黄素对2型糖尿病大鼠脂肪组织葡萄糖转运蛋白4表达的影响[J].福建中医药大学学报,2014,24(5):22-4.
[8] Xiang Q,Lai W F,Xu W,Zhang X Q.The influences of emodin on glucose transporter type 4 indispose tissue of T2DM rats[J].J Fujian Univ TCM,2014,24(5):22-4.
[9] Lai W,Tian X,Xiang Q,et al.11β-HSD1 modulates LPS-in-duced innate immune responses in adipocytes by altering expres-sion of PTEN[J].Mol Endocrinol,2015,29(4):558-70.
[10]Herman M A,Peroni O D,Villoria J,et al.A novel ChREBP iso-form in adipose tissue regulates systemic glucose metabolism[J].Nature,2012,484(7394):333-8.
[11]Marzagalli R,Scuderi S,Drago F,et al.Emerging role of PACAP as a new potential therapeutic target in major diabetes complica-tions[J].Int J Endocrinol,2015,2015:1-11.
[12]Anusree S S,Priyanka A,Nisha V M,et al.An in vitro study re-veals the nutraceutical potential of punicic acid relevant to diabetes via enhanced GLUT4 expression and adiponectin secretion[J].Food Funct,2014,5(10):2590-601.
[13]Zheng J,Wang K,Jin P,et al.The association of adipose-derived dimethylarginine dimethylaminohydrolase-2 with insulin sensitivity in experimental type 2 diabetes mellitus[J].Acta Biochim Biophys Sin,2013,45(8):641-8.
Activation of AMPK and PPARγ by emodin influences glucose uptake in 3T3-L1 adipocytes
HONG Hai-mian,XIE Xiu-li,HONG Gui-zhu,LAI Wen-fang
(College of Pharmacy,Fujian University of Traditional Chinese Medicine,Fuzhou 350122,China)
Abstract:Aim To investigate glucose uptake effects and mechanism of emodin in 3T3-L1 adipocytes.Methods LPS-induced differentiated 3T3-L1 adipo-cytes were divided into control group and emodin(1,10,50 μmol·L-1)groups.Then,6-NBDG uptake and the expression of cell surface GLUT4,PPARγ,AMPKα1/2,p-AMPKα1/2,IRS-1,p-IRS-1,Adi-ponectin,chREBP-α and chREBP-β were detected.The ability of 6-NBDG uptake in LPS-induced 3T3-L1 adipocytes was also evaluated following interference with AMPK inhibitor and PPARγ inhibitor,respective-ly.Meanwhile,STZ-induced diabetic rats were ran-
domly divided into control group and emodin treatment group.The mRNA expression of Adiponectin and pro-tein expression of cell surface GLUT4,AMPKα1/2,p-AMPKα1/2 were measured.Results Compared with the control group,emodin improved the mRNA expres-sion of cell surface GLUT4,Adiponectin,chREBP-α and chREBP-β,and protein expression of cell surface GLUT4,PPARγ,IRS-1,p-IRS-1,AMPKα1/2 and p-AMPKα1/2 in 3T3-L1 adipocytes(P<0.05).Emodin enhanced 6-NBDG uptake and the uptake of emodin group was both decreased following interference with AMPK inhibitor and PPARγ inhibitor,respectively(P<0.05).Emodin also increased the mRNA expression of Adiponectin and protein expression of cell surface GLUT4,AMPKα1/2 and p-AMPKα1/2 in adipose tis-sue of T2DM rats(P<0.05).Conclusion Emodin can enhance glucose uptake in 3T3-L1 adipocytes and the mechanism is probably associated with activating Adiponectin and IRS-1,thereby activating AMPK and PPARγ.
Key words:emodin;type 2 diabetes mellitus;glucose uptake;3T3-L1 cells;glucose transporter type 4;AMPK;PPARγ
作者简介:洪海棉(1990-),男,硕士生,研究方向:药理学,E-mail:xwzcghappy@163.com;赖文芳(1985-),女,硕士,助理研究员,研究方向:药理学,通讯作者,E-mail:laiwenfang08@163.com
基金项目:福建省自然科学基金资助项目(No 2015J01328);福建中医药大学校管课题(No X2015013-平台)
收稿日期:2015-06-18,修回日期:2015-07-14
文献标志码:A
文章编号:1001-1978(2015)11-1569-07
doi:10.3969/j.issn.1001-1978.2015.11.018

