甾醇类新药NSC67657诱导的HL60细胞单核系分化中β-catenin/ICAT蛋白差异表达及相互作用研究
王伟佳,张秀明,胡红霞
(中山大学附属中山医院检验医学中心,广东省重点实验室,广东中山 528403)
甾醇类新药NSC67657诱导的HL60细胞单核系分化中β-catenin/ICAT蛋白差异表达及相互作用研究
王伟佳,张秀明,胡红霞
(中山大学附属中山医院检验医学中心,广东省重点实验室,广东中山 528403)
中国图书分类号:R329.2;R329.24;R394.2;R977.6
摘要:目的 分析甾醇类新药NSC67657诱导HL60细胞单核系分化中,β-catenin/ICAT蛋白的差异表达及相互作用,探讨NSC67657诱导细胞分化的作用机制。方法 应用10 μmol·L-1NSC67657诱导HL60细胞分化,采用细胞化学染色和流式细胞技术评估细胞的分化方向和分化程度;通过RT-PCR和Western blot方法验证药物作用细胞前后β-cate-nin和ICAT基因和蛋白的表达差异;采用免疫共沉淀技术分析β-catenin与ICAT蛋白的相互作用情况;采用激光共聚焦技术协同分析目的蛋白的差异表达及细胞内定位。结果
NSC67657可诱导HL60细胞向单核系分化。在10 μmol· L-1NSC67657作用5 d后,CD14的表达可达到90%以上,细胞化学染色支持细胞单核系分化结论。分化后ICAT基因和蛋白表达明显升高(P<0.01),而β-catenin基因和蛋白表达明显下降(P<0.05)。免疫共沉淀结果显示,ICAT与β-catenin蛋白在细胞分化前后都存在相互作用,药物诱导细胞分化后两者蛋白相互作用条带吸光度明显增加。激光共聚焦结果显示,ICAT蛋白和β-catenin蛋白在胞质和胞核均有荧光,药物诱导HL60细胞分化后,ICAT蛋白胞质和胞核荧光均明显增加,β-catenin蛋白在核内荧光明显减弱,但胞质荧光强度增加,有蛋白胞质转位现象。结论 NSC67657能够诱导HL60细胞向单核系分化,且引起ICAT蛋白和β-catenin蛋白的表达差异;ICAT蛋白与β-catenin蛋白的相互作用增强及β-catenin蛋白从胞核向胞质的转位现象,提示NSC67657可能通过下调并阻止β-catenin蛋白入核,从而导致HL60细胞单核系分化。
关键词:NSC67657;分化,单核系;β-catenin/ICAT蛋白;表达差异;相互作用;HL60细胞
网络出版时间:2015-10-16 9:52 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20151016.0952.028.html
NSC67657是美国癌症研究中心(National Canc- er Institute,NCI)近期报道的甾醇类新药,能够高效促进人急性髓系白血病HL60细胞向单核系分化[1]。前期研究中,课题组采用比较蛋白质组学技术,筛选了细胞分化差异表达蛋白,其中β-catenin相关蛋白1(beta-catenin-interacting protein 1,ICAT)作为Wnt信号通路的关键蛋白质分子通过质谱技术得到确认[2]。为了了解Wnt信号通路在细胞分化中的作用,本研究将对细胞分化前后ICAT蛋白及与之相关的β-连环素蛋白(β-catenin)的表达水平、相互作用及细胞内定位进行分析,对Wnt信号通路在药物诱导HL60单核系分化中的可能作用机制进行探讨。
1 材料与方法
1.1细胞系与主要试剂 人髓系白血病细胞系HL60(上海细胞库生命科学研究所);甾醇类新药NSC67657(美国癌症研究中心);细胞培养基IM-DM、胎牛血清(美国Gibco公司);RT-PCR试剂盒(大连宝生物有限公司);羊抗人ICAT多抗、兔抗人β-catenin多抗、辣根过氧化物酶标记抗羊、抗兔二抗及兔抗人β-tubulin单抗等(美国Santa Cruz公司);抗CD14及其对照抗体(深圳晶美生物工程有限公司);DAPI核荧光染料、RBITC标记抗羊二抗、FITC标记抗兔二抗(碧云天生物技术有限公司);细胞蛋白抽提纯化试剂盒(上海生物工程有限公司)。
1.2NSC67657诱导HL60细胞分化验证 收集对数生长期非药物处理HL60细胞和10 μmol·L-1的NSC67657作用5 d后的细胞,PBS洗涤3次,调节细胞浓度5×108·L-1,离心涂片,参照教材《血液学检验试验指导》[3]分别对药物作用前后细胞进行瑞氏染色、酯酶染色及NaF抑制试验,观察细胞形态。同样取对数生长期HL60细胞,加入NSC67657诱导细胞分化,采用流式细胞技术检测细胞表面分化抗原CD14的表达情况。对照组除未加药物其余与处理组相同。
1.3NSC67657诱导HL60细胞分化中ICAT与β-catenin基因和蛋白的表达情况 收集对数生长期HL60细胞,调整细胞浓度为1×109·L-1,采用
10μmol·L-1的NSC67657作用HL60细胞,对照组除未加NSC67657外其余与处理组相同。处理组与对照组在37℃、5%CO2条件下培养5 d,提取细胞总RNA,逆转录后经过30个循环扩增。产物经0.15 g·L-1琼脂糖凝胶电泳,在Bio-Rad凝胶成像仪上观察并分析光密度。引物设计如下:β-catenin正义5′-CTGCAGGGGTCCTCTGTG-3′,反义5′-TG-CATATGTCGCCACACC-3′;ICAT正义5′-GGGAAT-TCATGAACCGCGAGGGAGCAC-3′,反义5′-GGG-GATCCCAGCTACTGCCTCCG GTCTTCCGTCTC-3′。
同样收集对照组与处理组细胞,用细胞裂解液裂解,提取总蛋白,Bradford法进行蛋白定量。取60 μg蛋白进行16%SDS-PAGE凝胶电泳,然后转膜、封闭、加入抗体孵育。化学发光法显色,于Bio-Rad凝胶仪上成像并进行密度分析。
1.4采用免疫共沉淀(Co-IP)分析ICAT蛋白与β-catenin蛋白之间的相互作用 收集非处理和NSC67657作用5 d后的HL60细胞,加入细胞裂解液和细胞蛋白酶抑制剂PMSF,待细胞充分裂解后加入8 μg抗β-catenin抗体,4℃缓慢摇晃孵育过夜;取100 μL protein A琼脂糖珠,将protein A琼脂糖珠加入到和抗体孵育过夜的细胞裂解液中,4℃缓慢摇晃孵育2~4 h,使抗体与protein A琼脂糖珠偶连;免疫沉淀反应后,低温条件离心吸去上清,裂解缓洗涤;最后加入2×SDS上样缓冲液,沸水煮5 min,离心后取上清;采用抗ICAT抗体,依据上述Western blot方法确定结合蛋白。采用结肠癌SW480细胞蛋白做为阳性对照。
1.5激光共聚焦分析药物作用HL60细胞前后ICAT与β-catenin蛋白的表达与定位 分别收集非处理和NSC67657作用5 d后的HL60细胞,冷丙酮固定30 min,经过150 mL·L-1小牛血清封闭,PBS洗涤后,孵育不同种属来源一抗,4℃过夜。再次洗涤后,先后滴加RBITC标记和FITC标记且针对不同种属的二抗和DAPI染料,分别孵育30 min 和3 min,激光共聚焦显微镜观察。
1.6统计学分析 结果通过统计软件SPSS 11.5分析。均值间比较使用t检验,药物处理前后ICAT 与β-catenin表达比较采用配对t检验。
2 结果
2.1NSC67657诱导HL60细胞单核系分化验证HL60细胞在NSC67657作用下增殖明显受抑,瑞氏染色中,对照组HL-60细胞仍处于幼稚原始状态,处理组可见明显的单核系分化的细胞,如Fig 1A、B所示。酯酶染色中,对照组HL60细胞酯酶染色阳性,但不会被NaF抑制,NSC67657处理组NaF抑制率>50%,如Fig 1C、D所示。对照组CD14+细胞小于2%,药物处理组CD14+细胞大于90%,如Fig 1E、F所示。以上结果提示NSC67657已诱导HL60细胞完全分化。

Fig 1 Verification of HL60 cellular differentiation when induced by NSC67657
2.2NSC67657诱导HL60细胞分化前后ICAT/β-catenin差异表达分析 NSC67657作用HL60细胞5 d后,可见ICAT基因表达增加(P<0.01),蛋白水平也相应增加(P<0.01),如Fig 2A、B所示。反之,β-catenin基因表达下调(P<0.05),蛋白水平也相应下调(P<0.05),如Fig 2C、D所示。
2.3药物诱导细胞分化前后ICAT蛋白与β-cate-nin蛋白之间相互作用确认 本实验采用β-catenin一抗包被琼脂糖珠,与之结合的ICAT蛋白被顺利检测,非药物处理组与NSC67657诱导分化组样本的上清液中均检测到ICAT蛋白,提示该实验样本有ICAT蛋白的表达;Co-IP实验显示NSC67657处理
组ICAT蛋白条带吸光度明显高于非处理组,不仅验证了β-catenin/ICAT蛋白存在相互作用,还提示药物处理后ICAT蛋白与β-catenin蛋白相互作用有增强的趋势,如Fig 3所示。
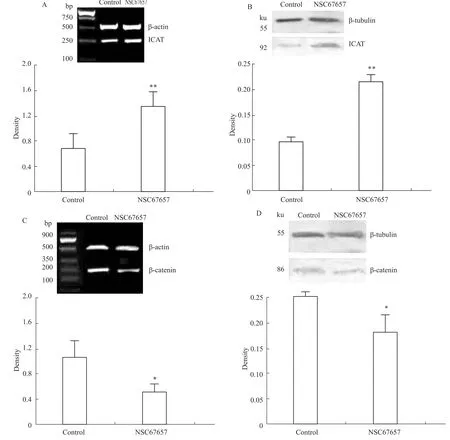
Fig 2 Differential expression of ICAT/β-catenin in HL60 cells when treated or not treated by NSC67657
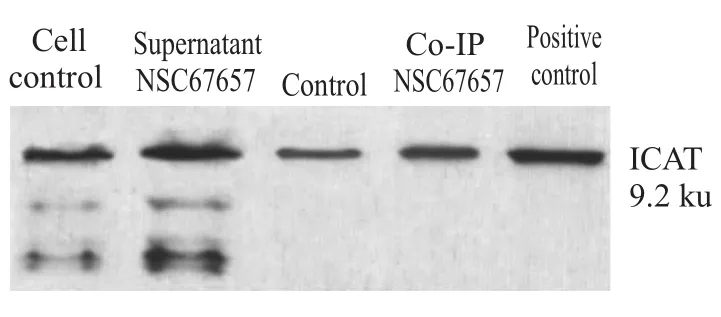
Fig 3 Protein interaction between ICAT and β-catenin in HL60 cells when treated or not treated by NSC67657
2.4激光共聚焦检测ICAT/β-catenin蛋白在细胞内表达差异及细胞内定位 实验结果显示,NSC67657作用HL60细胞后,ICAT蛋白(红色标记)荧光强度明显增加,细胞核内及胞质中均现荧光增强趋势;相比之下,β-catenin蛋白(绿色荧光)荧光强度下降,尤其是细胞核内荧光明显减弱,而胞质荧光强度增加,呈现荧光胞质转位现象,提示β-catenin蛋白在药物作用后可能入核减少,如Fig 4
所示。

Fig 4 Pictures from laser confocal microscopy to analyze the expression and intracellular location ofICAT/β-catenin proteins
3 讨论
Wnt信号通路是一个复杂的蛋白质作用网络,其功能常见于胚胎发育期和癌症,但也参与成年动物的正常生理。Wnt信号通路是细胞增殖分化的关键调节环节,参与了基因表达调节、细胞的迁移黏附、细胞极化等过程,同时还与其他信号通路存在交叉协同,参与干细胞的更新和分化[4]。其经典的激活途径是游离的β-catenin进入细胞核与辅转录因子LEF/TCF结合,调节下游基因如cyclin D1[5]、c-Myc[6]、PPARδ[7]、Tcf-1[8]和CD44[9]等的表达,这些基因的激活在细胞的增殖、分化以及恶性转变中都发挥重要作用[10]。整个通路存在内在平衡,一旦平衡打破,就可能成为肿瘤发生的重要诱因。ICAT蛋白是Wnt信号通路的重要调节因子,其可以与LEF/ TCF竞争性地结合β-catenin蛋白,从而抑制下游靶点激活[11]。虽然这些假说在其他研究中已经得到证实,但NSC67657是否通过这条通路诱导HL60细胞单核系分化仍需进一步确认。
本研究验证了HL60细胞单核系分化后ICAT基因和蛋白的表达上调,β-catenin基因和蛋白的表达下调,提示药物可能通过诱导ICAT的表达升高,从而干预β-catenin与LEF/TCF的结合及下游靶点的激活。免疫共沉淀结果显示,ICAT蛋白与β-cate-nin蛋白确实在细胞分化前后存在相互作用,且在药物诱导细胞分化后作用增强,可能与ICAT蛋白高表达有关,但不能解释β-catenin蛋白低表达的现象。激光共聚焦结果显示,NSC67657诱导HL60细胞单核系分化后,ICAT蛋白在细胞核和胞质均表达升高,β-catenin蛋白反之下降。有趣的是,β-catenin蛋白不但整体荧光减弱,还出现蛋白向胞质转位趋势,这与Rhee等报道结果对应。Rhee等[12]将10株头颈部鳞状细胞癌细胞株与正常口腔上皮细胞进行比较,结果显示Wnt10的水平在前者明显增加。并且发现19个Wnt家族成员的11个在头颈部鳞状细胞癌细胞株中高表达,同时表达Wnt的癌细胞胞质中β-catenin水平增高,并向胞核移位,提示了鳞状细胞癌细胞的生长和存活与Wnt信号通路的相关性。虽然白血病细胞与颈部鳞状癌细胞属于不同种属,但能为Wnt信号通路在肿瘤发病机制的研究提供借鉴。
本研究首次报道了甾醇类新药NSC67657诱导HL60细胞分化的可能机制,作为高效诱导剂,其分子机制的深入研究将为后期化疗药物的开发及靶向治疗提供理论依据和实验基础。该研究仅为Wnt通路对分化作用的初步探讨,其下游靶基因的变化趋势,及ICAT蛋白受到抑制或Wnt信号通路受到激活的情况下,细胞是否仍然会被药物诱导等一系列问题将是本课题组后续的研究重点。
参考文献:
[1] Wang W J,Zhang X M,Deng K Y,et al.ICAT as a potential en-hancer of monocytic differentiation:implications from the compara-tive proteome analysis of the HL60 cell line stimulated by all-trans retinoic acid and NSC67657[J].Cell Biochem Funct,2009,27 (6):329-37.
[2] 王伟佳,唐 薇,毛小琴,等.甲磺酸甾醇类药物诱导HL60细胞分化及其蛋白质组表达差异的研究[J].中国药理学通报,2008,24(12):1634-9.
[2] Wang W J,Tang W,Mao X Q,et al.A analysis of the proteome of HL60 cell line induced by a new steroidal drug as a monocytic in-ducer[J].Chin Pharmacol Bull,2008,24(12):1634-9.
[3] 陈宏础.骨髓细胞检查[M]//叶应妩,王毓三,申子瑜.全国临床检验操作规程(第3版).南京:东南大学出版社,2006:145-62.
[3] Chen H C.Bone Marrow Examination[M]//Ye Y W,Wang Y S,Shen Z Y.National Guide to Clinical Laboratory Procedures,3rd ed.Nanjing:Southeast University Publishing Company,2006:145-62.
[4] 杨秋臖,周龙洋,刘映孜,等.小檗碱抑制HCT116细胞生长与Wnt/β-catenin信号的关系研究[J].中国药理学通报,2012,28 (9):1234-8.
[4] Yang Q J,Zhou L Y,Liu Y Z,et al.Study on the correlation be-tween the anti-proliferation effect of berberine on HCT116 cells and Wnt/β-catenin siagnaling[J].Chin Pharmacol Bull,2012,28(9):1234-8.
[5] Clement G Y,Paul B T.Modulation of p53,c-fos,RARE,cyclin A,and cyclin D1 expression in human leukemia(HL-60)cells exposed to arsenic trioxide[J].Mol Cell Biochem,2009,331(1):207-14.
[6] Kwang B L,Shuai Y,Man H P,et al.p63-Mediated activation of the β-catenin/c-Myc signaling pathway stimulates esophageal squamous carcinoma cell invasion and metastasis[J].Cancer Lett,2014,353(1):124-32.
[7] Francesca B,Claudia B,Sebastiano C,et al.Antiproliferative effect of conjugated linoleic acid in caco-2 cells:involvement of PPARγ and APC/β-catenin pathways[J].Chem Biol Int,2007,169(2):110-21.
[8] Pramanik K C,Fofaria N M,Gupta P,et al.Inhibition of β-cate-nin signaling suppresses pancreatic tumor growth by disrupting nu-clear β-catenin/TCF-1 complex:critical role of STAT-3[J].On-cotarget,2015,6(13):11561-74.
[9] Kamazani F M,Bahoush-Mehdiabadi G,Aghaeipour M,et al.The expression and prognostic impact of CD95 death receptor and CD20,CD34 and CD44 differentiation markers in pediatric acute lymphoblastic leukemia[J].Iranian J Pediat,2014,24(4):371 -80.
[10]Behrens J.Control of β-catenin signaling in tumor development [J].Ann NY Acad Sci,2000,910(1):21-33.
[11]Tago K,Nakamura T,Nishita M,et al.Inhibition of Wnt signa-ling by ICAT,a novel beta-catenin-interacting protein[J].Genes Dev,2000,14(14):1741-9.
[12]Rhee C S,Sen M,Lu D,et al.Wnt and frizzled receptors as po-tential targets for immunotherapy in head and neck squamous cell carcinomas[J].Oncogene,2002,21(43):6598-605.
Differential expression and interaction of β-catenin/ICAT proteins in NSC67657 induced monocytic differentiation of HL60 cells
WANG Wei-jia,ZHANG Xiu-ming,HU Hong-xia
(Dept of Laboratory Medicine,Key Laboratory of Guangdong Province,Sun Yat-sun University Affiliated Zhongshan Hospital,Zhongshan Guangdong 528403,China)
Abstract:Aim To analyze differential expression and interaction of β-catenin/ICAT proteins in HL60 cells when they were induced into monocytic differentiation,and to figure out the mechanism of NSC67657 in cellu-lar induction.Methods HL60 cells were treated by 10 μmol·L-1NSC67657,and cellular differentiation could be observed by cytochemical staining and flow cytometry.Then,RT-PCR and Western blot were em-ployed to determine the differential expression of β-catenin/ICAT genes and proteins.Co-immunoprecipi-tation assay was used to confirm the interaction of β-catenin/ICAT proteins,and laser co-focus light mi-croscopy technology was used to co-indentify proteins differential expression and intracellular location.Re-sults HL60 cells could be induced into monocytic dif-ferentiation after 5 days treatment using 10μM NSC67657.The CD14(+)%cells could be up to o-ver 90%,and cytochemical staining reports were con-sistent with this result.The expressions of ICAT gene and protein were up-regulated significantly(P< 0.01),but the expressions of β-catenin gene and pro-tein,on the contrary,were down-regulated(P<0.05)when HL60 cells were induced into monocytic differen-tiation.From co-immunoprecipitation assay findings,ICAT protein interacted with β-catenin protein,and the absorbance of protein electrophoresis bands in-creased in differentiated cells.From laser co-focus light microscopy assay findings,the fluorescence of ICAT and β-catenin protein could be both observed in cytoplasm and nucleus.In drug treated HL60 cells,the fluorescence of ICAT protein was enhanced both in cytoplasm and nucleus,however,the fluorescence ofβ-catenin protein,which looked like transferring into different organelles,decreased significantly in nucleus,but increased in cytoplasm.Conclusions HL60 cells could be induced into monocytic differentiation by NSC67657 and β-catenin/ICAT proteins differentially expressed during cellular differentiation.The enhanced interaction of β-catenin/ICAT proteins and β-catenin protein transferring from nucleus into cytoplasm indi-
cates that NSC67657 probably induces HL60 cells into monocytic differentiation through down-regulating β-catenin protein and blocking β-catenin protein from nu-cleus.
Key words:NSC67657;monocytic differentiation;β-catenin/ICAT proteins;differential expression;inter-action;HL60 cells
作者简介:王伟佳(1981-),男,博士后,研究方向:白血病化疗新药的开发与应用,E-mail:xuelangchichao@163.com;张秀明(1964-),男,硕士,教授,研究方向:蛋白质组学技术在新药开发研究中的应用,通讯作者,E-mail:snow-touching@hotmail.com
基金项目:国家自然科学基金资助项目(No 81301492)
收稿日期:2015-07-29,修回日期:2015-08-26
文献标志码:A
文章编号:1001-1978(2015)11-1547-06
doi:10.3969/j.issn.1001-1978.2015.11.014

