凋亡通路及caspases在阿尔茨海默病中作为治疗靶点的研究
吴文宝,孔庆宏,阚祥绪,王冠林,张宽仁
(昆明理工大学生命科学与技术学院,云南昆明 650500)
凋亡通路及caspases在阿尔茨海默病中作为治疗靶点的研究
吴文宝,孔庆宏,阚祥绪,王冠林,张宽仁
(昆明理工大学生命科学与技术学院,云南昆明 650500)
中国图书分类号:R329.25;R745.702.2;R745.705
摘要:阿尔茨海默病(Alzheimer′s disease,AD)是一种神经退行性疾病。根据近年来的研究,AD的可能致病因素主要是由tau、APP以及Aβ引起神经元退化以及神经细胞凋亡。tau经caspases切割后会发生聚集,进而发生神经纤维缠结使神经元退化及死亡。细胞凋亡途径都需要caspases的活化,并且是凋亡的启动者、执行者。APP经β-、γ-分泌酶作用产生sAPPβ、Aβ40/42,其中Aβ42经DR4/5激活下游凋亡信号以及经caspase切割形成的C31片段,可促进细胞凋亡。sAPPβ水解后产生的N-APP可经DR6促进神经元的异常发展,但水解位点及机制并不清楚。其中,caspase可以通过作用于γ-分泌酶激活蛋白调节Aβ40/42以及C31的生成,进而影响AD的发生。目前关于AD的治疗还没有针对caspase的药物。在这篇综述中,我们就神经细胞凋亡机制及其通路中caspases在AD发生过程中的相关作用进行阐明,为药物研发以及临床治疗提供一些可能的治疗靶点。
关键词:caspase;阿尔茨海默病;tau;Aβ;细胞凋亡;治疗靶点;治疗药物
网络出版时间:2015-10-16 9:52 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20151016.0952.010.html
阿尔茨海默病(Alzheimer′s disease,AD)是以于1906年的第一例被诊断为早老性痴呆症患者Alois Alzheimer而命名。简单来说,它是一种让人只有短时记忆、使日常生活困难、脱离社会的一种疾病,表现在记忆力衰退、语言功能降低及注意力分散。在未来十几年内,有10%的老年人中将会患AD,那时AD将会成为全社会的健康焦点。美国联邦调查显示年龄在85岁左右的老年人,其中有50%正在面临AD的侵袭[1]。但是AD并不是完全年龄依赖的疾病。事实上AD有两种类型,其一是家族遗传性的(familial Alzheimers disease,fAD),这种类型的AD临床上会出现在非常年轻的人群中,大约占总AD的25%。另一种是散发性的(spo-radic Alzheimer′s disease,sAD),这是一种大多数AD病例的类型,它是由基因或者是环境因素造成的[2]。AD主要是由两个因素引起的疾病:一是神经纤维缠结(neurofibrillary tan-
gle,NFT),主要由tau蛋白引起的;另一种是由β-淀粉样蛋白(amyloid protein β,Aβ)引起的,使大脑细胞外产生老年斑和脑血管淀粉样变性[3]。目前认为主要由这两种因素导致神经元退化或死亡,促使AD的发生。
细胞凋亡(apoptosis)是生物体发育过程中普遍存在的,是一个由基因决定的细胞主动的有序的死亡方式。而凋亡的主要执行者是caspase(cystine containing aspirate specific protease)家族,即半胱氨酸的天冬氨酸特异蛋白水解酶。caspase可分为三大类型,即启动型、效应型、炎症型。其中启动型的caspase包括-2/-8/-9/-10,即凋亡的启动蛋白,通过其自身的活化启动下游的效应caspase包括-3/-6/-7执行凋亡。死亡受体家族的成员包括Fas、肿瘤坏死因子受体1(tumor necrosis factor receptor type 1,TNFR1)、肿瘤坏死因子相关凋亡诱导配体(tumor necrosis factor-related apoptosis-inducing ligand,TRAIL)相关的死亡受体4和5 (death receptor 4/5,TRAIL receptor 1/2,DR4/5)、DR3、DR6 和p75/神经生长因子受体(nerve growth factor receptor,NG-FR)。Fossati等[4]在其实验中证明了脑微血管内皮细胞的凋亡是由低聚Aβ引起的,并通过DR4和DR5的细胞凋亡机制提出了通过它们活化而触发凋亡信号的见解,并通过DR4和DR5的RNA干扰验证了其在Aβ介导细胞凋亡活化中的作用。TRAIL的信号转导共有两种途径,外源性凋亡途径(又称死亡受体凋亡途径)和内源性凋亡途径(又称线粒体凋亡途径)[5]。当procaspase-8激活不充分时,主要通过线粒体途径来执行凋亡通路。若procaspase-8被抑制,那么凋亡信号将不能传导下去。TRAIL通过与细胞膜上相应死亡受体结合从而使受体胞质内的死亡域彼此靠近、聚集,促使胞质内的caspase发生级联反应,从而导致细胞凋亡。本文就caspase在AD的发生过程中的相关作用进行阐明,期望找到AD治疗的新靶点。
目前,对于AD治疗的方案主要是以神经递质机能障碍物为靶点、tau蛋白为靶点、减少淀粉样蛋白的产生(即分泌酶的抑制剂)、免疫治疗、抗Aβ聚集、增强Aβ清除的药物以及其他药物的发现。部分药物已进入临床或临床试验阶段,也有在临床Ⅲ期失败的,其中各有利弊。目前的药物研究仅仅局限于tau和Aβ的相关研究,但是两种病因只局限于一点是否能有效治疗AD,这还没有定论。而且目前大多数的药物研究集中在Aβ的清除及以Aβ为靶点的治疗。目前还没有以caspases作为AD治疗靶点的药物研究(Tab 1),鉴于下文述及caspases与tau和Aβ都有直接的相互作用以及信号转导方面的联系,或许我们可以直接针对caspases作为AD治疗的靶点,可以直接调节tau和Aβ,这将会是一种可行的治疗或联用方案。
1 caspases调控tau及在病理过程中的作用

Tab 1 Medicine targets AD in recent years
微管系统是神经细胞骨架成分,可参与多种细胞功能。微管由微管蛋白及微管相关蛋白组成,tau蛋白是含量最高的微管相关蛋白。正常脑组织中tau蛋白在细胞内的功能是与微管蛋白结合,促进其聚合形成微管。tau蛋白与形成的微管结合,维持微管稳定性,降低微管蛋白分子的解离,并诱导微管成束。tau蛋白会受到异常超磷酸化和一些修饰,如硝基化、泛素化、移位、脯氨酰异构化、切割等可以减少其与微管的结合,不仅如此,还可以引起tau蛋白的聚集以及与其他大分子的结合[6-8]。tau蛋白的错误定位和积聚于树突和树突棘上破坏了神经细胞之间的信号传导,这是导致神经退行性病变和记忆丧失的主要原因[9]。近期AD研究治疗的热点即针对tau蛋白,主要在这3种类型的分子上。第一,蛋白激酶和磷酸酶的抑制剂修饰tau,这样可以控制神经元的退化;第二,亚甲蓝可能作为tau蛋白聚合的抑制剂;第三,天然植物复合物和多酚类化合物可以抑制tau蛋白纤丝片段的形成,并分解这些片段[10-14]。
1.1caspase-3与tau caspase-3是细胞凋亡的执行者,被称为“死亡蛋白酶”。它需要上游凋亡信号的激活,如caspase-2、caspase-8、caspase-9、caspase-10,使procaspase-3裂解失去前结构域形成caspase-3,从而被活化。在caspase-3
活化后,通过裂解与DNA修复相关的分子、灭活凋亡抑制物、酶解细胞外基质以及骨架蛋白等使细胞裂解死亡。caspase-3不仅在凋亡中担任重要角色,在成年大脑中可以调节神经突触功能,促进中枢神经系统的发育以及一些记忆的形成,常常在老年大脑中却担任不一样的作用。那它在AD中担任什么样的角色呢?其一是凋亡的执行者,tau在被过度磷酸化后会被切短,经caspase-3的凋亡途径引起细胞的凋亡[15]。很多的研究者认为神经细胞的死亡是AD发生的主要原因,但就神经细胞死亡的方式是否是典型的细胞凋亡,这一点还存在争论。Fossati等[4]证明了Aβ确实是通过凋亡途径引起神经细胞死亡,即经DR4/5引起的细胞凋亡。在tau引起的神经细胞死亡的过程中也观察到了凋亡的特征,如细胞萎缩、核质浓缩、DNA的片段化等。更有趣的是在人源细胞中表达切割后的tau蛋白会引起caspase-9的活化,即产生p37亚基。在内源性凋亡的通路上,caspase-3活化是经过caspase-9激活的,而caspase-9的活化又由上游的细胞色素C(cytochrome-C,Cyt-C)来激活。所以我们可以认为tau蛋白引起的神经细胞凋亡可能是通过内源性凋亡途径,但又和内源性凋亡途径相异,它是一种与caspase-3相关的凋亡类似的细胞死亡方式,或称为tau凋亡(tauoptosis)(Fig 1B)。被切割的tau蛋白在AD的大脑中广泛存在,并且在神经元的死亡中担任主要的角色[15]。其二,caspase-3 在tau蛋白的切割过程中可能还存在另外一种功能,即可能介导了tau在Asp421的切割,由caspase介导的在Asp421切割得到的tau蛋白会增加其聚集性,并促进其聚集[16]。这就提示我们,若是抑制了caspase-3的活性,可以在两条通路上延缓或治疗AD。现在已经得到证实,在caspase-3的活性被QVD-OPH(caspase的抑制剂)抑制后可以阻止tau的异常磷酸化,因为caspase的活化是使tau过度磷酸化的生化标志,其中多肽药物的候选药物NAP(NAPVSIPQ)已经在分子生物学的水平证明了,NAP降低caspase-3活性的同时降低tau过度磷酸化的程度[10]。所以把caspase-3作为治疗AD的靶点是可行的,这一推论已得到Rohn的证实[17]。
1.2caspase-6与tau caspase-6与caspase-3一样,也是细胞凋亡的执行者,在AD中的作用与caspase-3类似,但又有所不同。在AD中caspase-3不仅仅作为tau蛋白的切割者,又作为细胞凋亡的执行者。而在进一步的分析中发现,神经元缠结的起始并不一定需要caspase的活化,可caspase的活化却是tau蛋白聚集的一种可能机制[18]。然而caspase-6在大脑中的活化被认为是AD发生早期的生化标志物,因为大脑中的caspase-6活化可以切割tau蛋白,且切割位置在Asp421,与caspase-3是一种协同作用[19-20]。这也是一种AD病因,即tau蛋白切割后的聚集。后来证实caspase-6还可以介导tau蛋白在D13、D402位的切割(Fig 1A)。这也提示我们,caspase-6在tau蛋白的相关生物过程中担任着很重要的角色,若针对其来调节tau的相关过程也是可行的,从而达到治疗AD的目的。
2 caspases调控Aβ以及与APP的联系
Aβ是源于β淀粉样前体蛋白(amyloid precursor pro- tein,APP)。在生理条件下,少数APP在胞质溶酶体经β-分泌酶和γ-分泌酶的作用,最终裂解为Aβ[21](Fig 2)。Aβ有两种存在形式,Aβ40和Aβ42,两者仅氨基酸数量上差两个。其中Aβ42易聚集,具有较强的细胞毒性。脑微血管内皮细胞(endothelial cells,EC)与动脉中Aβ变体是通过细胞形态的改变,DNA的片段化,线粒体细胞色素C释放到细胞质中和磷脂酰丝氨酸膜上膜联蛋白V阳性荧光的转移而触发凋亡级联反应[4,22]。
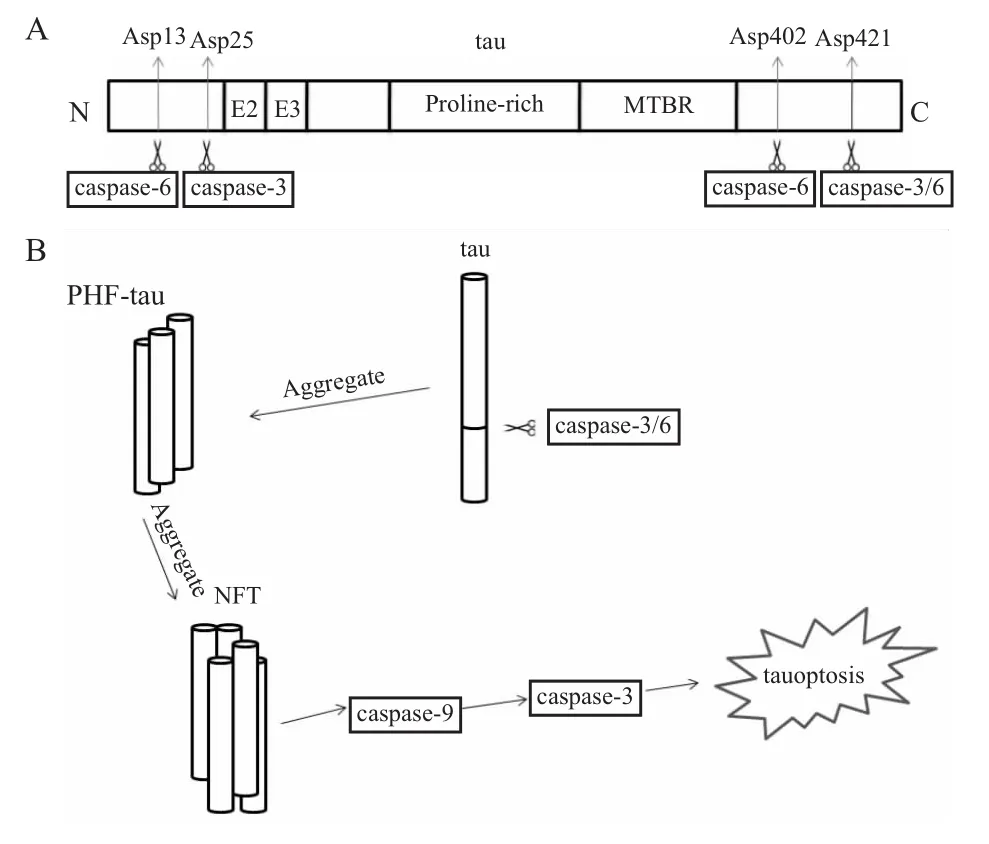
Fig 1 Tau truncation sites produced by caspases,and the progress of tau aggregation and tauoptosis
Fossati等[4]通过通路特异性PCR(pathway-specific,PCR)证实了EC中的AβE22Q引起凋亡相关基因的差异性表达,筛选出一部分细胞质凋亡介体。在这些基因中他们发现了一些受体基因,如TNFRSF10A(TNF超家族成员10A,或称为DR4/TRAILR1)、TNFRSF10B(TNF超家族成员10B,或称为DR5/TRAILR2),是典型的基于TRAIL/TNFSF10激活的。并且TRAIL受体DR4/5在大脑以及微血管细胞中也有表达[23-24]。用不同的Aβ变体来刺激EC,在不同时间内可观察到DR4/5的表达均有上调,用免疫细胞化学和激光共聚焦显微镜观察并确认了Aβ与DR4和DR5过表达共存。并且还通过体外实验免疫共沉淀以及DR4/5的基因干扰做了进一步的确认,证明Aβ是通过死亡受体DR4/5引起神经细胞死亡。既然如此,我们推测Aβ与caspase家族可能存在某种密切的联系,或许可以在这种联系中找到治疗AD的方案。
2.1caspase-3与APP以及γ-分泌酶 淀粉样前体蛋白(APP)是广泛存在于全身组织细胞膜上的I型跨膜糖蛋白,Aβ是由APP水解产生的β片层结构的多肽。APP的代谢途径有两种(Fig 2),参与代谢途径共有3种分泌酶,分别是
α-分泌酶、β-分泌酶和γ-分泌酶。APP经β-分泌酶、γ-分泌酶切割后,最终产生Aβ40和Aβ42,其中Aβ42具有疏水性易聚集,具有较强的细胞毒性,是淀粉样斑块形成的主要成分。

Fig 2 APP and intracellular signaling pathway
但γ-分泌酶的功能又与何种蛋白相关呢?Chu等[25]发现γ-分泌酶激活蛋白(γ-secretase-activating protein,GSAP)的生物合成和Aβ的形成与caspase-3密切相关。γ-分泌酶是一种高分子质量的多亚基复合体,分子质量约为250 ku,可切割各种I型跨膜糖蛋白,如APP、Notch等,酶切位点位于底物跨膜片段中。GSAP能选择性增加Aβ的生成,主要是GSAP与γ-分泌酶及其底物APP的C末端(APP-CTF)的相互作用。他们通过RNA干扰技术、共聚焦定位以及分子生物学手段证明,GSAP的产生与caspase-3密切相关,而与caspase-7无明显相关性。在两种AD小鼠模型Tg2576、3xTg中,通过caspase-3的抑制剂z-DEVD-fmk[26]的作用,caspase-3、GSAP-16 ku以及Aβ明显降低,对其他相关蛋白的表达并无明显影响,如GSAP-FL、procaspase-3、procaspase-7、caspase-7、TMP21以及CD147。证明了caspase-3对GSAP以及Aβ是有明显影响的。caspase-3不仅仅作为细胞凋亡的一个执行者,在AD小鼠模型中caspase-3对突触功能调节也具有很重要的功能[27]。GSAP作为一种独立内源性调节蛋白,是调节γ-分泌酶对APP裂解产生Aβ的关键蛋白,而GASP又受caspase-3的调节(Fig 2)。基于这种新的功能,caspase-3作为降低Aβ产生的治疗靶点是可行的,因为caspase-3的抑制不影响γ-分泌酶的功能[25,28],可通过调节GSAP来调节γ-分泌酶的生成量,进而达到降低Aβ的产生,从而减少AD发生的几率。
2.2caspase-6与APP APP的生理功能现在还不清楚,但已经有证据证明它与神经细胞的存活、轴突的生长、突触的生长以及细胞黏附有关。大脑中大量存在APP695,主要由神经元分泌。APP在细胞膜外的部分被α-分泌酶切割后产生sAPPα,这是很多类型细胞的生长因子,并且可以促进突触的生长以及神经元的有丝分裂[29],所以促进α-分泌酶的生成也可以达到治疗AD的目的。APP还会被β-分泌酶、γ-分泌酶以及caspases切割产生4种促凋亡蛋白:sAPPβ、Aβ、Jcasp、C31。C31和Jcasp是APP被caspases在C端切割后产生的片段,因C31的毒性较强所以被关注,而Jcasp的毒性较低[30]。caspase-6在APP上有2个切割位点653位和664位,并且在体外实验已经证明了这2个切割位点[31]。664位就是产生C31片段。另外,caspase-3/-8也会在APP664发生切割[32](Fig 2)。在AD模型中,如AD的脑组织、细胞模型以及转基因小鼠中,发现APP的Asp664位是AD发生过程中具有决定性的切割。caspases切割产生的C31是人工培养的神经母细胞瘤细胞的一种非常强的凋亡激动剂。C31与Smac/Diablo的作用相似,可通过与凋亡抑制家族IAPs结合,并抑制IAPs激活经典凋亡途径[33](Fig 2)。在AD中,APP是经DR6受体由外源性凋亡途径引起凋亡。APP经β-和γ-分泌酶作用生成Aβ及sAPPβ,sAPPβ被水解产生的N端片段N-APP可与DR6结合,活化后的DR6募集caspase-6并使其活化以及导致轴突的退化[34]。caspase-6在轴突退化的地位经体外实验得到证实,在神经营养因子缺失后,它的活化可使神经元和轴突退化[35-36]。而且病理学上轴突的退化是AD发生至关重要的事件,针对这些结论,caspase-6被抑制或增加神经营养因子作为神经元退化的治疗方案是可行的。
3 结语与展望
caspase在不同的器官及细胞中担任着相同但又不同的角色。一方面承担着凋亡启动及执行者的角色,另一方面又在凋亡配体的前修饰起着一定的作用。例如,caspase切割tau使其聚集引起tau凋亡,这一过程需要caspase的活化,凋亡的发生也需要caspase的活化,这在AD发生中较为常见。比如C31的产生与caspase相关,其又可抑制凋亡抑制家族IAPs,即间接的激活凋亡执行者caspase-3/-6/-7;而Aβ引起的细胞凋亡也需要caspase的活化。综上,在目前认为引起AD发生的两个重要病因中,caspase担任着非常重要的角色。caspase是比较关键的调节及功能蛋白,对APP以及γ-分泌酶激活蛋白也有相应的作用,促进神经元的退化及凋亡。
Aβ作为DR4/5的配体和N-APP作为DR6的配体使下游信号激活,是神经元退化及死亡的两个主要因素。目前,针对Aβ的药物还没有上市,临床试验结果也有失败的例子,如Tramiprosate在Ⅲ期临床试验失败等。部分药物也在研发阶段,更深入的研究或许可能在Aβ方面发现不同的治疗药物。N-APP是DR6的激动剂,但是目前关于N-APP的研究还没有深入,由sAPPβ产生的机制还不明确。若将N-APP的产生机制研究清楚,也可针对N-APP来为AD的治疗提供可能的靶点药物。
现在研究治疗AD的药物大都集中在Tab 1中,针对caspase的药物研发还没有进入实质的临床阶段,但之前已有人开始研究在AD中caspase的相关生物作用。caspases 在AD的两种致病因素中均有直接的调控作用,在AD方面将研究靶点转向caspases,这为下一步开发caspases专一抑制剂以及应用在AD药物联合治疗的研发将会提供很多帮助。
参考文献:
[1] Weuve J,Hebert L E,Scherr P A,et al.Deaths in the United States among persons with Alzheimer′s disease(2010-2050)[J].Alzheimers Dement,2014,10(2):e40-6.
[2] Bird T D.Genetic aspects of Alzheimer disease[J].Genet Med,2008,10(4):231-9.
[3] Karch C M,Cruchaga C,Goate A M.Alzheimer′s disease genet-ics:from the bench to the clinic[J].Neuron,2014,83(1):11 -26.
[4] Fossati S,Ghiso J,Rostagno A.TRAIL death receptors DR4 and DR5 mediate cerebral microvascular endothelial cell apoptosis in-duced by oligomeric Alzheimer′s Abeta[J].Cell Death Dis,2012,3:e321.
[5] 陈立立,陈忠明,王冠林,等.以细胞存亡调控蛋白c-FLIP为靶点的癌症治疗研究[J].中国药理学通报,2014,30(11):1496-502.
[5] Chen L L,Chen Z M,Wang G L,et al.Studies on cell death and survival regulatory protein c-FLIP as a target for cancer treatment [J].Chin Pharmacol Bull,2014,30(11):1496-502.
[6] Arriagada P V,Growdon J H,Hedley-Whyte E T,et al.Neurofi-brillary tangles but not senile plaques parallel duration and severity of Alzheimer′s disease[J].Neurology,1992,42(3 Pt 1):631 -9.
[7] Avila J,Lucas J J,Perez M,et al.Role of tau protein in both physiological and pathological conditions[J].Physiol Rev,2004,84(2):361-84.
[8] de Calignon A,Fox L M,Pitstick R,et al.Caspase activation precedes and leads to tangles[J].Nature,2010,464(7292):1201-4.
[9] Hoover B R,Reed M N,Su J,et al.Tau mislocalization to den-dritic spines mediates synaptic dysfunction independently of neuro-degeneration[J].Neuron,2010,68(6):1067-81.
[10]Idan-Feldman A,Ostritsky R,Gozes I.Tau and caspase 3 as tar-gets for neuroprotection[J].Int J Alzheimers Dis,2012,2012:493670.
[11]Carrasco-Gallardo C,Farias G A,Fuentes P,et al.Can nutraceu-ticals prevent Alzheimer′s disease?Potential therapeutic role of a formulation containing shilajit and complex B vitamins[J].Arch Med Res,2012,43(8):699-704.
[12]Carrasco-Gallardo C,Guzman L,Maccioni R B.Shilajit:a natu-ral phytocomplex with potential procognitive activity[J].Int J Alzheimers Dis,2012,2012:674142.
[13]Medina M,Avila J.Glycogen synthase kinase-3(GSK-3)inhibi-tors for the treatment of Alzheimer′s disease[J].Curr Pharm Des,2010,16(25):2790-8.
[14]Rudrabhatla P,Pant H C.Role of protein phosphatase 2A in Alzheimer′s disease[J].Curr Alzheimer Res,2011,8(6):623 -32.
[15]Zilkova M,Zilka N,Kovac A,et al.Hyperphosphorylated trun-cated protein tau induces caspase-3 independent apoptosis-like pathway in the Alzheimer′s disease cellular model[J].J Alzheim-ers Dis,2011,23(1):161-9.
[16]Lee S,Shea T B.Caspase-mediated truncation of tau potentiates aggregation[J].Int J Alzheimers Dis,2012,2012:731063.
[17]Rohn T T.Caspase cleaved tau in Alzheimers disease:a therapeu-tic target realized[J].Int J Neurol Neurother,2015,2(1):014.
[18]Lin W L,Dickson D W,Sahara N.Immunoelectron microscopic and biochemical studies of caspase-cleaved tau in a mouse model of tauopathy[J].J Neuropathol Exp Neurol,2011,70(9):779-87.
[19]Ramcharitar J,Albrecht S,Afonso V M,et al.Cerebrospinal fluid tau cleaved by caspase-6 reflects brain levels and cognition in ag-ing and Alzheimer disease[J].J Neuropathol Exp Neurol,2013,72(9):824-32.
[20]Zhao H,Zhao W,Lok K,et al.A synergic role of caspase-6 and caspase-3 in Tau truncation at D421 induced by H2O2[J].Cell Mol Neurobiol,2014,34(3):369-78.
[21]Torreilles F,Touchon J.Pathogenic theories and intrathecal analy-sis of the sporadic form of Alzheimer′s disease[J].Prog Neurobi-ol,2002,66(3):191-203.
[22]Fossati S,Cam J,Meyerson J,et al.Differential activation of mi-tochondrial apoptotic pathways by vasculotropic amyloid-beta vari-ants in cells composing the cerebral vessel walls[J].FASEB J,2010,24(1):229-41.
[23]Tsai A C,Pan S L,Sun H L,et al.CHM-1,a new vascular tar-geting agent,induces apoptosis of human umbilical vein endotheli-al cells via p53-mediated death receptor 5 up-regulation[J].J Biol Chem,2010,285(8):5497-506.
[24]Dorr J,Bechmann I,Waiczies S,et al.Lack of tumor necrosis factor-related apoptosis-inducing ligand but presence of its recep-tors in the human brain[J].J Neurosci,2002,22(4):RC209.
[25]Chu J,Li J G,Joshi Y B,et al.Gamma secretase-activating pro-tein is a substrate for caspase-3:implications for Alzheimer′s dis-ease[J].Biol Psychiatry,2015,77(8):720-8.
[26]Kishi T,Hirooka Y,Konno S,et al.Angiotensin II type 1 recep-tor-activated caspase-3 through ras/mitogen-activated protein ki-nase/extracellular signal-regulated kinase in the rostral ventrolater-al medulla is involved in sympathoexcitation in stroke-prone spon-taneously hypertensive rats[J].Hypertension,2010,55(2):291 -7.
[27]D′Amelio M,Cavallucci V,Middei S,et al.Caspase-3 triggers early synaptic dysfunction in a mouse model of Alzheimer′s disease [J].Nat Neurosci,2011,14(1):69-76.
[28]Shao H,Zhang Y,Dong Y,et al.Chronic treatment with anes-thetic propofol improves cognitive function and attenuates caspase activation in both aged and Alzheimer′s disease transgenic mice [J].J Alzheimers Dis,2014,41(2):499-513.
[29]Gralle M,Ferreira S T.Structure and functions of the human amy-loid precursor protein:the whole is more than the sum of its parts [J].Prog Neurobiol,2007,82(1):11-32.
[30]Butterfield D A,Swomley A M,Sultana R.Amyloid beta-peptide (1-42)-induced oxidative stress in Alzheimer disease:importance in disease pathogenesis and progression[J].Antioxid Redox Sig-nal,2013,19(8):823-35.
[31]Galvan V,Chen S,Lu D,et al.Caspase cleavage of members of
the amyloid precursor family of proteins[J].J Neurochem,2002,82(2):283-94.
[32]Gervais F G,Xu D,Robertson G S,et al.Involvement of caspas-es in proteolytic cleavage of Alzheimer′s amyloid-beta precursor protein and amyloidogenic A beta peptide formation[J].Cell,1999,97(3):395-406.
[33]Hell K,Saleh M,Crescenzo G D,et al.Substrate cleavage by caspases generates protein fragments with Smac/Diablo-like activi-ties[J].Cell Death Differ,2003,10(11):1234-9.
[34]Nikolaev A,McLaughlin T,O′Leary D D,et al.APP binds DR6 to trigger axon pruning and neuron death via distinct caspases[J].Nature,2009,457(7232):981-9.
[35]Sternberg C,Benchimol M,Linden R.Caspase dependence of the death of neonatal retinal ganglion cells induced by axon damage and induction of autophagy as a survival mechanism[J].Braz J Med Biol Res,2010,43(10):950-6.
[36]Monnier P P,D′Onofrio P M,Magharious M,et al.Involvement of caspase-6 and caspase-8 in neuronal apoptosis and the regenera-tive failure of injured retinal ganglion cells[J].J Neurosci,2011,31(29):10494-505.
[37]Yiannopoulou K G,Papageorgiou S G.Current and future treat-ments for Alzheimer′s disease[J].Ther Adv Neurol Disord,2013,6(1):19-33.
[38]Iwata N,Sekiguchi M,Hattori Y,et al.Global brain delivery of neprilysin gene by intravascular administration of AAV vector in mice[J].Sci Rep,2013,3:1472.
[39]DeMattos R B,Bales K R,Cummins D J,et al.Peripheral anti-A beta antibody alters CNS and plasma A beta clearance and decrea-ses brain A beta burden in a mouse model of Alzheimer′s disease [J].Proc Natl Acad Sci USA,2001,98(15):8850-5.
[40]Orgogozo J M,Gilman S,Dartigues J F,et al.Subacute meningo-encephalitis in a subset of patients with AD after Abeta42 immuni- zation[J].Neurology,2003,61(1):46-54.
[41]Winblad B,Andreasen N,Minthon L,et al.Safety,tolerability,and antibody response of active Abeta immunotherapy with CAD106 in patients with Alzheimer′s disease:randomised,doub-le-blind,placebo-controlled,first-in-human study[J].Lancet Neurol,2012,11(7):597-604.
[42]Salloway S,Sperling R,Fox N C,et al.Two phase 3 trials of bap-ineuzumab in mild-to-moderate Alzheimer′s disease[J].N Engl J Med,2014,370(4):322-33.
[43]Luo Y,Bolon B,Kahn S,et al.Mice deficient in BACE1,the Alzheimer′s beta-secretase,have normal phenotype and abolished beta-amyloid generation[J].Nat Neurosci,2001,4(3):231-2.
[44]Postina R,Schroeder A,Dewachter I,et al.A disintegrin-metal-loproteinase prevents amyloid plaque formation and hippocampal defects in an Alzheimer disease mouse model[J].J Clin Invest,2004,113(10):1456-64.
[45]Doody R S,Raman R,Farlow M,et al.A phase 3 trial of sema-gacestat for treatment of Alzheimer′s disease[J].N Engl J Med,2013,369(4):341-50.
[46]Grossberg G T,Pejovic V,Miller M L,et al.Memantine therapy of behavioral symptoms in community-dwelling patients with mod-erate to severe Alzheimer′s disease[J].Dement Geriatr Cogn Dis-ord,2009,27(2):164-72.
[47]Tayeb H O,Yang H D,Price B H,et al.Pharmacotherapies for Alzheimer′s disease:beyond cholinesterase inhibitors[J].Phar-macol Ther,2012,134(1):8-25.
[48]Duffy A M,Holscher C.The incretin analogue D-Ala2GIP reduces plaque load,astrogliosis and oxidative stress in an APP/PS1 mouse model of Alzheimer′s disease[J].Neuroscience,2013,228:294-300.
Research progress of apoptosis pathways and caspases as therapeutic targets involved in Alzheimer′s disease
WU Wen-bao,KONG Qing-hong,KAN Xiang-xu,WANG Guan-lin,CHANG Kwen-Jen
(Faculty of Life Science and Technology,Kunming University of Science and Technology,Kunming 650500,China)
Abstract:Alzheimer′s disease(AD)is a type of neurodegener-ative disease.Recent studies indicate that neuronal degeneration and loss triggered by tau,APP and Aβ are the probable risks for AD.Neurofibrillary tangles are formed after tau truncated by ac-tivated caspases and subsequently induced tau aggregates,which causes neuronal degeneration and loss.In addition,caspases are crucial components in the biological functioning in the apoptosis pathways.Apoptosis pathway involves activation of upstream ini-tiator caspase-8 and downstream executor caspase-3/-6/-7.After the actions of β-and γ-secretase,APP transforms into sAPPβ and Aβ40/42.Aggregated Aβ42 can activate apoptosis pathway through DR4/5 interaction.C-APP is truncated into C31 frag-ments by caspases and cell apoptosis is facilitated.N-APP,a product of sAPPβ hydrolysis,can promote the abnormal develop-ment of neurons mediated by DR6.Caspase activates γ-secre-tase-activating protein to regulate activity of γ-secretase,and the production of C31 and Aβ40/42,which,then,causes the occur-rence of AD.This brief review summarizes the specific roles of caspases and the concerning apoptosis pathways on the mecha-nisms of neuronal degeneration and loss,and how they impact the occurrence of AD in the hope of uncovering additional poten-tial therapeutic targets that can be employed in drug development and clinical therapy for AD.
Key words:caspase;Alzheimer′s disease;tau;Aβ;apoptosis;therapeutic targets;drug therapy
作者简介:吴文宝(1989-),男,硕士生,研究方向:分子药理学,E-mail:wenbaowu@outlook.com;王冠林(1983-),女,博士,讲师,硕士生导师,研究方向:分子药理学,通讯作者,E-mail:glwang83@gmail.com;张宽仁(1943-),男,美籍华人,博士,特聘教授,博士生导师,研究方向:分子药理学,通讯作者,E-mail:kwenjen-chang@yahoo.com
基金项目:国家自然科学基金资助项目(No 81260351,81360162)
收稿日期:2015-08-25,修回日期:2015-09-27
文献标志码:A
文章编号:1001-1978(2015)11-1496-06
doi:10.3969/j.issn.1001-1978.2015.11.005

