摄食海参皂苷对肥胖小鼠血压的影响
张铃玉,宋姗姗,徐 杰,董 平,薛长湖,王玉明
(中国海洋大学食品科学与工程学院,山东青岛 266003)
摄食海参皂苷对肥胖小鼠血压的影响
张铃玉,宋姗姗,徐 杰,董 平,薛长湖,王玉明
(中国海洋大学食品科学与工程学院,山东青岛 266003)
中国图书分类号:R-332;R282.74;R284.1;R544.1;R589.2;R972.4
摘要:目的 研究海参皂苷对db/db肥胖小鼠血压的影响。方法 将C57BL/KsJ(db/db)小鼠随机分为3组:模型组、海参皂苷低、高剂量组,并以C57BL/KsJ小鼠作正常对照组。海参皂苷低剂量组小鼠摄入饲料中添加0.02%的海参皂苷,高剂量组饲料中添加0.04%的海参皂苷。连续饲喂6周,于第3周和第6周测定小鼠尾动脉血压,并分别测定肾脏血管紧张素转换酶(ACE)、血管紧张素转换酶2(ACE2)以及天冬氨酰蛋白酶(REN)基因的mRNA表达量。结果模型组小鼠血压高于正常组(P<0.01),海参皂苷低剂量组血压低于模型组,但差异无显著性,海参皂苷高剂量组低于模型组(P<0.05),且与正常组相近;海参皂苷的摄食对ACE、REN mRNA表达量无影响,海参皂苷高剂量组ACE2 mRNA表达水平升高(P<0.05)。结论 海参皂苷可改善肥胖进展过程中的血压升高,其机制可能与肾素-血管紧张素系统(RAS)的调节作用有关。
关键词:海参;皂苷;肥胖;高血压;RAS;ACE;ACE2
网络出版时间:2015-7-22 10:42 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20150727.0901.031.html
海参是我国著名的海珍品,也是传统的药食同源的海洋食品,位居海八珍之首,具有多种营养保健功效。海参皂苷(saponin of sea cucumber,SSC)是棘皮动物海参的主要特征性代谢产物,有抗真菌、抗病毒、细胞毒活性、免疫调节等广泛的药理活性[1]。近年来对海参皂苷的研究逐渐增多,海参皂苷的多种药理学作用得到证实[2]。目前,国内外关于皂苷降血压的研究主要集中于植物来源的皂苷,如陈明等[3]对SHR大鼠灌胃低、中高浓度的无患子皂苷,发现中、高浓度皂苷具有持续降压效果;陆益红等[4]发现人参总皂苷灌胃SHR大鼠能产生稍逊于相同剂量卡托普利的降压效果;Turova等[5]报道静脉注射高纯度人参皂苷能够降低家兔血压。海参皂苷结构明显不同于人参等植物源性皂苷,而关于海参皂苷的报道鲜有。
高血压是一种常见的心血管系统疾病。目前我国高血压患病人数已超过1亿,并以每年500万人的速度增加。体重超重、膳食高盐、中度以上饮酒是高血压病发病的三大危险因素[6]。其中,绝大多数为原因不明的原发性高血压,体重超重和肥胖作为原发性高血压的第一危险因素,日益引起人们的关注。
目前,人们已在动物身上建立了多种动物高血压模型,常用的模型一般有两类,一类是通过对肾脏进行手术,造成肾源性高血压;另一类是自发性SHR大鼠,其更接近于家族性高血压的人群。本实验中采用的db/db小鼠是一类瘦素受体突变的自发性肥胖小鼠,食欲旺盛、极度肥胖[7],且伴随肥胖血压升高,其特征更接近于肥胖的高血压人群。本实验通过观察海参皂苷对db/db小鼠血压的影响,初步探讨海参皂苷对肥胖小鼠的降压机制,为其作为海洋药物原料提供科学依据。
1 材料与方法
1.1材料、试剂与仪器 海参皂苷以菲律宾刺参为原料,按照董平等[8]的方法制备,其纯度经HPLC法测定达91%。
C57BL/KsJ(db/db)小鼠合计24只,SPF级,♂,体质量20~25 g;C57BL/KsJ作为正常对照,共5只,SPF级,♂,体质量15~20 g,购自南京青紫兰科技有限公司。
小动物无创血压测定系统,CODA 2-Channels型,美国Kent Scientific公司;Ultra Trurrax T18 Basic型高速匀浆机,德国Ika公司;iQ5型Realtime PCR仪,美国Bio-Rad公司。
1.2方法
1.2.1动物分组及饲料配制 24只C57BL/KsJ (db/db)小鼠经适应性喂养1周后,按体质量随机分为模型组、海参皂苷低剂量组和海参皂苷高剂量组,每组8只;并以5只C57BL/KsJ作为正常对照组。其中,对照组和模型组均喂食基础饲料,海参皂苷低、高剂量组在基础饲料的基础上分别添加0.2 g ·kg-1的海参皂苷和0.4 g·kg-1的海参皂苷。各组饲料具体成分如Tab 1所示。

Tab 1 Compositions of experimental diets
1.2.2动物实验 动物放入钢丝笼内单只饲喂,室温(23±2)℃,12∶12 h明暗交替,自由摄食和饮水,连续喂养6周。分别于第3周和第6周进行血压测定。末次喂食后,禁食不禁水10 h,眼球取血处死,取肾脏于-80℃保存,用于提取RNA。
1.2.3血压测定 参照小动物无创血压仪说明书,使用尾袖套法无创血压系统测量小鼠尾动脉血压,测定前1周,每日使小鼠进入套筒适应15 min,模拟测试3 min,实际测定时于测定前5 min进入套筒,适应后连续测定,取5次成功测定值的平均值为其实际血压值。
1.2.4肾脏相关基因mRNA表达量的测定 使用TRIzol法提取肾脏组织总RNA,依照M-MLV说明书进行逆转录步骤得到cDNA,并参照SYBR Green I Master Mix说明书进行RT-qPCR,检测各目的基因mRNA表达量。PCR扩增程序为:95℃预变性10 min;95℃变性15 s,57℃退火20 s,72℃延伸30 s,重复45个循环。目的基因mRNA表达量以18s为内参进行校正。实验中使用引物序列如Tab 2所示。

Tab 2 Primer sequences of RT-qPCR amplification
2 结果
2.1海参皂苷对小鼠生长指标的影响 由Tab 3可以看出,与正常组相比,模型组小鼠在饲养前后体重明显大于正常组,这也是C57BL/KsJ(db/db)小鼠的典型特征。在日平均摄入能量相近的情况下,海参皂苷低、高剂量组小鼠体重增加均受到抑制。而由Fig 1可知,模型组与海参皂苷组小鼠的身体各部分脂肪重量较正常组小鼠均明显升高(P<0.01);与模型组相比,身体各部分脂肪重量海参皂苷组均明显下降,其中,海参皂苷高剂量组肾周脂肪、皮下脂肪、生殖腺周围脂肪、肠系膜脂肪的重量分别下降0.21(P<0.05)、0.25(P<0.01)、0.28(P <0.01)和0.46(P<0.01)。说明皂苷有抑制体重增长和抑制体脂肪蓄积的效果。
Tab 3 Effects of sea cucumber saponin on the growth of mice(±s,n=8)

Tab 3 Effects of sea cucumber saponin on the growth of mice(±s,n=8)
**P<0.01 vs model
Group Food intake/g·d-1Body weight gain/g Normal 2.45±0.43 6.6±0.4 Model 2.93±0.79 13.7±0.3 SSC 0.2 g·kg-1 3.09±1.24 10.4±0.1**SSC 0.4 g·kg-1 2.93±0.98 10.6±0.2**
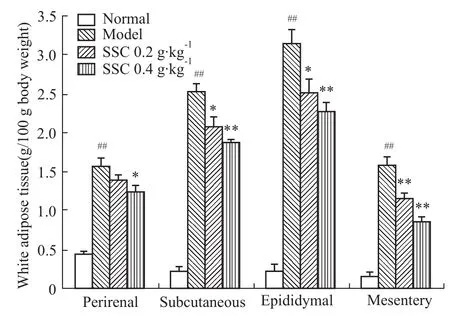
Fig 1 Effects of sea cucumber saponin on adipose tissue weight in mice(n=8)
2.2海参皂苷对小鼠血压的影响 Fig 2、3分别为小鼠血压第3周和第6周的测量值。由Fig 2所示,第3周时模型组、海参皂苷组血压水平较正常组均明显升高(P<0.01),海参皂苷组与模型组相比,血压有降低趋势,但两者差异无统计学意义。Fig 3示第6周数据中可以看出,与正常组相比,模型组的舒张压和收缩压水平均升高(P<0.01),分别升高了0.22和0.19。相较于模型组,海参皂苷低剂量组的收缩压降低0.09(P<0.05),高剂量组的血压降低更为明显,特别是收缩压降低0.15(P<0.01),更接近于正常组。

Fig 2 Effects of sea cucumber saponin on blood pressures in mice(n=8)
2.3海参皂苷对小鼠肾脏基因mRNA表达量的影响
2.3.1海参皂苷对小鼠肾脏ACE和ACE2 mRNA表达量的影响 ACE是肾素-血管紧张素系统(RAS)的重要组件,是上皮细胞和内皮细胞表面的膜结合蛋白。ACE2即血管紧张素转化酶2,其与ACE表达失衡导致RAS系统过度激活,是高血压形成与发展的重要原因。对肾脏中ACE和ACE2 mR-NA表达量进行测定,结果如Fig 4所示。与正常组相比,模型组ACE mRNA表达量略有降低,海参皂苷低剂量组和高剂量组均有所上升,但差异均无统计学意义。海参皂苷低剂量组和高剂量组ACE2 mRNA表达量较模型组明显上升(P<0.05),海参皂苷高剂量组较低剂量组略高,但两者差异无统计学意义。
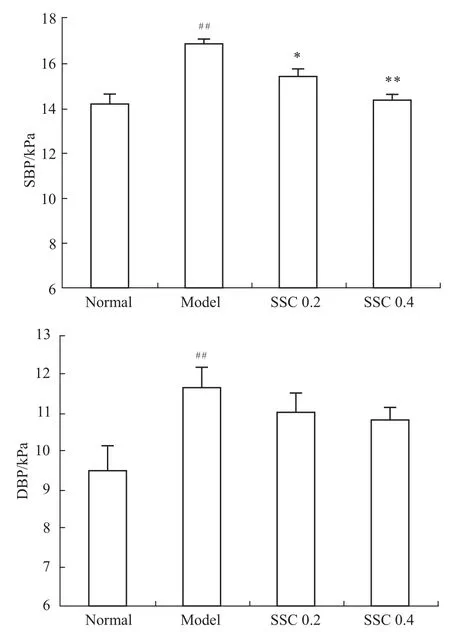
Fig 3 Effects of sea cucumber saponin on blood pressures in mice(n=8)

Fig 4 Effects of sea cucumber saponin on nephritic ACE and ACE2 level in mice(n=8)
2.3.2海参皂苷对肾脏基因REN mRNA表达量的影响 对肾脏基因REN mRNA表达量的测定结果如Fig 5所示,与对照组相比,模型组REN mRNA表达水平有升高趋势;与模型组相比,海参皂苷低剂量组REN mRNA表达量较模型组有所升高,且高剂量组升高幅度较低剂量组小,但差异均无统计学意义。

Fig 5 Effects of sea cucumber saponin on nephritic REN level in mice(n=8)
3 讨论
近年来,人们生活水平日益提高,超重、肥胖人口日益增多,成为高血压发病的重要因素之一。已有研究显示,肥胖者与正常体重者相比,患高血压的可能性增加7倍[9],而大量实验与临床研究表明,高血压常伴有胰岛素抵抗、高胰岛素血症、糖代谢和脂肪代谢异常等,并引起冠心病、心力衰竭、肾功能不全等并发症[10],导致人体全身脏器的损害,严重影响人的身体健康,甚至危及人们的生命。通过饮食预防和控制高血压,特别是针对临界高血压(边缘型高血压)的干预尤为重要。近年来,已有报道表明食物中的皂苷类具有降血压功效,卞海等[11]等研究表明,无患子皂苷可降低原发性高血压大鼠的血压;武聪等[12]研究表明,对于两肾两夹法造高血压大鼠模型,人参皂苷的降压效果明显,并适当改善模型组大鼠心脏、肾脏等的形态学损伤程度;而关于海参皂苷的降压功效研究鲜有报道。本实验选取伴随肥胖而血压升高的C57BL/KsJ(db/db)小鼠,与其他高血压模型小鼠相比,属于临界高血压模型,其模型特点与因肥胖造成的边缘型高血压人群更为接近。
通过对小鼠的血压进行检测,可发现模型组小鼠血压明显高于正常对照组,即伴随着肥胖的血压升高。而海参皂苷高剂量组血压与模型组相比明显降低,说明海参皂苷具有较为明显的降血压作用。
RAS是心血管功能调节的重要系统,ACE、ACE2和REN均为RAS系统中的成员。肝脏合成的前体蛋白血管紧张素原(AGT)可在肾素(REN)的作用下转变为无活性的血管紧张素I(Ang I)。ACE全身性表达,作为一种升压酶在RAS中发挥作用,将血管紧张素I(Ang I)转化形成血管紧张素Ⅱ(AngⅡ),并且降解具有血管舒张性的Ang(1-7)。ACE2主要在心脏、肾脏及睾丸中表达,最明显的功能为降解AngⅡ形成Ang(1-7),起到舒缓血压的作用[13]。ACE2的缺失会促进高血压病情发展并减弱降压药ACE抑制剂的降压效果[14]。因此,关于RAS的新观点认为其具有使血管收缩和血管舒张的双重功能,而功能的实现从根本上取决于ACE-ACE2的平衡[15]。本实验对小鼠肾脏REN、ACE、ACE2的mRNA表达量的测定结果显示,海参皂苷可明显上调ACE2的表达量,使得ACE/ACE2比值降低,这可能是其发挥降血压作用的机制之一。有研究发现给予Ang(1-7)对血压有不利影响,过量Ang(1-7)的存在可能造成ACE-ACE2的失衡,进而利于AngⅡ的积累[16],说明ACE2表达量的升高,以及活性的增加比添加ACE2的产物更利于高血压疾病的治疗[17]。
本实验结果显示,在摄入能量相近的情况下,海参皂苷组(低剂量组和高剂量组)体重以及身体各部分脂肪重量均低于模型组小鼠。已有研究表明,海参皂苷能够抑制高脂肪饮食诱导的肥胖[18],本实验结果进一步证明海参皂苷对遗传性肥胖也有效。
此外,肥胖体脂肪组织增多,脂肪组织作为一种重要的内分泌组织分泌脂肪细胞因子,而瘦素等被认为在伴随肥胖的高血压中起中介作用[19];同时,脂肪组织是体内AngⅡ的重要补充来源,而AngⅡ也可促进机体前脂肪细胞分化和脂肪细胞增殖,诱导脂肪组织形成,形成恶性循环[20],促使血压升高。因此,海参皂苷也可能通过改变脂肪组织分泌的升压性细胞因子而抑制肥胖小鼠血压升高。
综上所述,本实验证实了海参皂苷具有明显抑制肥胖体脂肪蓄积,以及改善肥胖进程中的血压升高的作用,其机制与RAS的调节作用有关。而海参皂苷是对RAS中基因直接作用还是通过影响脂肪组织进一步影响RAS以发挥降压作用,需后续研究进一步验证。
(致谢:本实验于中国海洋大学食品学院人类健康实验室完成,感谢实验室所提供的帮助与支持。)
参考文献:
[1] 徐慧静,张 灏,刘春花,等.摄食海参皂苷对小鼠高尿酸血症的影响[J].中国药理学通报,2011,27(8):1064-7.
[2] Xu H J,Zhang H,Liu C H,et al.The effect of dietary sea cu-cumber saponin on hyperuricemia in mice[J].Chin Pharmacol Bull,2011,27(8):1064-7.
[2] 阮伟达,苏永昌,吴成业.海参皂苷的研究现状[J].福建水产,2011,33(2):74-8.
[2] Ruan W D,Su Y C,Wu C Y.Research of sea cucumber glyco-sides[J].J Fujian Fish,2011,33(2):74-8.
[3] 陈 明.基于AngⅡ上调p38MAPK通路介导的炎症反应与无患子皂苷降压作用及机制的相关性研究[D].合肥:安徽医科大学,2013.
[3] Chen M.The research of the relationship between inflammatory re-sponse mediated by p38-mitogen-activated protein kinase pathway based on angiotensin-Ⅱand the antihypertensive effects and mech-anisms of sapindus saponins[D].Hefei:Anhui Med Univ,2013.
[4] 陆益红,王广基,黄 青,等.自发性高血压大鼠血浆代谢组学研究及人参总皂苷作用机制初探[J].中国天然药物,2007,5 (6):443-7.
[4] Lu Y H,Wang G J,Huang Q,et al.Investigations into metabo-nomic profiling of spontaneously hypertensive rat(SHR)and met-abolic effects of total ginsenoside on SHR using GCPMS[J].Chin J Nat Med,2007,5(6):443-7.
[5] Turova A D,Aleshkina YaA.Experimental study of Echinopanax elatum[M]//Turova A D.Medicinal Preparations from Plants.Moscow:Soviet Muscovite Press,1962:101-62.
[6] 中国高血压防治指南(试行本)[S].中华人民共和国卫生部,1999.
[6] The guidelines for prevention and control of hypertension[S].Ministry of Health of the People's Republic of China,1999.
[7] Wu J,Wang H M,Li J,Men X L.The research applications of db/db mouse[J].Prog Physiol Sci,2013,44(1):12-8.
[8] 董 平.革皮氏(Pearsonothria graeffei)海参皂苷化合物的分离鉴定、结构修饰及活性研究[D].青岛:中国海洋大学,2008.
[8] Dong P.Srudies on the isolation,identification structure-modifi-cation and bioactivities of triterpene glycosides in Pearsonothria graeffei[D].Qingdao:Ocean Univ China,2008.
[9] Reisin E,Jack A V.Obesity and hypertension:mechanisms,car-diorenal consequences,and therapeutic approaches[J].Med Clin North Am,2009,93(3):733-51.
[10]王子宽,程志清,郭 艳.高血压肥胖发病机制研究进展[J].陕西中医学院学报,2004,27(2):52-4.
[10]Wang Z K,Cheng Z Q,Guo Y.Pathogenesis of hypertensive obe-sity:research progress[J].J Shaanxi Coll Tradit Chin Med,2004,27(2):52-4.
[11]卞 海,龙子江,陈 明,王 靓.无患子皂苷对原发性高血压大鼠的影响[J].中成药,2009,31(3):367-9.
[11]Bian H,Long Z J,Chen M,Wang L.Effect of sapindoside on pri-mary hypertension rat[J].Chin Tradit Patent Med,2009,31(3):367-9.
[12]武 聪.人参皂苷降解物对高血压高血脂大鼠心肝肾的形态学研究[D].长春:吉林大学,2012.
[12]Wu C.Degradation products of ginsenosides on morphological study of heart,liver,kidney in rats with hypertension and hyper-lipidemia[D].Changchun:Jilin Univ,2012.
[13]罗益滨,朱天怡,陈 震,等.肥胖性高血压机制研究进展[J].第二军医大学学报,2010,31(4):442-4.
[13]Luo Y B,Zhu T Y,Chen Z,et al.Mechanisms of obesity-related hypertension:recent progress[J].Acad Sec Mil Med Univ,2010,31(4):442-4.
[14]Tikellis C,Cooper M E,Bialkowski K,et al.Developmental expres-sion of ACE2 in the SHR kidney:a role in hypertension[J]?Kid-ney Int,2006,70(1):34-41.
[15]Santos R A,Ferreira A J,Simões E,Silva A C.Recent advances in the angiotensin-converting enzyme 2-angiotensin(1-7)-Mas axis [J].Exp Physiol,2008,93(5):519-27.
[16]Velkoska E,Dean R G,Griggs K,et al.Angiotensin-(1-7)infusion is associated with increased blood pressure and adverse cardiac re-modelling in rats with subtotal nephrectomy[J].Clin Sci(Lond),2011,120(8):335-45.
[17]Burrell L M,Burchill L,Dean R G,et al.Chronic kidney disease:cardiac and renal angiotensin-converting enzyme(ACE)2 expres-sion in rats after subtotal nephrectomy and the effect of ACE inhi-bition[J].Exp Physiol,2012,97(4):477-85.
[18]胡晓倩.海参皂苷对脂质代谢的影响及其机制研究[D].青岛:中国海洋大学,2010.
[18]Hu X Q.Study on effects and mechanism of saponis of sea cucum-ber on lipid metabolism[D].Qingdao:Ocean Univ China,2010.
[19]Seven E,Husemoen L L,Wachtell K,et al.Overweight,adipocyto-kines and hypertension:a prospective population-based study[J].J Hypertens,2014,32(7):1488-94.
[20]吴晓明,姜建国,黄志立,张丽君.RAS与肥胖性高血压[J].中山大学研究生学刊(自然科学、医学版),2008,29(4):1-6.
◇实验方法学◇
[20]Wu X M,Jiang J G,Huang Z L,Zhang L J.RAS and obesity-re-lated hypertension[J].J Grad Sun Yat-Sen Univ(Nat Sci,Med),2008,29(4):1-6.
Effects of sea cucumber saponin on blood pressure in obese mice
ZHANG Ling-yu,SONG Shan-shan,XU Jie,DONG Ping,XUE Chang-hu,WANG Yu-ming
(College of Food Science and Engineering,Ocean University of China,Qingdao Shandong 266003,China)
Abstract:Aim To investigate the effects of saponin of sea cucumber(SSC)on the blood pressure in obese mice.Methods C57BL/KsJ(db/db)mice were ran-domized into 3 groups(8 mice each):model group,low-dose SSC group and high-dose SSC group.Normal C57BL/KsJ mice were used as control.The low and high SSC groups were fed on basal diets incorporated with 0.02%and 0.04%SSC.Different treatments were administered for 6 weeks and arterial pressure was measured in the third and sixth weeks.The abundance of renal ACE,ACE2 and REN mRNA was detected by real time PCR.Results Compared with controlbook=1174,ebook=143group,the blood pressure of model group mice was ob-viously raised(P<0.01).Low-dose SSC group mice showed lower blood pressure than model group without statistically significant differences,and the blood pres-sure of high-dose SSC group mice was similar to that of control group and significantly lower than model group.(P<0.05)There were no remarkable differences a-bout ACE and REN mRNA among the groups,howev- er,ACE2 mRNA level was significantly increased in high-dose SSC group.Conclusion SSC plays a vital role in decreasing blood pressure,which probably re-lates to the regulating function of renin-angiotensin sys-tem(RAS).
Key words:sea cucumber;saponin;obesity;hyperten-sion;RAS;ACE;ACE2
作者简介:张铃玉(1991-),女,硕士生,研究方向:海洋生物活性物质,E-maill:lyuzhang2010@hotmail.com;王玉明(1973-),男,博士,教授,博士生导师,研究方向:食品活性成分功效,通讯作者,E-mail:wangyuming@ouc.edu.cn
基金项目:国家自然科学基金资助项目(No U1406402);教育部“新世纪优秀人才支持计划”(No NCET-13-0534);"泰山学者"建设工程专项经费
收稿日期:2015-04-18,修回日期:2015-05-25
文献标志码:A
文章编号:1001-1978(2015)08-1169-06
doi:10.3969/j.issn.1001-1978.2015.08.028