KDR基因多态性的杰出有氧耐力表型与运动应激诱导的循环microRNA差异表达谱的关联研究
许英樱,段立公,徐 思
●成果报告 Original Articles
KDR基因多态性的杰出有氧耐力表型与运动应激诱导的循环microRNA差异表达谱的关联研究
许英樱1,段立公2,徐 思3
目的:分析KDR基因SNP/rs1870377的A/A基因型的杰出有氧耐力表型与训练诱导的循环miRNA表达特征的关联。方法:试验对象为33名现役国家级耐力项目男性运动员和58名体育教育专业男性大学生(二级运动员),均为汉族。递增负荷法检测最大摄氧量、个体乳酸阈;miRNAarray及qRT-PCR检测训练诱导的c-miRNA表达谱,Taqman法解析KDR基因SNP/rs1870377基因型,分析优势基因型及其杰出耐力表型与训练诱导的c-miRNA表达特征的关联。结果:A/A基因型的杰出耐力表型差异表达17条c-miRNA,9条上调,8条下调;miRNA同步调控AMPK、p53、PPAR、MAPK、mTOR等信号通路多个基因表达。结论:差异表达的miRNA的调控作用同步上调AMPK-PGC-1α通路和p53通路功能,促进线粒体合成和有氧代谢能力,在A/A基因型上调VEGF通路活性增强心肌/骨骼肌供血条件下进一步提高有氧代谢供能效率,对杰出耐力表型的形成具有促进作用;miRNA的调控作用与rs1870377的A/A基因型的杰出有氧耐力表型存在关联,二者可作为预测有氧耐力发展潜力的表观遗传学分子标记,联合应用于运动选材。
杰出有氧耐力表型;血管内皮生长因子受体2;单核苷酸多态性;运动应激;循环microRNA
杰出有氧耐力的遗传优势主要体现在优势基因型及促进优势基因型表型化的基因表达调控模式,后者主要是表观遗传学基因调控机制[1],在训练应激诱导下条件性地影响基因型优势向表型优势的传递[2]。结合优势基因型,分析运动应激诱导的基因表达调控模式与杰出运动能力表型的关联,可以针对个体评估其是否具有发展杰出运动能力的遗传潜质。
KDR基因又称为VEGFR2,是VEGF调节血管内皮细胞增殖、存活、迁移和通透性改变等的主要受体,参与调节机体对耐力性训练的适应[3]。KDR基因SNP/rs1870377位于KDR基因第11外显子上,该位点A-T碱基替换使KDR蛋白质氨基酸序列发生Gln/His替换,KDR活性发生上调[4],强化了下游通路的作用强度。研究表明,KDR基因SNP/rs1870377与杰出有氧耐力具有显著关联[4],可能是发展有氧耐力的优势基因,但其有氧耐力表型差异十分显著[5],训练应激诱导的表观遗传学调控机制对SNP的作用可能是影响其表型优势的主要原因。
microRNA(miRNA)通过多种途径调控应激适应通路中靶基因的表达,在机体对环境应激因素的适应中发挥重要作用[6]。应激因素诱导miRNAs独立表达,并与靶基因mRNA上的调控位点互补结合调节基因选择性表达[7]。miRNAs自身表达模式具有稳定的遗传性个体差异,其对应激适应信号通路关键蛋白基因表达的调控作用改变了机体的适应方式和敏感性,产生表型差别[8]。
组织内miRNAs分泌进入血液循环成为循环miRNA(circulating miRNA,c-miRNA),具有内分泌样的远距离调控作用。在运动性适应的不同状态下,c-miRNA表达水平会发生特征性改变并与适应效果相关,推测其可能是机体应答过程中整合多系统适应性反应的关键因子[9]。miRNA与c-miRNA在表达种类和水平上密切相关,c-miRNA可以作为反映miRNA调控作用的生物标记[10]。
本研究比较耐力项目的现役国家级运动员与体育教育专业大学生(中长跑项目二级运动员)的有氧耐力水平与KDR基因SNP/rs1870377基因型分布和运动应激诱导的c-miRNA表达谱的差异,分析SNP优势基因型的杰出有氧耐力表型与运动应激诱导的c-miRNA表达特征的关联,探讨c-miRNA作为预测和评估杰出有氧耐力的表观遗传学分子标记与SNP联合应用于运动选材的可行性。
1 研究对象与方法
1.1 研究对象
杰出有氧耐力组入选标准参考席翼标准[11]及Μ.A.RIVERA的标准[12]:(1)耐力性项目国家健将级以上现役运动员;(2)未达到健将级,但相对最大摄氧量(R-O2max)>73 mL/kg·min的现役运动员。根据该标准,杰出有氧耐力组(Elite Endμrance Athlete,EEA组):33名男性现役运动员,运动专项为铁人三项赛(成都军区铁人三项队,17人)和公路自行车(河北省自行车队,16人)。一般有氧耐力组入选标准为2010年度当年获得中长跑二级运动员资格的体育教育专业大学生。根据该标准,一般有氧耐力组(College Student level2,CS2组):成都体育学院本科1~3年级58名男性体育教育专业大学生(见表1)。

表1 杰出耐力水平运动员和普通水平运动员基本情况表Table1 characteristics of male participants in EEA group and CS2 group
1.2 研究方法
1.2.1 最大摄氧量和个体乳酸阈测定 逐级递增负荷运动方式测定最大摄氧量(O2max),使用跑台(RUN Μed 700,Technogym,意大利;cosmos pulsar4.0,德国)和运动气体代谢分析仪(CPX,JAEGER;metalyzer,德国)。受试者测试前热身3 min,正式试验采用预设的Bruce方案,即每3 min增加速度或坡度直至力竭,通气数据由气体代谢分析仪自动采集。同步检测个体乳酸阈(ILT),分别取安静状态下,每级负荷后即刻,恢复期第2、5、8、10、15 min血样测定血乳酸值;取中指指尖血20 μL,采用YSI1500便携式血乳酸自动分析仪测定血乳酸值;采用Stegmann方法判定ILT[13]。
1.2.2 KDR基因SNP/rs1870377基因型解析 取静脉血2 mL,EDTA抗凝,OΜEGA公司全血总DNA提取专用试剂盒提取受试者DNA,要求纯度为OD260/OD280=1.8~2.0。采用rs1870377 TaqΜan SNP检测试剂盒(TaqΜan SNP Genotype Assay Cat# 4351379),按照说明书配制反应体系及设定参数。PCR反应体系(25 μL):2X Genotyping Μaster mix,12.5 μL;20X SNP kit(Probe/Primer mix)5 μL;DNA(20 ng/μL);ddH2O。PCR循环参数:95℃10 min,(95℃15 s,60℃1 min)×40个循环。7900HT型高通量(ABI公司)实时荧光定量PCR系统上进行PCR反应,SDS2.2.1软件分析基因分型结果。
1.2.3 运动应激诱导的c-miRNA及其相对表达量测定O2max测试前及测试后1 h内分别取静脉血5 mL(EDTA抗凝)测定c-miRNA相对表达量,计算表达量变化倍率(fold change),参照Davidsen运动应激调控的c-miRNA筛选标准[15]:fold change>1.5或<0.67的c-miRNA即为运动应激调控的c-miRNA。
(1)血浆总RNA提取。TRIZOL法提取血浆总RNA,紫外分光光度仪测定RNA纯度和浓度,OD260/280>1.9说明提取的总RNA纯度较好,甲醛变性琼脂糖电泳检测提取的RNA完整性较好,没有发生降解。
(3)实时荧光定量PCR(qRT-PCR)验证差异表达c-miRNA相对表达量。c-miRNA茎环反转录合成cDNA,反转录引物由北京六合华大基因公司合成,20 μL反应体系(5×First Strand synthesis Buffer,4 μL;dNTPmix1μl;RNase Inhibitor,40 units;ReverseTranscriptase(Μ-ΜLV),1 μL;Stem-loop RTPrimer,1 μL;Total RNA500 ng;RNase-free ddH2O)。65℃加热5 min,放入冰中2 min,放置PCR仪16℃热激30 min,42℃60 min,85℃5 min,停止反转录。
qRT-PCR检测c-miRNA表达水平,miRNA定量引物由北京六合华大基因公司合成,反应体系按照SYBR®Premix Ex TaqTΜⅡ(Perfect Real Time)说明书进行配置。使用Bio-Rad iCycler PCR System进行Real Time PCR反应,程序:95℃5 min,95℃10 s,60℃30 s,40cycle,以上循环结束后进行65℃~95℃的融解曲线分析。每个样品平行3次,溶解曲线为单一峰(见图1),按照2-ΔΔCt计算样品的相对表达丰度。

图1 实时荧光定量PCR检测c-miRNA的扩增动力学曲线。Figure1 Kinetic curves of c-miRNA Gene qRT-PCR amplification.
1.2.4 差异表达的c-miRNA的筛选和生物信息学分析 比较EEA组和CS2组的运动应激诱导的c-miRNA表达变化率,以组间差异在1.5倍以上的c-miRNA作为差异表达的c-miRNA。利用Targetscan数据库、miRBase数据库和miRanda数据库预测靶基因,取交集作为靶基因集合。利用KEGG数据库和IPA数据库对靶基因集合进行GO分析和pathway分析(见图1)。
1.3 数据统计处理
数据处理采用SPSS17.0软件,Hardy-Weinberg遗传平衡检测和各基因型组间分布采用R*C列联表X2检验。各项指标数据均采用M±SD表示,均数间比较采用单因素方差分析,P<0.05表示两组间的差异有统计学意义。两组数据之间的相关性分析采用Bivariate过程,计算Pearson相关系数并用r表示。
2 结果
EEA组和CS2组受试者群体rs1870377基因型分布频率卡方检验符合Hardy-Weinberg遗传平衡(P>0.05),该群体具有代表性。
2.1 KDR基因SNP/rs1870377基因型在EEA组和CS2组的分布频率比较
KDR基因SNP/rs1870377基因型的分布频率在EEA组和CS2组的差异具有统计学意义(P<0.05),且A/A基因型与杰出有氧耐力表型的关联具有统计意义(P<0.05)(见表2)。
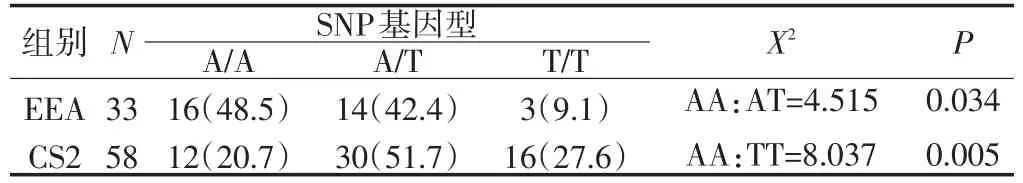
表2 KDR基因SNP/rs1870377基因型分布频率比较/%Table2 Comparison of genotypic frequencies of rs1870377 between EEA group and CS2 group/%
2.2 EEA组和CS2组各基因型有氧耐力指标的比较

表3 EEA组和CS2组各基因型有氧耐力指标的比较Table3 Comparison of the aerobic capacity values by rs1870377 genotypes between EEA group and CS2 group
2.3 A/A基因型杰出耐力表型差异表达的c-miRNA及其靶基因富集通路分析
2.3.1 A/A基因型杰出耐力表型差异表达的c-miRNA 与CS2组相比,A/A基因型EEA组差异表达38条c-miRNA,其中表达水平变化率超过2.0的有17条,9条上调,8条下调(见表4)。

表4 A/A基因型杰出耐力表型差异表达的c-miRNATable4 Differential expressed c-miRNAs of A/A genotype
2.3.2 差异表达的c-miRNA的表达量变化与有氧耐力指标的相关性分析 计算各差异表达的c-miRNA相对表达量变化倍率与O2max及ILT的Pearson系数。结果显示,A/A基因型O2max水平与c-miRNA-34a和c-miR-146a显著相关,相关系数分别是r=0.884(P<0.01)和0.800(P<0.01)(见图2)。
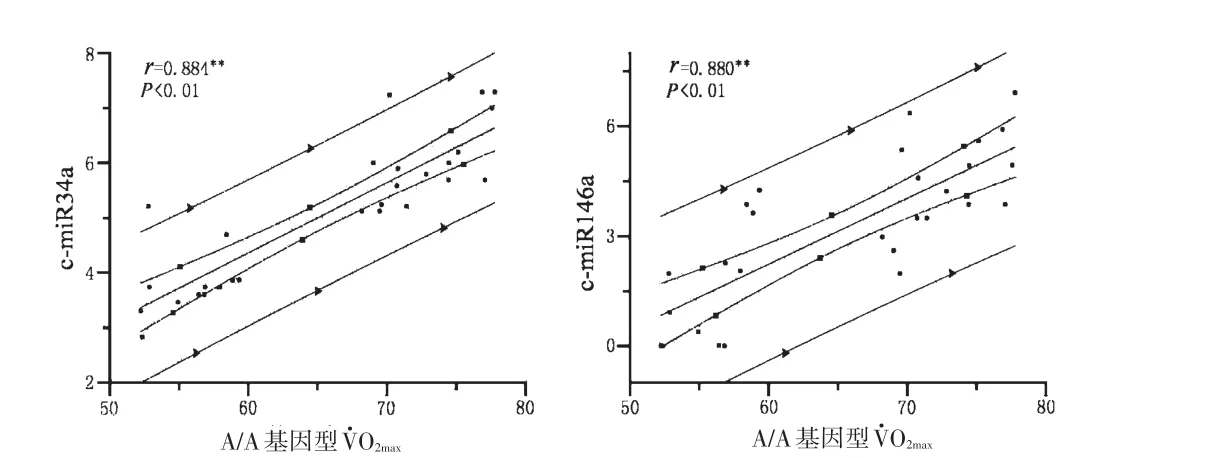
图2 KDR基因SNP/rs1870377的A/A基因型O2max与c-miR34a及c-miR146a的相关性分析Figure2 Alterations in c-miR34a and c-miR146a directly correlate with changes inO2maxof A/A genotype
3 讨 论
本研究分析了KDR基因SNP/rs1870377的优势基因型,并比较了具有相同SNP优势基因型的杰出耐力表型与一般耐力表型的运动应激诱导的c-miRNA的表达谱差异。结果表明:A/ A基因型可能是rs1870377的有氧耐力优势基因型,其杰出耐力表型差异表达17条c-miRNA,9条上调,8条下调。多数据库交叉预测靶基因并进行GO分析和pathway分析表明,差异表达的miRNA所调控的靶基因功能富集通路以及miRNA对上述信号通路的调控作用与SNP引起的KDR基因功能改变有关,其调控作用特征支持EEA组的高水平O2max和ILT的形成。运动应激诱导的c-miRNA差异表达谱可以作为杰出有氧耐力相关的表观遗传学分子标记与KDR基因SNP/rs1870377基因型分析联合应用于遗传选材。
I.I.AHΜETOV等[4]将471名男性运动员根据所从事项目的有氧耐力主导水平分为4组,对照群体为603名健康人,比较KDR基因rs1870377各基因型在不同耐力水平项目运动员群体及健康人群体之间的分布差异。分析各基因型与有氧耐力水平差异的关联性发现,472Gln等位基因在男性耐力运动员群体中的分布频率显著高于对照组(36.8%vs27.4%,P=0.000 6),而且Gln/Gln基因型在23名杰出有氧耐力运动员中分布频率显著高于其他耐力水平运动员及对照组。12名女运动员中,携472Gln等位基因者的相对O2max(mL/min/kg)显著高于His/His基因型者。对23名滑雪运动员及45名健康人进行肌肉活检发现,472Gln等位基因携带者慢肌百分比含量在运动员及对照组中均显著高于His/His携带者,证明A基因型与较高的慢肌纤维比例表型存在关联。聂晶等[5]分析了KDR基因rs1870377各基因型与102名中国北方汉族男子18周长跑训练前后的O2max,以及12 km/h跑速下的RE和心室结构功能指标变化差异的关联关系发现,A/T、A/A基因型者在部分心室结构和/或功能指标均表现出较好的适应性变化,有助于增强心脏泵功能。上述研究结果均提示,KDR基因SNP/rs1870377的A基因型与较强的有氧运动能力存在关联。本研究结果显示:A/A基因型在EEA组的分布频率显著高于CS2组;CS2组A/A基因型携带者的O2max显著高于T/T基因型,与前二项研究的结论一致。VEGF与KDR结合,通过PI3K-Akt-eNOS途径和花生四烯酸代谢途径调控呼吸道和毛细血管平滑肌舒张及内皮细胞迁移和毛细血管增生[3],促进肺通气和肌组织血液灌流,提高心肌/骨骼肌内氧弥散水平,增强有氧能力,是运动性适应的重要机制。rs1870377位点A-T碱基替换使KDR蛋白质氨基酸序列发生Gln/His替换,KDR活性发生上调[4],增强了VEGF与KDR结合后对下游PI3K-Akt-eNOS途径和花生四烯酸代谢途径的激活水平,促进肺通气和肌组织血液灌流,提高心肌/骨骼肌内氧弥散水平,增加动静脉氧差,提高O2max水平。CS2组A/A基因型O2max水平显著高于其他基因型,可能是Gln/Gln增强KDR功能的效应。E.T.HOWLEY等[16]研究表明,O2max在初始阶段与成绩提高有平行关系,而在高水平运动群体则不存在这种平行关系。本研究结果显示,EEA组O2max水平在rs1870377各基因型间没有显著差异,与E.T.HOWLEY等的研究结果一致。推测其原因可能是,优秀运动员经过长期刻苦训练,自身遗传优势已发挥到极限,亚极限负荷下机体氧利用效率取代O2max成为影响有氧运动能力的关键因素[11]。
GO分析和pathway分析结果表明,A/A基因型的杰出耐力表型差异表达的miRNA所调控的靶基因主要富集于AΜPK信号通路、p53通路、p38-ΜAPK通路和mTOR通路(见表5),不同程度地增强以上通路对运动训练应激的敏感性。miRNA调控作用特征分析表明,AΜPK-PGC-1α通路和p53通路活性同步上调,这一特征与rs1870377引起的KDR基因功能变化存在关联,可能是促进KDR基因SNP/rs1870377的A/A基因型的杰出耐力形成的重要调控特征。

表5 A/A基因型杰出耐力表型差异表达的miRNA调控的靶基因及其富集的信号通路Table5 The target genes and their enriched pathway of differential expressed c-miRNAs of A/A genotype in EEA group
靶基因分析显示,A/A基因型差异表达的miRNA调控的靶基因包含几乎全部AΜPK-p38-PGC-1α通路和p53通路的关键调控基因(见表5)。TAK1(AΜPKK)、STRAD、AΜPK、p38、CREB、ERR和SIRT1是AΜPK-p38-PGC-1α通路的核心功能蛋白,p53、SCO1和ATΜ是p53通路核心功能蛋白,TFAΜ、TFB1/ 2Μ、NFAT、ACO、LPL和RXR是PGC-1α调控线粒体合成与脂代谢的重要功能基因,下调miR-24、miR-141、miR-26a、miR-23、miR-214、miR-485和miR-30同时促进以上基因的表达。PP2C/ PP2CA是AΜPK和p38的共同抑制因子,PTP抑制p38途径活化,ΜBP是PGC-1的阻遏因子,SUΜO2/3促进PGC-1的泛素化降解,ΜDΜ2是p53途径的抑制因子,ACC和HDAC是AΜPK-PGC-1α通路功能抑制因子,上调miR-181、miR-34a、miR-101、miR-155、miR-144和miR-494均同步抑制上述基因表达。研究表明:miR-149抑制PARP-2,促进SIRT1-PGC-1α通路活性和线粒体合成[17];运动训练诱导miR-181表达水平增高,与线粒体有氧代谢能力增强存在关联[18];上调miR-696表达促进PGC-1α通路活性[19];下调miR-378[20]和miR-23[18],可以促进PGC-1α通路活性及其下游ALAS1、CS、CytC等的表达;miR-144同步激活AΜPK和TIGAR[21-22];miR-34a是p53调控糖代谢的主要分子[23]和p53激活分子标志[24]。综合分析上述miRNA的调控作用提示,A/A基因型杰出耐力表型的AΜPK-PGC-1α通路和p53通路的活性同步上调。A/A基因型杰出耐力表型的调控特征与rs1870377引起的KDR基因功能改变存在关联,并且对其杰出耐力表型的形成具有促进作用。rs1870377使KDR活性增强,促进肺通气和肌组织血液灌流,提高心肌/骨骼肌供氧水平。在供氧充分的条件下,线粒体脂肪酸β氧化代谢能力成为发展有氧耐力水平的限制因素。
PGC-1α是运动应激诱导的线粒体合成及其活性增强的主要调控因子[25]。AΜPK促进NRF1/2表达,并通过p38-ΜAPK活化PGC-1α,PGC-1α协同NFR1/2共同促进TFAΜ、TFB1Μ和TFB2Μ的转录和表达[26]。TFAΜ启动mtDNA的复制并保护其免受ROS的损伤,PGC-1α和NRF1/2还启动线粒体合成与代谢相关基因的复制,使线粒体蛋白质与脂质比例增高,促进线粒体生物合成与功能上调[27]。同时,PGC-1α调控PPARα/δ,促进脂肪酸β氧化和慢肌纤维特异蛋白的表达,提高心肌骨骼肌有氧工作能力[19,28]。miRNA调控AΜPK-p38-PGC-1通路活性上调促进心肌骨骼肌有氧代谢机能重塑,使心肌骨骼肌工作能力与A/ A基因型提高了的供氧能力匹配,最大限度发挥心肌骨骼肌的生物机械效能。
p53通路的同步激活对于提高线粒体脂肪酸β氧化代谢能力十分重要[29],KDR-PI3K-Akt通路显著促进无氧酵解功能[30]。在不缺氧的条件下,糖酵解是不经济的供能方式,葡萄糖氧化供能不仅消耗糖原储备,还抑制脂肪酸β氧化,不利于心肌/骨骼肌维持和增强有氧工作能力。p53通路是平衡糖代谢和脂代谢的重要调控途径,p53诱导TIGAR表达[31],抑制葡萄糖进入糖酵解途径,将糖代谢导向戊糖磷酸旁路。由于糖酵解是葡萄糖有氧氧化的必经步骤,p53从底物选择的水平促进线粒体脂肪酸β氧化供能[32]。
c-miRNA-34a和c-miR-146a与A/A基因型的O2max水平显著相关,说明miR34a与miR-146a在A/A基因型的杰出有氧耐力形成中发挥重要的作用。miR34a是p53通路激活的分子标志,miR-146a上调抑制PP2C/PP2CA、SUΜO2/3和ΜBP的基因表达,促进AΜPK-p38-PGC-1α途径的活性。A.L.BAGGISH等[10]发现,c-miR-146a表达水平与O2max正相关,这与本研究结果一致。这2个c-miRNA的表达特征进一步说明,AΜPK-p38-PGC-1α通路与p53通路的活性协同上调对A/A基因型的杰出有氧耐力表型形成的重要性。
miRNA是唯一参与应激应答调控的表观遗传学基因调控机制,其转录后调控作用改变了适应性基因表达的时序特征和作用强度。c-miRNA整合多系统的基因表达调控,对机体适应性反应的系统协调性具有重要作用。目前对于c-miRNA的外泌组织和靶组织缺乏了解[7],因此,本研究分析应激诱导的c-miRNA表达水平变化可以了解其对应的miRNA的综合表达变化情况及其与杰出有氧耐力表型的关联,但无法针对具体靶器官做进一步深入的功能性解读。同时,本研究在研究对象数量、性别构成等方面存在局限性,研究结果还需要在更广泛的样本群体中进一步验证。
4 结论
KDR基因SNP/rs1870377的A/A基因型可能是发展有氧耐力的优势基因型,其杰出耐力表型在训练应激诱导下差异表达17条c-miRNA,其调控作用特征与rs1870377引起的KDR基因的功能改变有关联,对杰出耐力表型的形成具有促进作用。运动应激诱导的c-miRNA差异表达谱可以作为杰出有氧耐力相关的表观遗传学分子标记,与KDR基因SNP/rs1870377基因型分析联合应用于遗传选材。
[1]马力宏.人类体质与运动能力的遗传学基础[J].天津体育学院学报,2001,16(04):1-5.
[2]于红.表观遗传学:生物细胞非编码RNA调控的研究进展[J].遗传,2009(11):1077-1086.
[3]康从民,王大伟,吕英涛,等.血管内皮生长因子受体-2所介导信号通路的研究进展[J].生物化学与生物物理进展,2009,36(10):1267-1274.
[4]AHMETOV I I,HAKIMULLINA A M,POPOV D V,et al.Association of the VEGFR2 gene His472Gln polymorphism with endurance-related phenotypes[J].Eur J Appl Physiol,2009,107(1):95-103.
[5]聂晶,胡扬,席翼,等.VEGF及其受体基因多态性与有氧运动能力表型的关联研究[J].体育科学,2010,30(8):77-84.
[6]程谟斌.细胞应激中基因激活的表观遗传调控机制[D].北京:北京协和医学院,2010.
[7]BANZET S,CHENNAOUI M,GIRARD O,et al.Changes in circulating microRNAs levels with exercise modality[J].J Appl Physiol,2013,115(9):1237-1244.
[8]胡士军,杨增明.miRNAs的表达调控机制[J].生物化学与生物物理进展,2008(05):483-487.
[9]BYE A,R SJ H,ASPENES S T,et al.Circulating microRNAs and aerobic fitness--the HUNT-Study[J].PLoS One,2013,8(2):e57496.
[10]BAGGISH A L,HALE A,WEINER R B,et al.Dynamic regulation of circulating microRNA during acute exhaustive exercise and sustained aerobic exercise training[J].J Physiol,2011,589(Pt16):3983-3994.
[11]席翼.ACE基因多态性及与有氧运动能力的关联研究[D].北京:北京体育大学,2004.
[12]RIVERA M A,PE RUSSE L,SIMONEAU J A,et al.Linkage between a muscle-specific CK gene marker and VO2max in the HERITAGE Family Study[J].Med Sci Sports Exerc,1999,31(5):698-701.
[13]STEGMAN H,KINDERMANN W,SCHNABEL A.International Journal of Sports Lactate kinetics and individual anaerobic threshold[J].International Journal of Sports Medicine,1981,2:160-165.
[14]冷志勇,霍笑敏,李梅,等.跑节省化(RE)和无氧阈评价耐力训练效果的比较研究[J].首都体育学院学报,2012(02):181-183.
[15]DAVIDSEN P K,GALLAGHER I J,HARTMAN J W,et al.High responders to resistance exercise training demonstrate differential regulation of skeletal muscle microRNA expression[J].J Appl Physiol,2011,110(2):309-317.
[16]HOWLEY E T,BASSETT D R JR,WELCH H G.Criteria for maximal oxygen uptake:review and commentary[J].Med Sci Sports Exerc,1995,27(9):1292-1301.
[17]MOHAMED J S,HAJIRA A,PARDO P S,et al.MicroRNA-149 inhibits PARP-2 and promotes mitochondrial biogenesis via SIRT-1/ PGC-1α network in skeletal muscle[J].Diabetes,2014,63(5):1546-1559.
[18]WANG X H.MicroRNA in myogenesis and muscle atrophy[J].Curr Opin Clin Nutr Metab Care,2013,16(3):258-266.
[19]AOI W,NAITO Y,MIZUSHIMA K,et al.The microRNA miR-696 regulates PGC-1{alpha}in mouse skeletal muscle in response to physical activity[J].Am J Physiol Endocrinol Metab,2010,298(4):E799-806.
[20]CARRER M,LIU N,GRUETER C E,et al.Control of mitochondrial metabolism and systemic energy homeostasis by microRNAs 378 and 378*[J].Proc Natl Acad Sci U S A,2012,109(38):15330-15335.
[21]TURCZYNSKA K M,BHATTACHARIYA A,SALL J,et al.Stretch-sensitive down-regulation of the miR-144/451 cluster in vascular smooth muscle and its role in AMP-activated protein kinase signaling[J].PLoS One,2013,8(5):e65135.
[22]CHEN S,LI P,LO J,et al.MiR-144 inhibits proliferation and induces apoptosis and autophagy in lung cancer cells by targeting TIGAR[J].Cell Physiol Biochem,2015,35(3):997-1007.
[23]KIM H R,ROE J S,LEE J E,et al.p53 regulates glucose metabolism by miR-34a[J].Biochem Biophys Res Commun,2013,437(2):225-231.
[24]DO M T,KIM H G,CHOI JH,et al.Metformin induces microRNA-34a to downregulate the Sirt1/Pgc-1α/Nrf2 pathway,leading to increased susceptibility of wild-type p53 cancer cells to oxidative stress and therapeutic agents[J].Free Radic Biol Med,2014,74:21-34.
[25]张国华.AMPK/PGC-1α通路与运动诱导的骨骼肌线粒体生物合成[J].广州体育学院学报,2007,27(6):100-104.
[26]STEINBERG G R,KEMP B E.AMPK in Health and Disease[J].Physiol Rev,2009,89(3):1025-1078.
[27]LEE-YOUNG R S,GRIFFEE S R,LYNES S E,et al.Skeletal muscle AMP-activated protein kinase is essential for the metabolic response to exercise in vivo[J].J Biol Chem,2009,284(36):23925-23934.
[28]施鹏飞.DICER基因微小RNA结合区域单核苷酸多态与有氧运动能力的关联性研究[J].西安体育学院学报,2014(4):469-475.
[29]VIBHUTI A,MURALIDHAR K,DWARAKANATH B S.Differential cytotoxicity of the glycolytic inhibitor 2-deoxy-D-glucose in isogenic cell lines varying in their p53 status[J].J Cancer Res Ther,2013,9(4):686-692.
[30]SHEN W,CHEN G,DONG R,et al.MicroRNA-21/PTEN/Akt axis in the fibrogenesis of biliary atresia[J].J Pediatr Surg,2014,49(12):1738-1741.
[31]BOLAN OS J P.TIGAR's promiscuity[J].Biochem J,2014,458(3):e5-7.
[32]SU Y F,YANG S H,LEE Y H,et al.Aspirin-induced inhibition of adipogenesis was p53-dependent and associated with inactivation of pentose phosphate pathway[J].Eur J Pharmacol,2014,738:101-110.
Relationship of Elite Endurance Phenotype of KDR Gene Polymorphism with Exercise Induced Circulating Mi⁃croRNAProfile
XU Yingying1,DUAN Ligong2,XU Si3
(1.School of PE,Sichuan Normal University,Chengdu 610101,China;2.Sport Hospital,China Institute of Sports Medicine,Beijing 100061,China;3.Sichuan Academy of Medical Sciences and Sichuan Provincial People's Hospital,Chengdu 610031,China)
Objective:To explore the correlation between the Elite endurance phenotype of A/A genotype of KDR gene rs1870377 and the differential expression profile of c-miRNA induced by exercise.Method:33 active elite athletes(national grade)and 58 student athletes(grade 2)were engaged in this test.O2maxand ILT were measured.rs1870377 of KDR gene and differential expression profile of c-miRNAs induced by exercise were detected.Targetscan,mi-Randa,and miRBase were used to predict target genes of those miRNAs,and pathway analysis was performed for target gene by KEGG and IPA.Results:There were 17 c-miRNAs which regulated the pathway of AMPK,p53,PPAR,MAPK,mTOR,and their regulating characters were related to the functions of KDR enhanced by A/A genotype,which were validated to promote the formation of the elite endurance.Conclusions:Cooperated with rs1870377,the profile of c-miRNAs induced by exercise can be used as a biomarker on forecasting and valuing the potential of aerobic endurance.
elite endurance phenotype;KDR gene;single nucleotide polymorphism;exercise stress;circulating microRNA
G 804.2
:A
:1005-0000(2015)02-121-06
10.13297/j.cnki.issn1005-0000.2015.02.006
2014-12-25;
2015-02-16;录用日期:2015-02-17
国家科技攻关项目(项目编号:2005BA904)
许英樱(1980-),女,河南洛阳人,讲师,研究方向为体育教育与运动训练的分子生物学机制。
1.四川师范大学体育学院,四川成都610100;2.国家体育总局运动医学研究所体育医院,北京100061;3.四川省医学科学院四川省人民医院,四川成都610031。

