流感病毒多表位核酸疫苗CTB-Eg的构建与细胞转染研究*
寇静远 潘兴 李婉宜 邝玉 周琳琳 杨靖 石新丽 陆顺顺黄筱钧 邓昭敏 秦臻 王保宁 李明远
(1.四川大学华西基础医学与法医学院微生物教研室, 四川 成都 610041;2.湖北医药学院微生物学教研室, 湖北 十堰 442000)
流感病毒多表位核酸疫苗CTB-Eg的构建与细胞转染研究*
寇静远1潘兴1李婉宜1邝玉1周琳琳1杨靖2石新丽1陆顺顺1黄筱钧1邓昭敏1秦臻1王保宁1李明远1
(1.四川大学华西基础医学与法医学院微生物教研室, 四川 成都 610041;2.湖北医药学院微生物学教研室, 湖北 十堰 442000)
目的 设计并构建含分子内佐剂的流感病毒多表位核酸疫苗CTB-Eg,初步研究其在HEK293T细胞中的转染效率。方法 通过生物信息学软件设计并合成了含分子内佐剂的流感病毒多表位基因CTB-Eg,将其插入真核载体pEGFP-C2中,获得了重组质粒pEGFP-C2/CTB-Eg;用脂质体法转染HEK293T细胞,通过荧光显微镜观察和PCR法检测其转染效率。结果 成功构建了真核表达质粒pEGFP-C2/CTB-Eg,且该重组质粒能在HEK293T细胞中瞬时转染, 转染效率在50%~70%之间。结论 本研究成功设计、构建了CTB-Eg融合基因,其在HEK293T细胞中转染效率较高,为流感病毒多表位核酸疫苗CTB-Eg在小鼠体内的抗病毒作用研究奠定了坚实基础。
流感病毒; 核酸疫苗; 多表位基因; 霍乱毒素B亚单位
季节性流感至少影响着全球15% 的人口,每年约有50 万人死于流感[1~4]。同其他病毒性疾病一样,流感的防治尚无特别有效的方法,接种疫苗被认为是预防流感发生与传播的最佳方法。目前使用的流感疫苗主要是以血凝素(Hem- agglutinin,HA)和神经氨酸酶(Neuraminidase,NA)作为靶抗原。然而HA基因很容易发生变异,针对特定流感病毒株的疫苗不能对其他的病毒株产生相应的保护性。因此,研发能够诱导广谱免疫反应的通用流感疫苗已经成为流感疫苗研究的重要趋势[5、6]。本研究将前期设计合成的新型流感病毒多表位基因Eg[7]与分子内佐剂CTB串联,连接至真核表达载体pEGFP-C2中,构建了流感病毒多表位核酸疫苗CTB-Eg,并对其在真核细胞HEK293T中的转染效率做了初步研究,为流感病毒多表位核酸疫苗CTB-Eg在小鼠体内的抗病毒作用研究奠定了坚实基础。
1 材料与方法
1.1 实验材料 大肠杆菌DH5α菌株由本教研室保存;真核表达质粒pEGFP-C2购自ATCC(America Type Culture Collection);人胚肾HEK293T(Human embryonic kidney 293)细胞源自美国ATCC;转染试剂Lipofectamine TM 2000 、胶回收试剂盒和质粒提取试剂盒均购自Invitrogen公司;PCR试剂盒(SinoBio 2× Taq Master Mix)、Trizol试剂、T4连接酶、限制性内切酶EcoR I和Hind III购自TAKARA公司;青霉素和卡那霉素为北京百泰克生物技术有限公司;DMEM、RPMI-1640细胞培养基购自Gibco公司,新生小牛血清购自中美合资兰州民海生物工程有限公司;96孔培养板、24孔培养板和6孔培养板为Corning 公司产品。
1.2 实验方法
1.2.1 CTB-Eg的设计与合成 为了增加流感病毒多表位核酸疫苗的抗原性及靶向性,选择兼具神经节苷脂结合活性及粘膜佐剂活性的霍乱肠毒素B亚单位(CTB)作为分子内佐剂,重新设计并合成了分子内佐剂-流感病毒多表位基因融合疫苗CTB-Eg,并通过ProPred、SWISS-MODEL等生物信息学软件,对CTB-Eg蛋白进行了3维建模。目的片段Eg、CTB及CTB-Eg 均由华大基因合成。合成的puc57/CTB、puc57/Eg、puc57/ CTB-Eg质粒通过EcoR Ⅰ和Hind Ⅲ酶切位点分别进行单、双酶切鉴定,并回收双酶切产物。
1.2.2 重组真核表达质粒pEGFP-C2/CTB-Eg的构建 pEGFP-C2质粒经EcoR Ⅰ和Hind Ⅲ双酶切胶回收后,在T4 DNA连接酶的作用下,分别与目的片段CTB、Eg和CTB-Eg连接,载体与目的片段摩尔比为1∶10。连接产物转化感受态大肠杆菌DH5α,在含有卡那霉素的LB平板上筛选克隆。挑取阳性克隆,摇菌扩增,DNA抽提试剂盒提取质粒,并进行单、双酶切鉴定和基因测序鉴定。
1.2.3 HEK293T细胞的培养和转染 HEK293T细胞株于37℃、5%的CO2条件下, 在含10%胎牛血清、100 μg/ml青霉素及100 U/ml链霉素的DMEM高糖培养基中进行培养。将生长良好的细胞用上述完全培养基调至2×105~5×105/ml后按2 ml/孔分装至6孔板中,待细胞贴壁生长至大约70%覆盖密度时进行质粒DNA转染。转染采用Lipofectamine TM 2000试剂,按pEGFP-C2、pEGFP-C2/CTB、pEGFP-C2/Eg、pEGFP-C2/CTB-Eg质粒DNA 0.2 g/孔、转染试剂1 μl/孔对细胞进行转染,同时设立不进行转染的细胞对照孔。转染细胞培养48 h后,在倒置荧光显微镜下,利用pEGFP-C2质粒自带的EGFP标签检测重组质粒的转染效率。
1.2.4 PCR法检测重组质粒在HEK293T细胞中的转染情况 分别设计CTB、Eg、CTB-Eg引物各一对,引物序列见表1。转染细胞培养48小时后,利用普通PCR法检测重组质粒在HEK293T细胞中的转染情况。

表1 PCR扩增CTB、Eg、CTB-Eg 3者的引物序列
2 结果
2.1 CTB-Eg结构示意图及其3级结构 在前期构建的流感病毒多表位基因Eg[7]的N末端添加已去除信号肽的CTB序列,GGGGS为二者的连接序列,进而构建了流感病毒多表位核酸疫苗CTB-Eg,见图1。CTB-Eg三级结构显示Linker序列GGGGS、AAY有效地维持了各个抗原的空间结构,避免了抗原表位间的相互干扰,见图2。
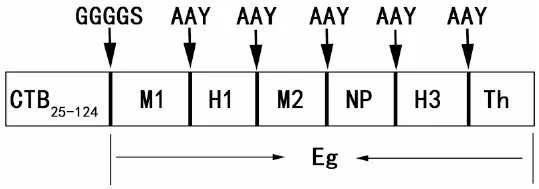
图1 CTB-Eg构建示意图
Fig. 1 Schematic representation of the designed multi-epitope vaccine CTB-Eg
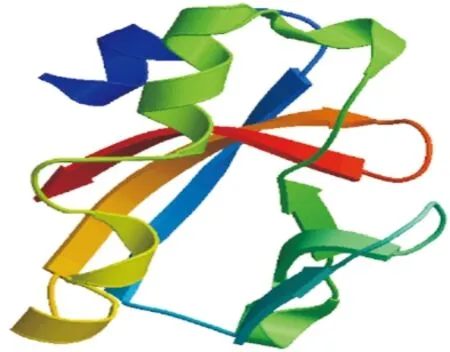
图2 SWISS-MODEL预测CTB-Eg的3级结构
Fig. 2 Three dimensional (3D) structure information of CTB-Eg.
2.2 CTB、Eg、CTB-Eg目的片段和真核载体pEGFP-C2的鉴定 puc57/CTB、puc57/Eg、puc57/ CTB-Eg及pEGFP-C2质粒分别经EcoR I和Hind III进行单、双酶切,经1.5%的琼脂糖凝胶电泳,可分别在312 bp、264 bp、579 bp和4700 bp处出现明显条带,见图3,与目的片段及载体pEGFP-C2片段大小一致。
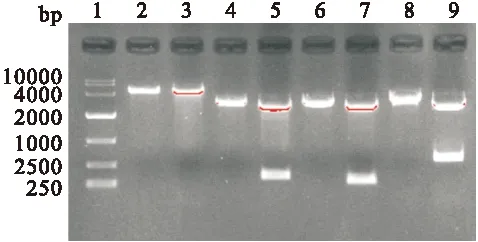
图3 1.5%琼脂糖凝胶电泳检测目的基因片段大小
Fig.3 Restriction analysis of recombinant plasmids
1: DNA Maker;2、3:pEGFP-C2载体单、双酶切 ;4、5:puc57/CTB单、双酶切;6、7:puc57/Eg单、双酶切;8、9:puc57/CTB-Eg单、双酶切
2.3 重组质粒的酶切鉴定及测序鉴定 重组质粒pEGFP-C2/CTB、pEGFP-C2/Eg、 pEGFP-C2/CTB-Eg 分别进行EcoR I、Hind III单、双酶切鉴定,1.5%琼脂糖凝胶电泳显示获得了312 bp、264 bp、579 bp的插入片段,见图4。测序结果同样证实所获目的片段与设计的基因序列完全一致,无碱基突变。
2.4 荧光显微镜观察重组质粒转染HEK293T细胞 重组质粒pEGFP-C2/CTB、pEGFP-C2/Eg、 pEGFP-C2/CTB-Eg转染HEK293T细胞48 h后,荧光显微镜观察EGFP绿色荧光信号。结果可见重组质粒转染HEK293T细胞的转染效率达50%~70%,对照孔未见荧光,见图5。
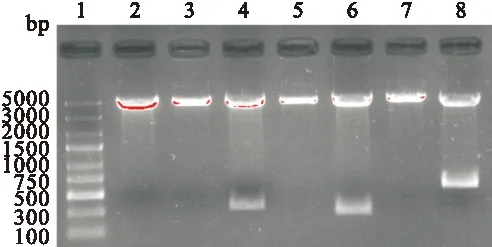
图4 重组真核表达质粒EcoR I和Hind III单、双酶切分析
Fig. 4 Restriction analysis of recombinant plasmids.
1: DNA Maker;2:pEGFP-C2载体双酶切 ;3、4:pEGFP-C2/CTB单、双酶切;5、6: pEGFP-C2/Eg单、双酶切;7、8:pEGFP-C2/ CTB-Eg单、双酶切
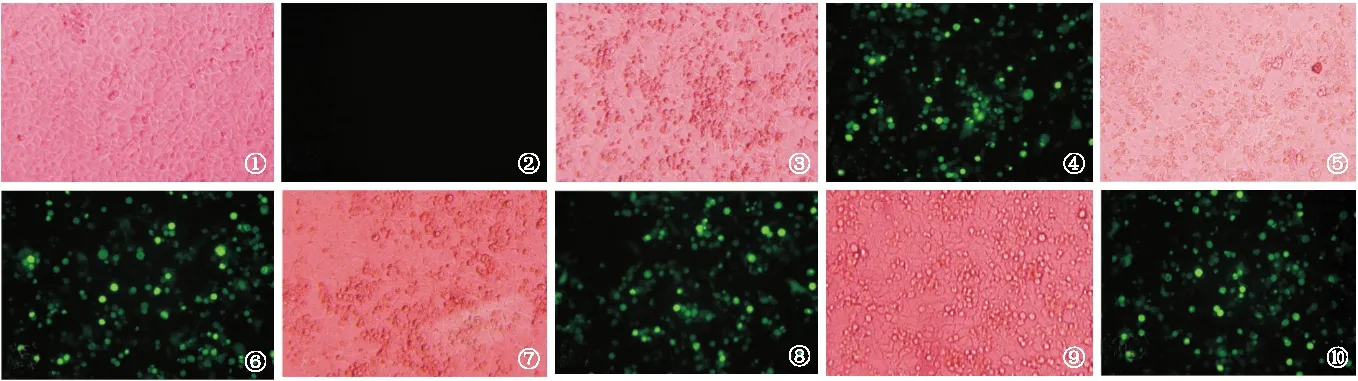
图5 荧光显微镜检测各组重组质粒在HEK293T细胞中的转染效率(×200)
Fig.5 Fluorescence microscope detection of the transfection effiencyof recombinant plasmids.
①、②:空白组;③、④:pEGFP-C2组;⑤、⑥:pEGFP-C2/CTB组;⑦、⑧:pEGFP-C2/Eg组;⑨、⑩:pEGFP-C2/CTB-Eg组
2.5 PCR法鉴定重组质粒转染HEK293T 重组质粒转染HEK293T细胞48小时后,利用普通PCR法检测重组质粒在293T细胞中的转染情况。经1.5%的琼脂糖凝胶电泳,可分别在312 bp、264 bp和579 bp处出现条带,与目的片段大小一致,见图6。
3 讨论
流感病毒独特的基因结构导致其极易发生变异,而新病毒株的出现意味着那些接种过传统流感疫苗的人群对新出现的流行株同样敏感。因此,流感疫苗的研究焦点是研发对不同亚型流感病毒都具有交叉保护作用的通用型长效疫苗,而多表位基因疫苗的构想有望实现这一目标。
多表位核酸疫苗可在宿主细胞系统中转录并表达多个不同的保护性抗原表位,从多个方面诱导机体
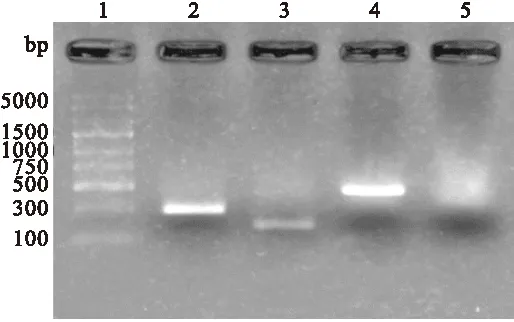
图6 PCR检测各组质粒在HEK293T细胞中的转染情况
Fig. 6 PCR analysis of the transfection of recombinant plasmids.
1:DNA Maker; 2: pEGFP-C2/CTB组;3: pEGFP-C2/Eg组;4: pEGFP-C2/CTB-Eg组; 5: pEGFP-C2载体组
的免疫应答,是一种具有广谱免疫反应的通用疫苗。且DNA疫苗在体内有长期持久的免疫原性,其表达蛋白的结构类似于正常真核细胞的表达结构[8]。DNA编码的相关蛋白作为内源性抗原经由MHC-Ⅰ类途径加工处理后,表达于抗原提成细胞(antigen presenting cell, APC)表面,进一步刺激细胞毒性T细胞的活化。抗原肽也可作为分泌性蛋白,通过B细胞表面抗原受体直接识别结合进而摄取抗原,并经MHC-Ⅱ类途径加工处理后形成的抗原肽,以抗原肽-MHC-Ⅱ类分子复合物的形式转运到细胞表面,供CD4+ Th细胞识别,从而启动特异性体液免疫应答,同时产生记忆B细胞参与二次免疫,保护宿主免受相关微生物的攻击[9]。
Graeme等研究表明NP和M2的表达可显著降低流感病毒在小鼠之间的传播[10]。Donnelly等构建了含有不同流感病毒株HA、M1和NP的融合DNA疫苗,该疫苗可以有效的提高小鼠的免疫保护率[11]。还有研究证实,含有HA基因的DNA疫苗加上NP或M基因,被免疫的小鼠可以抵抗不同亚型的流感病毒[12,13],其中M1或NP基因能提高疫苗的保护性并使免疫小鼠抵抗不同亚型流感病毒的攻击,而M2基因对免疫小鼠缺乏有效的保护作用[14]。流感病毒感染人体后,只有1%~2%的人会产生抗M2e抗体,该抗体可能通过与感染细胞结合,介导CD+8 T细胞的杀细胞过程[15]。本研究从HA蛋白选择了2个B细胞表位,分别在NP、M1、M2蛋白选择了3个T细胞表位。既保留HA表位良好的抗原性及诱导中和抗体的能力,又可能通过高度保守的M、NP蛋白克服HA高度变异所导致的疫苗交叉保护性弱的问题。为防止DNA疫苗在体内非特异性降解而导致的效率减弱及各表位间相互抑制的问题,课题中我们将所选取的5个表位通过不同排列方式串联组合,通过生物信息学分析评估,选取最佳组合方式,加上适当的间隔序列设计成流感通用多表位基因疫苗Eg。
霍乱毒素(cholera toxin,CT)是最常用的免疫佐剂之一,由霍乱弧菌(Vibrio cholerae)分泌,分子量大小为84 kD,具有很强的免疫原性和粘膜免疫佐剂性。CT的结构为一个A亚单位、五个B亚单位。CTB分子量大小为11.6 kD,五分子的CTB通过盐键和氢建聚集成56 kD的大亚基,呈圆筒状,与真核细胞表面的神经节苷脂GM1结合,可使连接的抗原与粘膜作用,进而引起一系列的生化反应,产生更强的免疫效果[16]。CTB可促进抗原通过粘膜屏障,加强抗原被树突状细胞和其他抗原提呈细胞的提呈作用,增强抑制性T细胞分泌TGF-β。重组CTB去除了CTA的毒性,保留了霍乱毒素的免疫佐剂性,从而使机体产生较强的系统免疫应答和局部黏膜免疫应答[17,18]。因此,在多表位核酸疫苗的设计中,我们在其N末端添加霍乱毒素B亚单位(cholera toxin B subunit, CTB)作为分子内佐剂,期望能增强疫苗的免疫效果。
4 结论
本实验将流感多表位基因Eg与分子内佐剂CTB串联,连接至真核表达载体pEGFP-C2中,构建了流感病毒多表位核酸疫苗CTB-Eg,并对其在真核细胞HEK293T中的转染情况做了初步研究,为下一步流感病毒多表位核酸疫苗CTB-Eg在小鼠体内的抗流感作用研究奠定了实验基础。
[1]Meng S, L.Z., Xu L,etal. Intranasal immunization with recombinant HA and mast cell activator C48/80 elicits protective immunity against 2009 pandemic H1N1 influenza in mice[J]. PLoS One, 2011, 6(5): e19863.
[2]Ferraris O, E.V., Bouscambert M,etal. H1N1 influenza A virus neuraminidase modulates infectivity in mice[J]. Antiviral Res, 2012, 93(3): 374-380.
[3]Imai M, Watanabe T, Hatta M,etal. Experimental adaptation of an influenza H5 HA confers respiratory droplet transmission to a reassortant H5 HA/H1N1 virus in ferrets[J]. Nature, 2012, 486(7403): 420-428.
[4]Seasonal influenza: World Health Organization, Copenhagen, Denmark (2009). (www.euro.who.int/influenza/2008618_1).
[5]Girard MP, Cherian T, Pervikov Y,etal. A review of vaccine research and development: human acute respiratory infections[J]. Vaccine, 2005, 23 (50): 5708-5724.
[6]陈则.通用流感疫苗进展研究[J]. 湖南师范大学学报(医学版),2012, 9 (3):1-5.
[7]邵京京,丰锋,张强,等.流感病毒多表位基因盒的设计与预测[J].华西药学杂志,2012,27(005):486-489.
[8]Alarcon JB, Waine GW, McManus DP. DNA vaccines: technology and application as anti-parasite and anti-microbial agents[J]. Adv Parasitol, 1999, 42: 343-410.
[9]Kishwar Hayat Khan. DNA vaccine: roles against diseases[J]. Germs, 2013, (3)1: 27-35.
[10] Graeme E. Price, Chia-Yun Lo,etal. Mucosal Immunization with a Candidate Universal Influenza Vaccine Reduces Virus Transmission in a Mouse Model[J]. Journal of Virology, 2014, 88(11): 6019-6030.
[11] Donnelly JJ, Friedman A, Ulmer JB,etal. Further protection against antigenic drift of influenza virus in a ferret model by DNA vaccination[J]. Vaccine, 1997, 15(8): 865-868.
[12] Chen Q, Kuang H, Wang H,etal. Comparing the ability of a series of viral proteinexpressing plasmid DNAs to protect against H5N1 influenza virus[J]. Virus Genes, 2009, 38(1): 30-38.
[13] Chen Z, Yoshikawa T, Kadowaki S,etal. Protection and antibody responses in different strains of mouse immunized with plasmid DNAs encoding influenza virus haemagglutinin, neura-minidase and nucleoprotein [J]. J Gen Virol, 1999, 80(10): 2559-2564.
[14] M. Zheng, J. Luo, Z. Chen. Development of universal influenza vaccines based on influenza virus M and NP genes[J]. Infection, 2014, 42(2): 251-262.
[15] Oxford JS. Towards a universal influenza vaccine: volunteer virus challenge studies in quarantine to speed the development and subsequent licensing[J]. Br J Clin Pharmacol, 2013, 76(2): 210-216.
[16] Hiramatsu Y, Yamamoto M, Satho T,etal. Recombinant fusion protein of cholera toxin B subunit with YVAD secreted by Lactobacillus casei inhibits lipopolysaccharide-induced caspase-1 activation and subsequent IL-1 beta secretion in Caco-2 cells[J]. BMC Biotechnol, 2014, 14(1): 38.
[17] Sun JB, Raghavan S, Sjoling A,etal. Oral tolerance induction with antigen conjugated to cholera toxin B subunit generates both Foxp3+ CD25+ and Foxp3+ CD25+ CD4+ regulatory T cells[J]. Immunol, 2006, 177(11): 7624-7644.
[18] Luci C, Hervouet C, Rousseau D,etal. Dendritic cell-mediated induction of mucosal cytotoxic responses following intravaginal immunization with the nontoxic B subunit of cholera toxin[J]. Immunol, 2006, 176(5): 2749-2757.
Construction and transfection of a multi-epitope DNA vaccine CTB-Eg of influenza
KOU Jing-yuan1, PAN Xing1, LI Wan-yi1,etal
(1.DepartmentofMicrobiology,WestChinaSchoolofPreclinicalandForensicMedicine,SichuanUniversity,Chengdu610041,China; 2.DepartmentofMicrobiology,HubeiUniversityofMedicine,Shiyan442000,China)
Objective To design and construct the eukaryotic expression vector of CTB-Eg fusion gene of influenza virus, and study the transfection efficiency of pEGFP-C2/CTB-Eg in HEK293T cells. Methods CTB-Eg fusion gene containing CTB (cholera toxin B subunit) as the molecule adjuvant was designed and synthesized. The eukaryotic expression vector of pEGFP-C2/CTB-Eg was constructed. The certified recombinant plasmid was transfected in HEK293T cells by Liposomal Transfection Reagent. The transfection efficiency of CTB-Eg gene was detected by fluorescence microscope and PCR. Results Expression vector pEGFP-C2/CTB-Eg was constructed successfully. The recombinant plasmid could be transfected in HEK293T cells and its transfection efficiency could reach to 50%-70%. Conclusion The eukaryotic expression vector of pEGFP-C2/CTB-Eg was constructed successfully and transfected in HEK293T cells.
Influenza virus; DNA vaccine; multi-epitope genes; Cholera toxin B subunit
四川省科技厅支撑计划项目(2014SZ0036)
李婉宜,教授,E-mail:hxliwanyi@126.com
R 181.2+4
A
10.3969/j.issn.1672-3511.2015.02.007
2014-07-11; 编辑: 张文秀)

