葡萄皮色素和黑米色素稳定性比较研究
黄士文,孙志栋,张方刚
(1.慈溪市横河镇农业办公室,浙江慈溪315318;2.宁波市农科院315300;3.宁波烛湖酒业有限公司315318)
葡萄皮色素和黑米色素稳定性比较研究
黄士文1,孙志栋2,张方刚3
(1.慈溪市横河镇农业办公室,浙江慈溪315318;2.宁波市农科院315300;3.宁波烛湖酒业有限公司315318)
通过不同pH、糖浓度、酒精度对黑米色素和葡萄皮色素及复配色素在不同条件下花色苷稳定性研究。比较了两种色素的稳定性差异,除了在酸性环境条件下(pH值3~5)葡萄皮色素的稳定性高于黑米色素外。其他在不同糖浓度条件下,黑米色素稳定性高于葡萄皮色素,它们的稳定性与糖浓度之间均呈正相关关系。在不同乙醇浓度条件下,黑米色素稳定性也高于葡萄皮色素。复配色素在(乙醇浓度15%、pH3.0)和(糖度10%、pH3.0)条件下稳定性随着黑米色素成分的增加而上升。因而黑米色素在不同条件下相对葡萄皮色素更稳定。
黑米色素;葡萄皮色素;花色苷;稳定性
0 前言
人工合成色素大多以煤焦油为主原料。既没有营养价值,又会对人体产生危害,许多国家已禁止使用。来源于动植物的天然色素,特别是从可食性植物中提取的天然色素,使用安全性高,色泽自然,多数兼有营养保健和着色的双重作用,因而备受人们的青睐[1]。 葡萄皮色素和黑米色素均为天然色素,主要应用于果酒和果汁加工中。葡萄皮和黑米中主要的色素为花青素,花青素与各种单糖以糖苷键结合形成的化合物,称为花色苷[2]。花色苷是葡萄皮和黑米色素的主要成分,易溶于水、乙醇和甲醇,不溶于乙醚、石油醚、乙酸乙醋等有机溶剂。花色苷类色素是一类具有保健功能的天然活性物质,还具有抗氧化、捕获氧自由基的能力,对某些疾病的发生有防治作用[3],因而葡萄皮和黑色素的发展前景被一致看好。但是它们应用于不同食品后色素的稳定性如何,尚无研究报道。
花色苷稳定性较差,在水溶液中极易受到水分子的亲核进攻而水解,易受pH值、温度、有机酸、光照、氧、金属离子、糖、酶等的影响而发生变化[2-3]。
pH值是影响花色苷稳定性的重要因素。在不同的pH值下花色苷存在形式不同;一般单糖花色苷在pH值小于2时花色苷以2-苯基苯并吡喃阳离子(AH+)的形式存在;pH值为4~5时,花色苷主要以醌型假碱(B)或查尔酮(C)存在,pH值大于6时花色苷主要以醇型(A)存在。pH值通过影响花色苷的存在形式改变花色苷的热稳定性[4]。pH值越低,花色苷的稳定性越强。其颜色随pH不同而改变,非酰化和单酰化的花色苷在pH值很低时,其溶液呈现最强红色。在pH3.0以下时显鲜艳的玫瑰红色,随着pH值的增大,花色苷的颜色将褪至无色,在pH 7.0以上时颜色有红色变紫色,随pH值加大颜色由浅变深,在pH 13.0时变成紫黑色[5]。但是,具有两个或两个以上酰基的花色苷在整个pH范围内都表现出了相当好的颜色稳定性[6]。
糖对花色苷稳定性的影响主要表现为,花色苷溶液在高浓度糖的条件下,由于水分活度降低,花色苷生成假碱式结构的速度减慢,所以花色苷的颜色得到了保护;在低浓度的条件下,花色苷的降解或变色却加速。果糖、阿拉伯糖、乳糖和山梨糖的这种作用比葡萄糖、蔗糖和麦芽糖更强。花色苷的降解速率和糖本身降解时生成糖醛类化合物的速率有关[7]。而对与这两种色素稳定性比较一直没有定论。
本实验主要从4个方面比较葡萄皮和黑米色素的稳定性:(1)不同pH对两种色素稳定性影响;(2)不同糖浓度对两种色素稳定性影响;(3)不同酒精度对两种色素稳定性影响;(4)复配色素在不同条件下花色苷稳定性影响。目的在与比较两种色素稳定性差异,为果酒果汁的实际生产提供依据。
1 材料与方法
1.1 主要材料
1.1.1 实验原料。 葡萄皮色素,由宁波市烛湖酒业有限公司提供,花色苷含量为3%;黑米色素,由浙江瑞康生物技术有限公司提供,花色苷含量为25%。
1.1.2 主要试剂。本研究使用的主要化学药品和试剂如表1所示。

表1 实验主要试剂一览表
1.1.3 主要仪器和设备。本研究所采用的主要仪器和设备如表2所示。

表2 主要仪器和设备
1.2 实验方法
1.2.1 葡萄皮色素和黑米色素初处理。称取0.2g花色苷含量为3%的葡萄色素,在容量瓶中定容至100mL,使葡萄皮色素花色苷的浓度为0.06g/L;称取0.024g花色苷含量为25%的黑米色素,在容量瓶中定容至100mL,使黑米色素花色苷的浓度为0.06g/L。
1.2.2 不同pH对葡萄皮色素花色苷和黑米色素花色苷保存率影响。准确称取28.392g磷酸氢二钠定容至1L,使其浓度为0.2mol/L;称取21.024g柠檬酸定容至1L,使其浓度为0.01mol/L。配置pH3.0(4.11mL Na2HPO4与15.89mL柠檬酸混合)、pH4.0(7.71mL Na2HPO4与12.29mL柠檬酸混合)、pH5.0(10.3mL Na2HPO4与9.7mL柠檬酸混合)的缓冲溶液,待用。将花色苷浓度为0.06g/L的葡萄皮色素和黑米色素溶液用pH (3.0、4.0、5.0)的缓冲溶液稀释至0.03g/L,在阴暗处放置24h,在λvis-max为520nm下测量吸光值,根据吸光值计算葡萄皮色素和黑米色素花色苷保存率的变化。
1.2.3 不同乙醇浓度对葡萄皮色素花色苷和黑米色素花色苷保存率影响。取10mL无水乙醇,稀释成乙醇浓度分别为(10%、15%、20%)的溶液。用不同浓度乙醇溶液将花色苷浓度为0.06g/L的葡萄皮色素和黑米色素溶液稀释至0.03g/L,在阴暗处放置24h,在λvis-max为520nm下测量吸光值,根据吸光值计算葡萄皮色素和黑米色素花色苷保存率的变化。
1.2.4 不同糖浓度对葡萄皮色素花色苷和黑米色素花色苷保存率影响。准确称取10g蔗糖,用蒸馏水溶解成糖度为(5%、10%、15%)的蔗糖溶液。用不同浓度蔗糖溶液将花色苷浓度为0.06g/L的葡萄皮色素和黑米色素溶液稀释至0.03g/L,在阴暗处放置24h,在λvis-max为520nm下测量吸光值,根据吸光值计算葡萄皮色素和黑米色素花色苷保存率的变化。
1.2.5 复配色素对果酒和果汁花色苷保存率影响。将1.2.1中配置好的两种浓度相同的色素溶液在(乙醇浓度15%、pH3.0)的水平下稀释成0.03g/L,按(9∶1、8∶2、7∶3……1∶9)9个水平配置,以0.03g/L葡萄皮色素和黑米色素溶液为对照组,在λvis-max为520nm下测量吸光值,根据吸光值计算花色苷保存率的变化进行比较。将1.2.1中配置好的两种浓度相同的色素溶液在(糖度10%、pH3.0)的水平下稀释成0.03g/L,按(9∶1、8∶2、7∶3……1∶9)9个水平配置,以0.03g/L葡萄皮色素和黑米色素溶液为对照组,在λvis-max为520nm下测量吸光值,根据吸光值观测花色苷保存率的变化进行比较。1.2.6 花色苷含量的测定。 采用pH示差法,具体操作如下:
pH1.0缓冲液的配制:准确称取1.49g KCl,用蒸馏水定容至100mL。准确量取1.7mL盐酸(分析纯),用蒸馏水定容至100mL,配制成0.2mol/L盐酸溶液,将KCl溶液与盐酸溶液以25∶67的比例混合。用KCl溶液调节pH(1.0±0.1)。
pH4.5缓冲液的配制:准确称取8.203g NaAC,用蒸馏水定容至100mL。准确量取8.453mL HCl,用蒸馏水定容至100mL,从中分别取25mL HCl溶液,50mL NaAC溶液,在加入180mL的蒸馏水,充分混合,用HCl调节pH至4.5。取pH1.0缓冲液和pH4.5缓冲液各9mL,分别加入待测样品1mL,混匀,平衡2h,用蒸馏水作为空白,在λvis-max和700nm(校正浑浊度)下,测定其吸光度,并按下式计算稀释样品的吸光度(A):
A=(Aλvis-max-A700)pH1.0-(Aλvis-max-A700)pH4.5
按照下式计算原始样品中花色苷色素的质量浓度:
花色苷色素(mg/L)=(A×MW×DF×1000)/(ξ×1)
式中:MW为分子量,DF为稀释因子,ξ为摩尔吸光度,1为比色皿直径(cm)。本实验中按矢车菊素-3-葡萄糖苷计算花色苷浓度,其中MW=449.2,ξ=26900。
2 结果与分析
2.1 不同pH下葡萄皮和黑米色素稳定性比较
从图1可以看出,当葡萄皮和黑米色素花色苷浓度为0.03g/L时,葡萄皮和黑米色素花色苷保存率随着pH的增大而减小。许多资料表明,pH值越低,花色苷的稳定性越强[10]。当pH为3时,葡萄皮和黑米色素花色苷的保存率最好,分别为96.9%和92.4%。所以葡萄皮色素比黑米色素更稳定。
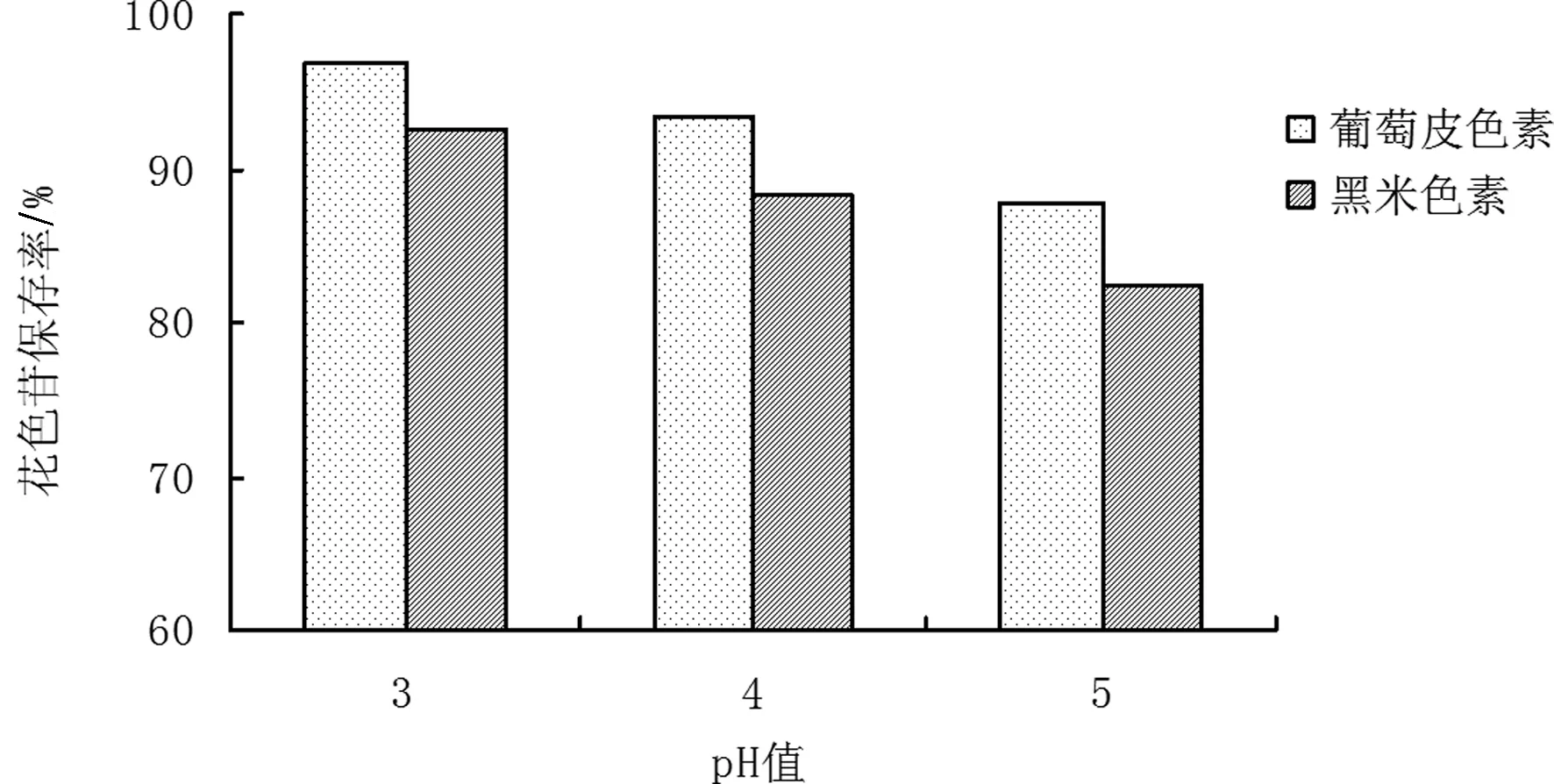
图1 不同pH下葡萄皮和黑米色素花色苷保存率变化
2.2 不同乙醇浓度下两种色素稳定性比较
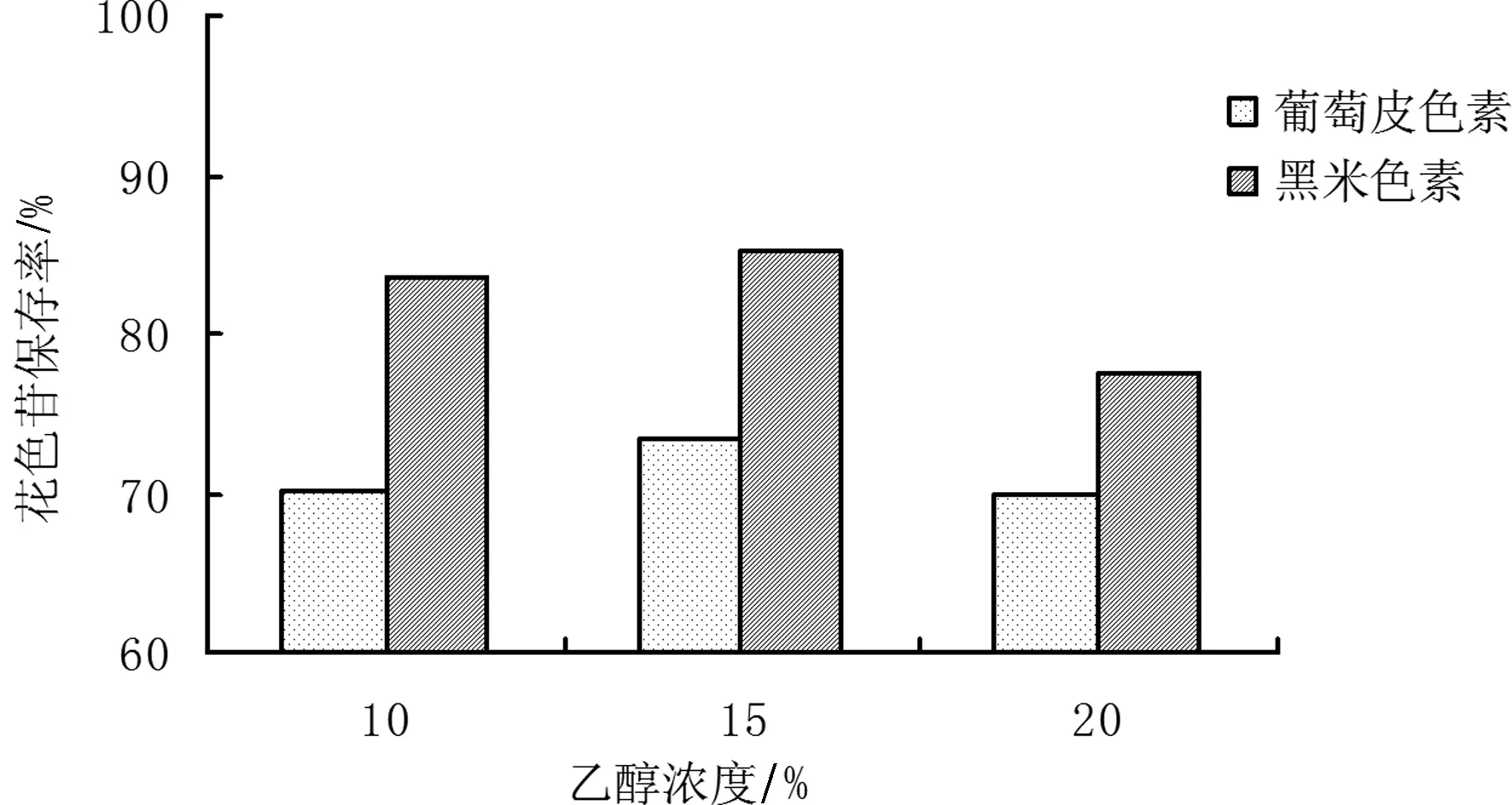
图2 不同乙醇浓度下葡萄皮和黑米色素花色苷保存率变化
由图2可以看出,在乙醇浓度为15%条件下葡萄皮色素和黑米色素花色苷保存率处于最佳状态。葡萄皮色素花色苷最优保存率为73.4%,黑米色素花色苷最优保存率为85.2%。因此,酒精度对于黑米色素的影响小于葡萄皮色素,所以黑米色素更稳定。
2.3 不同糖浓度下两种色素稳定性比较
从图3中可以看出,葡萄皮和黑米色素在花色苷浓度为0.03g/L条件下,糖浓度越高花色苷的保存率越好。与许多资料中显示的高浓度糖降低了水分活度,对花色苷起保护作用相符[13]。在糖度为15%时,葡萄皮色素和黑米色素花色苷的保存率最好,分别为83.8%和90.8%。因为黑米色素的保存率较高,所以黑米色素较葡萄皮色素更稳定。
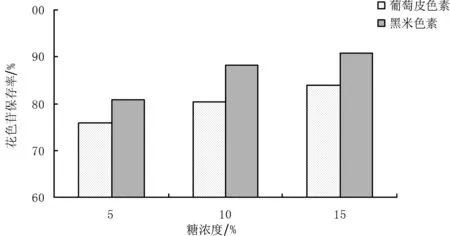
图3 不同糖浓度下葡萄色素皮花色苷保存率变化
2.4 复配色素下两种色素稳定性
由图4可以看出,复配色素随着黑米色素成分的增多保存率逐渐上升。在乙醇浓度15%、pH3.0条件下,随着黑米色素成分增加,花色苷保存率由83.5%上升到90.1%;在糖度10%、pH3.0条件下,当黑米成分增加,花色苷保存率由86.8%上升到91.9%。所以黑米色素在复配色素中占主导地位,黑米色素稳定性更高。
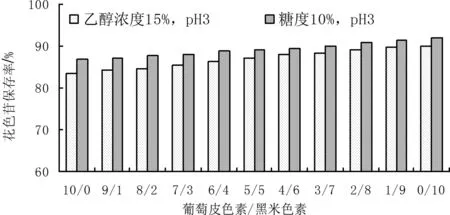
图4 复配色素在不同条件下花色苷保存率变化
3 结论
在酸性环境条件下(pH 3~5)葡萄皮色素的稳定性高于黑米色素,葡萄皮色素和黑米色素花色苷保存率与pH值呈负相关性。在花色苷浓度为0.03g/L时,pH为3时,葡萄皮色素花色苷的保存率为96.9%,而黑米色素花色苷保存率仅92.4%。
在不同糖浓度条件下,黑米色素稳定性高于葡萄皮色素,它们的稳定性与糖浓度之间均呈正相关关系。当蔗糖浓度为15%时,黑米色素花色苷的保存率为90.8%,而葡萄皮色素的保存率为83.8%。
在不同乙醇浓度条件下,黑米色素稳定性也高于葡萄皮色素。在乙醇浓度为15%时,黑米色素花色苷的保存率85.2%,而葡萄皮色素的保存率为73.4%。
复配色素在(乙醇浓度15%、pH3.0)和(糖度10%、pH3.0)条件下稳定性随着黑米色素成分的增加而上升。因而黑米色素在该条件下更稳定。
[1]梅建生,李理,胡建涛.黑豆皮色素提取方法的研究[J].西北大学学报,2004,34(3):321-324.
[2]吉欣,毛利群,李霞.葡萄色素的提取及稳定性研究[J].化学研究,2004,15(1):48-52.
[3]余季金,侯倩慧,王晓东.红葡萄皮色素的离子色谱分析法研究[J].中外葡酒,2004(1):14-16.
[4]郭松年,徐驰,刘兴华.温度pH和光照对石榴汁花色苷稳定性的影响[J].食品与发酵科技,2009,45:29-34.
[5]郭耀东.葡萄皮花色苷提取纯化技术及稳定性研究[D].陕西杨凌:西北农林科技大学,2008:1-49.
[6]Ohta H,Watanabe H,Osaiima Y.Effects of saccharides on anthocyanin pigment from juices of Campbell early grape[J].Nippon Shikuhin Kogyo Gajdihisi,1979,26:111-115.
[7]Metivier RP,Francis FJ,Clydesdale FM.Solvent extraction of anthocyanins from wine pomace[J].Journal of Food Science,1980,45:1099-1104.
[8]俞群娣.黑米色素稳定性的研究[J].浙江海洋学院学报,2002,21(1):72-74.
[9]吉欣,毛利群,李霞.葡萄色素的提取及稳定性研究[J].化学研究,2005,15(1):48-52.
[10]钟瑞敏.花色苷结构与稳定性的关系及其应用研究[J].韶关学院学报(自然科学版),2001,22(12):79-83.
[11]聂芊,吴春,张若男,等.黑米色素的性质及光稳定化剂的研究[J].中国粮油学报,2002,17(6):51-54.
[12]Wrolstad R E.Anthocyanin pigments bioactivity and coloring proper-ties[J].Journal of Food Science,2004,69(5):419-421.
[13]Ates A D,Erdogrul O T.Antimicrobial activities of variousmedicinal and commercial plant extracts[J].Turk JournalofBiology,2003,27(1):157-162.
[14]张福娣,苏金为,蔡碧琼.黑米色素提取工艺及性质表征[J].福建农林大学学报,2006,2(3)36-37.
[15]曹小勇,李新生.黑米花色苷类研究现状展望[J].氨基酸和生物资源,2002,24(1):3-6.
2015-04-03
宁波市农业科技创新创业重点项目(2012092015)
黄士文(1979-),男,工程师,农推硕士在读,从事农林技术推广,E-mail:773768904@qq.com。
S663.1
A
DOI.:10.13268/j.cnki.fbsic.2015.04.006

