灵芝多糖对荷膀胱癌T24细胞小鼠化疗后腹腔巨噬细胞的影响及相关免疫机制研究
刘 奔,郭鹏荣,盛玉文,傅德望,王成财,王 朝
·中医·中西医结合研究·
灵芝多糖对荷膀胱癌T24细胞小鼠化疗后腹腔巨噬细胞的影响及相关免疫机制研究
刘 奔,郭鹏荣,盛玉文,傅德望,王成财,王 朝
目的 探讨灵芝多糖对荷膀胱癌T24细胞小鼠化疗后腹腔巨噬细胞免疫功能的影响。方法 2012年5月—2014年10月建立荷膀胱癌T24细胞小鼠模型15只,采用随机数字表法分为3组:0.9%氯化钠溶液组、顺铂组、顺铂+灵芝多糖组,每组5只。分别以0.9%氯化钠溶液、0.9%氯化钠溶液、灵芝多糖灌胃18 d,以0.9%氯化钠溶液、顺铂、顺铂腹腔注射5 d。收集小鼠腹腔巨噬细胞,采用流式细胞仪检测腹腔巨噬细胞对异硫氰酸荧光素-右旋糖酐(FITC-dextran)的吞噬能力,以FITC-dexran阳性率表示;采用酶联免疫吸附试验法(ELISA)检测腹腔巨噬细胞白介素1(IL-1)和肿瘤坏死因子α(TNF-α)表达水平;采用荧光定量PCR(RT-PCR)检测腹腔巨噬细胞IL-1 mRNA和TNF-α mRNA表达水平。结果 顺铂+灵芝多糖组小鼠FITC-dextran阳性率较顺铂组升高4.5%;顺铂+灵芝多糖组小鼠CD11b-FITC阳性率和CD68-FITC阳性率分别较顺铂组升高11.5%和13.4%,但均未能达到0.9%氯化钠溶液组巨噬细胞中阳性率。3组小鼠腹腔巨噬细胞IL-1、TNF-α表达水平及IL-1 mRNA、TNF-α mRNA表达水平比较,差异有统计学意义(P<0.05);其中顺铂组和顺铂+灵芝多糖组小鼠腹腔巨噬细胞IL-1、TNF-α表达水平及IL-1 mRNA、TNF-α mRNA表达水平较0.9%氯化钠溶液组降低(P<0.05);顺铂+灵芝多糖组小鼠腹腔巨噬细胞IL-1、TNF-α表达水平及IL-1 mRNA、TNF-α mRNA表达水平较顺铂组升高(P<0.05)。结论 灵芝多糖能够提高荷膀胱癌T24细胞小鼠腹腔巨噬细胞的吞噬作用,从而提高机体的免疫功能,其机制可能与增强IL-1和TNF-α的表达水平有关。
膀胱肿瘤;灵芝;抗肿瘤联合化疗方案;巨噬细胞
刘奔,郭鹏荣,盛玉文,等.灵芝多糖对荷膀胱癌T24细胞小鼠化疗后腹腔巨噬细胞的影响及相关免疫机制研究[J].中国全科医学,2015,18(24):2971-2975.[www.chinagp.net]
Liu B,Guo PR,Sheng YW,et al.Effects of ganoderma lucidum polysaccharides on peritoneal macrophages in nude mice bearing human ladder cancer T24 cells after chemotherapy and related immune mechanism[J].Chinese General Practice,2015,18(24):2971-2975.
灵芝多糖是从灵芝孢子体中提取的有效成分。有研究表明,灵芝多糖灌胃给药具有增强小鼠腹腔巨噬细胞吞噬鸡红细胞的能力[1],促进脾脏及外周血淋巴细胞增生,近一步活化T淋巴细胞,提高免疫应答能力,并且能够促进相关细胞因子的表达,如肿瘤坏死因子(TNF)和白介素(IL)的表达,具有增强免疫抑制和抗肿瘤作用[2]。本实验研究其对小鼠化疗后腹腔巨噬细胞的影响及相关表达,探讨灵芝多糖影响免疫逃逸的初步机制,深入研究传统中药对恶性肿瘤的免疫机制及治疗方法。
1 材料与方法
1.1 实验材料 2012年5月—2014年10月,人源膀胱癌T24细胞株购于中科院上海细胞库。Balb/c小鼠15只,4~6周龄,雌性,购于北京华阜康生物科技股份有限公司(动物合格证号:SCXK京2009-0004)。
1.2 实验药物及试剂 灵芝多糖选用杭州众芝康菇生物技术有限公司生产的灵芝多糖粉,用 0.5%羧甲基纤维素钠溶液溶解,并稀释至实验浓度。顺铂注射液购于山东齐鲁制药有限公司。RPMI 1640培养基(批号:SH30809.01)、胎牛血清(批号:V30087.01)、胰蛋白酶(批号:SH30042.01)均购于美国 hyclone公司。异硫氰酸荧光素-右旋糖酐(FITC-dextran)、IL-1、TNF-α购于美国 Sigma公司。目的基因IL-1和TNF-α引物和内参基因β-actin引物由天根生化科技(北京)有限公司合成。小鼠IL-1定量酶联免疫吸附试验(ELISA)试剂盒购于上海森雄科技实业有限公司(进口分装);RNA酶抑制剂焦碳酸二乙酯(DEPC)(批号:1609-47-8)购于上海思域化工科技有限公司,RNA提取试剂盒TRIzol、RNA酶抑制剂、EcoRⅠ限制酶、反转录酶(M-MLV)均购于美国Invitrogen公司;反转录Taq DNA聚合酶购于日本Takara公司。
1.3 荷瘤鼠的建立及分组 取对数生长期人源膀胱癌T24细胞,调至细胞浓度2.0×106个/ml,悬于200 μl磷酸盐缓冲液(PBS),接种于小鼠右侧腋窝皮下。待小鼠体表肿瘤长至长径4~5 mm时,为荷瘤成功。采用随机数字表法将荷瘤鼠平均分为3组:0.9%氯化钠溶液组、顺铂组、顺铂+灵芝多糖组,每组5只。分别以0.9%氯化钠溶液、0.9%氯化钠溶液、灵芝多糖(200 mg/kg)灌胃18 d,以0.9%氯化钠溶液、顺铂(25 mg/kg)、顺铂(25 mg/kg)腹腔注射5 d。
1.4 腹腔巨噬细胞的收集及培养 于实验第19天在SPF实验室操作台按动物福利学将小鼠脱颈断头处死,向腹腔注入Hanks液5 ml,轻揉挤压腹部,吸出灌洗液。将灌洗液以1 300 r/min离心5 min(离心半径3.0 cm),弃去上清液,用Hanks液洗涤3次,合并小鼠细胞,用含10%胎牛血清的RPMI 1640培养液重悬细胞,配制浓度为2×106/ml,将细胞悬液加入24孔培养板中,1 ml/孔,于37 ℃,5%CO2培养箱中培养3 h,使巨噬细胞贴壁,弃去上清液,用含10%胎牛血清的RPMI 1640培养液反复冲洗3遍,除去非黏附细胞,即为巨噬细胞。调至细胞浓度为2×106个/ml,同时进行细胞活力的观察及巨噬细胞的鉴定,接种于培养板内,放入37.5 ℃,20%CO2培养箱2~3 h后换液,继续培养24 h 取生长状态良好的细胞。
1.5 巨噬细胞吞噬功能的测定 将培养好的巨噬细胞冲液、悬浮计数,使其调整至浓度为1×106个/ml。分别取150 μl细胞悬液,加入浓度为1 mg/ml的FITC-dextran,同时另做阴性对照,加入150 μl PBS。配置好的细胞悬液置于37 ℃,5%CO2培养箱中孵育2 h待用。取出后用PBS冲洗至细胞悬浮,采用流式细胞仪进行分析。检测FITC-dextran阳性率,表示巨噬细胞的吞噬能力。检测数据经Cell Quest软件计算所得。
1.6 检测腹腔巨噬细胞IL-1和TNF-α表达水平及其mRNA 表达水平 24 孔板内每孔加入500 μl待测巨噬细胞,调至细胞浓度为2×106个/ml,并加入含10%胎牛血清的RPMI 1640培养液补充至1 000 μl/孔,每个终浓度设3个复孔,并设空白对照孔(只含RPMI 1640培养液)。在37 ℃,5%CO2条件下培养2 d后,分别吸取上清液,按照小鼠ELISA试剂盒说明书分别检测巨噬细胞IL-1和TNF-α表达水平。
按RNA提取试剂盒TRIzol说明书提取腹腔巨噬细胞 RNA。将所提RNA依次经RNA酶抑制剂DEPC 50 μl溶解,同时取5 μl用于检测RNA的完整性。取上述RNA溶液10 μl,首先按照反转录试剂盒说明书进行反转录,获得cDNA后,以cDNA为模版进行PCR 扩增。IL-1上游引物为:5′-GAGCACCTTCTTTTCCTTCATCTT-3′,下游引物为 5′-TCACACACCAGCAGGTTATCATC-3′;TNF-α上游引物为:5′-ATCCGCGACGTGGAACTG-3′,下游引物为 5′-ACCGCCTGGAGGTTGGAA-3′。扩增引物和TaqMan由宝生物工程(大连)有限公司设计。以上述cDNA进行PCR 扩增,PCR反应体系总体积为50 μl。PCR反应条件为:95 ℃ 5 min,95 ℃ 50 s,72 ℃ 1 min,进行35个循环反应;最后72 ℃ 10 min。反应结束,取PCR扩增产物经5%琼脂糖凝胶电泳后进行PCR产物条带扫描,以β-actin作为荧光定量PCR(RT-PCR)的鉴定、测序,分别计算 IL-1、TNF-α mRNA与其对应的β-actin峰面积的比值,即为相对表达水平。
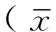
2 结果
2.1 巨噬细胞的吞噬能力 顺铂+灵芝多糖组小鼠FITC-dextran阳性率较顺铂组升高4.5%。顺铂+灵芝多糖组小鼠CD11b-FITC阳性率和CD68-FITC阳性率分别较顺铂组升高11.5%和13.4%,但均未能达到0.9%氯化钠溶液组巨噬细胞中阳性率(见图1)。
注:FITC-dextran=异硫氰酸荧光素-右旋糖酐
图1 小鼠腹腔巨噬细胞吞噬能力变化
Figure 1 The change of phagocytosis in peritoneal macrophages of mice
2.2 小鼠腹腔巨噬细胞IL-1及TNF-α表达水平比较 3组小鼠腹腔巨噬细胞IL-1及TNF-α表达水平比较,差异有统计学意义(P<0.05);其中顺铂组和顺铂+灵芝多糖组小鼠腹腔巨噬细胞IL-1及TNF-α表达水平较0.9%氯化钠溶液组降低,差异有统计学意义(P<0.05);顺铂+灵芝多糖组小鼠腹腔巨噬细胞IL-1及TNF-α表达水平较顺铂组升高,差异有统计学意义(P<0.05,见表1)。

Table 1 Comparison of the expression levels of IL-1 and TNF-α in peritoneal macrophages among each group of mice
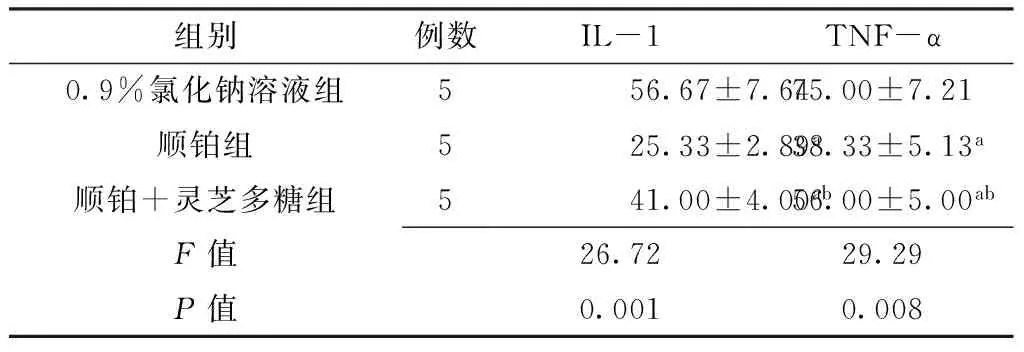
组别例数IL-1TNF-α0.9%氯化钠溶液组556.67±7.6475.00±7.21顺铂组525.33±2.89a38.33±5.13a顺铂+灵芝多糖组541.00±4.00ab56.00±5.00abF值26.7229.29P值0.0010.008
注:IL-1=白介素1,TNF-α=肿瘤坏死因子α;与0.9%氯化钠溶液组比较,aP<0.05;与顺铂组比较,bP<0.05
2.3 小鼠腹腔巨噬细胞IL-1 mRNA和TNF-α mRNA表达水平比较 3组小鼠腹腔巨噬细胞IL-1 mRNA及TNF-α mRNA表达水平比较,差异有统计学意义(P<0.05);其中顺铂组和顺铂+灵芝多糖组小鼠腹腔巨噬细胞IL-1 mRNA及TNF-α mRNA表达水平较0.9%氯化钠溶液组降低,差异有统计学意义(P<0.05);顺铂+灵芝多糖组小鼠腹腔巨噬细胞IL-1 mRNA及TNF-α mRNA表达水平较顺铂组升高,差异有统计学意义(P<0.05,见表2)。
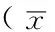
Table 2 Comparison of the expression levels of IL-1 mRNA and TNF-α mRNA in peritoneal macrophages among each group of mice

组别例数IL-1mRNATNF-αmRNA0.9%氯化钠溶液组51.00±0.101.00±0.20顺铂组50.35±0.06a0.30±0.04a顺铂+灵芝多糖组50.79±0.06ab0.68±0.42abF值57.6025.52P值<0.0010.001
注:与0.9%氯化钠溶液组比较,aP<0.05;与顺铂组比较,bP<0.05
3 讨论
巨噬细胞是机体重要的免疫细胞,具有抗感染、抗肿瘤和免疫调节等重要功能。其免疫效应主要以固定细胞或游离细胞的形式对细胞残片及病原体进行噬菌,在机体的免疫系统中起重要作用。研究表明,巨噬细胞通过释放 NO、IL-1、IL-6、IL-12、TNF-α等增加表面分子诱导细胞免疫,提高机体免疫力,杀伤肿瘤细胞[3]。TNF-α主要由激活的巨噬细胞产生,参与免疫调节和前炎性因子,可以促使T淋巴细胞产生相关因子,促进抗炎反应,还可以直接杀伤肿瘤细胞,而对正常细胞无明显杀伤作用,同时也是一种内生致热源,引起主要血管扩张。IL-1与TNF-α相比,IL-1的细胞毒作用较弱,而特异性免疫调节作用较强。有研究表明,IL-1可以杀伤人的黑色素瘤细胞,还能促使小鼠胸腺瘤细胞的凋亡[4]。目前,临床应用的抗肿瘤化疗药物均有不同程度的毒副作用,其在杀伤肿瘤细胞的同时,又杀伤正常组织细胞和器官,使机体功能出现不同程度的损害,胃肠道反应、皮肤病损、血液病变等[5]。当长期大剂量应用后最主要是致使免疫力降低及抵抗外来侵入的能力降低,体质极度削弱。
传统中草药黄芪、蒲公英、当归、益母草等制成的灌胃液(高剂量1 ml·只-1·d-1)能明显提高小鼠腹腔巨噬细胞的吞噬能力[6]。Dai等[7]研究证明,甘草多糖可以增加巨噬细胞产生IL-12,提高非特异免疫功能,同时具有免疫调节、抗病毒、抗感染等作用[8]。亮菌多糖能显著提高小鼠腹腔巨噬细胞培养上清液中IL-1β、IL-6、TNF-α和NO的表达水平,增强IL-1β、IL-6、TNF-α和NO合成关键酶一氧化氮合酶(NOS)基因的转录和表达,进而增强小鼠免疫力,杀伤肿瘤细胞[9]。张莘莘等[10]研究证明了,黑灵芝多糖可增强巨噬细胞活化能力,并且可以释放相关免疫因子如IL-1β、NO、TNF-α等,进而提高机体免疫力。实验研究通过小鼠灵芝多糖灌胃,腹腔注射鸡红细胞悬液后,观察得到巨噬细胞能显著提高对鸡红细胞的吞噬率及吞噬指数[1]。另有研究表明,小鼠腹腔巨噬细胞中TNF-α mRNA表达水平与灵芝多糖的浓度呈依赖性[11]。
尽管恶性肿瘤在治疗、临床试验效果均不理想,其原因与应用相关化疗药物所致毒副作用相关。中药在提高机体免疫力方面具有优势,启发在中药提取物中寻找有效的成分提高免疫力能协调化疗药物抗肿瘤。本研究结果显示,灵芝多糖能通过活化小鼠腹腔巨噬细胞,增强其吞噬作用,顺铂+灵芝多糖组巨噬细胞IL-1和TNF-α表达水平较顺铂组升高,说明灵芝多糖能高机体的免疫力和协同顺铂抗肿瘤能力,抑制肿瘤细胞生长,发挥抗肿瘤作用。本研究仅探讨巨噬细胞IL-1和TNF-α的表达水平,而其他相关免疫因子的表达水平和免疫机制以及灵芝多糖对机体免疫系统的影响需进一步研究。
综上所述,目前针对恶性肿瘤治疗,由于化疗后出现毒副作用,致使肿瘤治疗失败[12-14]。因此,研究灵芝多糖对巨噬细胞的激活作用,提高机体免疫力,以整合医学为指导,配合化疗药物治疗膀胱癌有望为恶性肿瘤的治疗提供一条新的有效方法,为解决临床实际问题提供理论依据,推动祖国传统中医药理论以及应用技术的发展,并为调控肿瘤免疫提供新的思路,具有潜在的应用前景。
利益冲突声明:本课题未涉及任何厂家及相关雇主或其他经济组织直接或间接的经济或利益的赞助。无利益冲突。
伦理要求:实验大鼠符合动物福利和伦理,实验方案获医院伦理委员会批准。
[1] Wang JJ.Experimental study of ganoderma lucidum polysaccharide on macrophage cell immunological function in mice[J].Guide of China Medicine,2012,10(21):471-472.(in Chinese) 王静静.灵芝多糖对小鼠巨噬细胞免疫功能的影响研究[J].中国医药指南,2012,10(21):471-472.
[2] Zhu XL,Chen AF,Lin ZB.Ganoderma lucidum polysaccharides enhance the function of immunological effector cells in immunosuppressed mice[J].J Ethnopharmacol,2007,111(2):219-226.
[3] Suzuki S,Mimuro H,Kim M,et al.Shigella IpaH7.8 E3 ubiquitin ligase targets glomulin and activates inflammasomes to demolish macrophages[J].Proc Natl Acad Sci U S A,2014,111(40):E4254-4263.
[4] Yang OO,Kelesidis T.Interleukin-2-unresponsive immune defects in good syndrome:Letter to the Editor[J].Clin Immunol,2010,135(3):496-498.
[5] Williams KM,Schulte RW,Schubert KE,et al.Evalutaion of mathematical algorithms of automatic patient alignment in radiosurgery[J].Technol Cancer Res Treat,2014,9(10):234-238.
[6] Zhang MT,Wang QF,Xiao M,et al.Effects of herb medicine on lick-up ability of rat macrophage[J].Heilongjiang Animal Science and Veterinary Medicine,2000(12):26.(in Chinese) 张淼涛,王秋芳,效梅,等.中草药对小白鼠巨噬细胞吞噬力的影响[J].黑龙江畜牧兽医,2000(12):26.
[7] Dai JH,Iwatani Y,Ishida T,et al.Glycyrrhizin enhances interleukin-12 production in peritoneal macrophhages[J].Immunology,2001,103(2):235-243.
[8] Ashfaq UA,Masoud MS,Nawaz Z,et al.Glycyrrhizin as anticiral agent against Hepatitis C Virus[J].J Transl Med,2011(9):112.
[9] Luo X,Yu MY,Xu XY,et al.Effects of Armillariella tabescens polysaccharide IPS-B2 on activity of mouse peritoneal macrophages and transcription of related gene[J].China Journal of Chinese Materia Medica,2008,33(11):1305-1308.(in Chinese) 罗霞,余梦瑶,许晓燕,等.亮菌多糖IPS-B2对小鼠腹腔巨噬细胞活性及其相关基因转录的影响[J].中国中药杂志,2008,33(11):1305-1308.
[10] Zhang XX,Li WJ,Nie SP,et al.Effects of polysaccharide of Ganoderma atrum on the function of mouse peritoneal macrophages in vitro[J].Chinese Pharmacological Bulletin,2010,26(9):1139-1142.(in Chinese) 张莘莘,李文娟,聂少平,等.黑灵芝多糖对体外培养的小鼠腹腔巨噬细胞功能的影响[J].中国药理学通报,2010,26(9):1139-1142.
[11] Li MC,Lei LS,Liang DS,et al.Effects of Ganoderma lucidum polysaccharides on expression of interleukin 1α and tumor necrosis factor α mRNA in murine macrophage[J].Chinese Journal of Pharmacology and Toxicology,2000,14(3):237-240.(in Chinese) 李明春,雷林生,梁东升,等.灵芝多糖对小鼠巨噬细胞白介素1α和肿瘤坏死因子α mRNA表达的影响[J].中国药理学与毒理学杂志,2000,14(3):237-240.
[12] Niu XD,Ma DW,Tian HL,et al.Efficacy of temozolomide versus traditional chemotherapy drugs in treatment of gliomas:a systematic review[J].Journal of International Neurology and Neurosurgery,2014,41(1):1-6.(in Chinese) 牛小东,马弟娃,田宏亮,等.替莫唑胺对比传统化疗药治疗脑胶质瘤疗效的系统评价[J].国际神经病学神经外科学杂志,2014,41(1):1-6.
[13]张蕴超,贾英杰,孙一予,等.免疫治疗系统联合养正消积胶囊对恶性肿瘤化疗减毒作用的疗效观察[J].疑难病杂志,2012,11(9):716.
[14]Shan JY,Chi BR,Yang L,et al.Toxic and side effects of intraperitoneal hyperthermic perfusion chemotherapy on advanced ovarian cancer postoperatives[J].Chinese General Practice,2012,15(2):565.(in Chinese) 单既英,迟宝荣,杨雷,等.老年卵巢癌术后腹腔热灌注化疗的毒副作用分析[J].中国全科医学,2012,15(2):565.
(本文编辑:陈素芳)
Effects of Ganoderma Lucidum Polysaccharides on Peritoneal Macrophages in Nude Mice Bearing Human Ladder Cancer T24 Cells After Chemotherapy and Related Immune Mechanism
LIUBen,GUOPeng-rong,SHENGYu-wen,etal.
DepartmentofUrology,theFirstAffiliatedHospitalofLiaoningMedicalUniversity,Jinzhou121001,China
Objective To explore the effects of ganoderma lucidum polysaccharides(GLP) on the immune function of macrophages in mice bearing human ladder cancer T24 cells.Methods Nude mice model bearing the human bladder cancer T24 cells was established from May 2012 to October 2014,mice were divided into three groups by random number table method:0.9% sodium chloride solution group,cisplatin group and cisplatin+GLP group,there were 5 mice in each group.Mice in the above three groups received intragastric administration of 0.9% sodium chloride solution,0.9% sodium chloride solution and GLP,respectively,and received intraperitoneal injection of 0.9% sodium chloride solution,cisplatin and cisplatin,respectively.The peritoneal macrophages were then collected,the phagocytic rate of peritoneal macrophages against FITC-dextran was further detected by flow cytometry,the levels of IL-1 and TNF-α in peritoneal macrophages were measured by ELISA,and real-time fluorescent quantitative polymerase chain reaction (qPCR) was used to analyze the mRNA levels of IL-1 and TNF-α in peritoneal macrophages.Results The positive rates of FITC-dextran,CD11b-FITC and CD68-FITC among mice in cisplatin+GLP group were 4.5%,11.5% and 13.4% higher than those among mice in cisplatin group,respectively,the above indicators among mice in cisplatin+GLP group and cisplatin group were lower than those among mice in 0.9% sodium chloride solution group,respectively.There were significant differences in levels of IL-1 and TNF-α,expression levels of IL-1 mRNA and TNF-α mRNA in peritoneal macrophages among three groups of mice (P<0.05);levels of IL-1 and TNF-α,expression levels of IL-1 mRNA and TNF-α mRNA in peritoneal macrophages among mice in cisplatin+GLP group and cisplatin group were significantly lower than those among mice in 0.9% sodium chloride solution group,respectively (P<0.05);the above indicators among mice in cisplatin+GLP group were significantly higher than those among mice in cisplatin group (P<0.05).Conclusion GLP could improve the phagocytic function of peritoneal macrophages in mice,thus can improve immune function of body,the mechanism of which may be related to the enhancement effect of GLP on IL-1 and TNF-α expression levels.
Urinary bladder neoplasms;Ganoderma lucidum;Antineoplastic combined chemotherapy protocols;Macrophages
辽宁省自然科学基金资助项目 (201202131)
121001辽宁省锦州市,辽宁医学院附属第一医院泌尿外科
刘奔,121001辽宁省锦州市,辽宁医学院附属第一医院泌尿外科;E-mail:doctor_liuben@163.com
R 737.14
A
10.3969/j.issn.1007-9572.2015.24.020
2014-10-14;
2015-03-20)

