Bmi1基因在胰腺癌中的表达及其临床意义
李 慧, 贺恒鹏, 于雯婷, 崔吉香
(中国医科大学附属第四医院, 1. 输血科; 2. 检验科, 辽宁 沈阳, 110032)
Bmi1基因在胰腺癌中的表达及其临床意义
李慧1, 贺恒鹏2, 于雯婷1, 崔吉香1
(中国医科大学附属第四医院, 1. 输血科; 2. 检验科, 辽宁 沈阳, 110032)
摘要:目的探讨Bmi1基因在胰腺癌及癌旁组织中的表达。方法选取胰腺癌患者的病理组织86例,癌旁正常组织80例。应用半定量 RT-PCR法检测Bmi1基因mRNA表达情况,分析其与临床病理特征及预后的关系。结果与癌旁组织相比较,Bmi1基因mRNA在胰腺癌中的表达明显升高。Bmi1基因mRNA的表达与患者的年龄、性别和分化程度无关,而与肿瘤的TNM分期、淋巴结转移以及术后3年生存率有关(P=0.019、0.006、0.002)。结论Bmi1基因mRNA的含量高低与胰腺癌的发生、发展有显著相关性。
关键词:Bmi1; 胰腺癌; RT-PCR; 临床意义
胰腺导管腺癌(PDAC)是一种常见的恶性肿瘤,其发病率有明显增高的趋势,90%的病人在诊断后1年内死亡,5年生存率不到5%[1]。因此,探索相关的指标以指导早期诊断、治疗、评估预后、改善患者的生存质量是非常必要的。
Bmi1基因被认为是C-MYC原癌基因的协同基因,在人类许多肿瘤,如霍奇金淋巴瘤、食管癌、乳腺癌、前列腺癌等的发生和发展都和Bmi1的过量表达有关,提示Bmi1基因在研究肿瘤的发病机制和治疗等方面有着重大的临床意义[2-5]。最近的研究[6-7]表明,Bmi1基因在PDAC中也呈现出高表达,但其在PDAC的临床意义及具体功能尚不十分清楚。该实验主要通过RT-PCR的方法,研究Bmi1基因在PDAC中的表达,分析其与患者临床病理参数以及预后的关系,探讨Bmi1基因与PDAC生物学行为的相关性以及可能的发病机制,为临床对PDAC的早期诊断和治疗提供新的理论依据。
1材料与方法
1.1 RNA的提取及反转录
① 从之前保存在-80 ℃冰箱中取出组织块重量约100 mg, 放在EP管中后用一次性研磨棒轻轻研磨至匀浆状,加入1 mL Tlrizol试剂,室温静置5 min; ② 加入200 μL氯仿,振荡15 s, 室温静置5 min, 在低温高速离心机以4 ℃、12 000 r/min离心15 min; ③ 吸取上层液体转至另一新 EP管中,加入500 μL异丙醇,混匀后室温静置10 min, 4 ℃、12 000 r/min离心10 min; ④ 弃上清,加入1 mL 75%乙醇,置于4 ℃、10 000 r/min离心5 min, 弃上清; ⑤ 加入DEPC处理后的水20~40 μL, 经反复吹打溶解RNA; ⑥ 取2 μL抽提的RNA加入98 μL 0.1%DEPC灭活RNA酶的去离子水中; ⑦ 用反转录试剂盒将总RNA反转录为cDNA,cDNA可直接用于PCR扩增。
1.2 RT-PCR扩增反应
引物的设计与合成。参照Genbank中注册的Bmi1基因序列,用Primer5.0软件进行分析设计PCR引物,交由上海生工生物工程技术服务有限公司合成,引物序列及片段长度如表1所示。
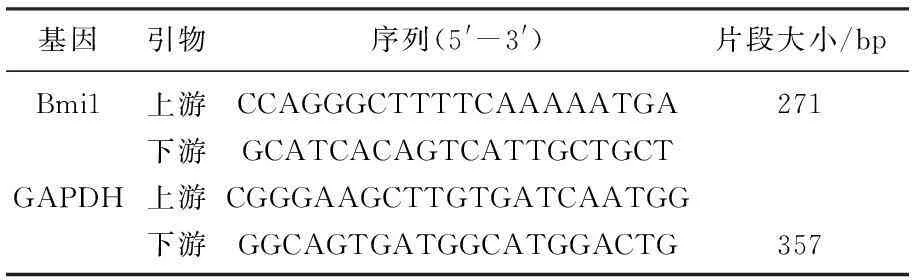
表1 引物序列
PCR扩增反应。PCR反应体系25 μL, 具体如下: dNTP 2.0 μL, Bmi1上下游引物各1.0 μL, GAPDH上下游引物各1.0 μL, Taq聚合酶、0.15 μL, cDNA 1.0 μL。反应条件为: 94 ℃变性45 s, 55 ℃退火45 s, 72 ℃延伸60 s, 共35个循环,结束后再72℃总延伸10 min。
PCR产物琼脂糖凝胶电泳及结果判定。PCR产物以15 g/L制备1.5%的琼脂糖凝胶,加5μL PCR产物,并设定电泳参数为110 mV电压、45 min。经凝胶图像分析仪分析电泳条带亮度并拍照,用QuatityOne软件进行灰度值的比较。以GAPDH作为内参照,计算记录Bmi1基因mRNA的相对表达量。
1.3 组织标本的收集
研究对象为中国医科大学附属第四医院2011年10月—2014年1月有完整病例资料的PDAC患者的病理组织86例,每例患者手术取切除的PDAC组织,同时取其离癌组织边缘2 cm以上的癌旁组织80例,且病理证实无癌细胞浸润。详细记录病人的性别,年龄及临床特征,患者在手术前未进行任何的放疗或化疗等抗癌治疗。
1.4 数据处理
采用SPSS 13.0统计学软件对数据进行统计学分析,半定量RT-PCR结果选用t检验分析,计数资料采用χ2检验,患者预后分析采用kaplan-meier法,logistic-rank进行检验,P<0.05为差异有统计学意义。
2结果
2.1 Bmi1基因mRNA在PDAC中的表达情况
对RT-PCR产物进行琼脂糖凝胶电泳分析,Bmi1基因和GAPDH内参基因共同扩增后,PDAC Bmi1基因mRNA条带亮度明显高于癌旁组织。经凝胶图像分析仪分析电泳条带亮度并进行灰度值结果显示,Bmi1基因mRNA在PDAC组织中为(1.58±0.49), 与癌旁组织的(0.31±0.23)相比较,差异有统计学意义(P<0.0001)。
2.2 Bmi1的表达与PDAC患者临床病理特征之间的关系
将86例PDAC的Bmi1基因平均表达值作为cut-off值,将Bmi1基因的含量分为高表达组和低表达组,其中高表达组45例,低表达组41例,分析其与PDAC临床病理特征之间的关系。结果发现Bmi1基因mRNA的表达与患者的年龄、性别及分化程度无关(P>0.05); 而与肿瘤的TNM分期、淋巴结转移有关,差异具有统计学意义(P<0.05), 见表2。

表2 Bmi1蛋白表达与PDAC患者临床病理特征的关系
2.3 Bmi1 mRNA的表达与预后的关系
运用Kalpan-meier生存分析Bmi1 mRNA表达与PDAC患者术后3年随访存活率的关系,Bmi1mRNA高表达者生存时间更短[χ2=9.156,P=0.002, 中位生存时间分别为(17.0±5.01)月、(25.0±1.99)月]; 说明Bmi1mRNA表达上调影响患者的预后。
3讨论
PcG家族最初是在果蝇体内作为同源盒基因(Hox)的抑制因子被鉴定和发现,PcG蛋白通过形成巨大的多目标复合物,作用在染色体上的不同位点,致使染色体变构,调控基因的表达[8]。Bmi1基因是第一个被鉴定的PcG家族基因,人Bmi1基因位于人10号染色体短臂1区3带(10p13),该区主要与恶性淋巴瘤和儿童白血病的染色体移位有关。在动物模型和体外模型中,Bmi1能引起细胞的转化和促进肿瘤的生长[9]。
Bmi1通过与c-Myc蛋白共同作用抑制INK4a/ARF基因位点,由于不同的阅读顺序,INK4a/ARF编码2种不同结构的蛋白的表达p16ink4a和p19 arf。p16ink4a是一个周期性依赖蛋白激酶抑制因子,可以抑制周期蛋白D-CDK4/6复合物的形成,激活Rb信号通路,抑制细胞增殖; p19ink4a可以通过抑制MDM2诱导p53信号通路,阻止细胞周期停滞和细胞凋亡,因此当Bmi1基因高表达时,通过抑制 p16ink4a和p19 arf,从而促进细胞增殖、阻止细胞凋亡[10]。
在本实验中,作者通过对Bmi1基因在PDAC中的表达情况进行研究,用RT-PCR的方法测定了Bmi1基因mRNA在PDAC和癌旁组织含量。结果显示,Bmi1基因mRNA在PDAC组织中的表达明显高于癌旁组织,含量表达差异具有统计学意义。在以往的研究[6-7]中也表明,与正常组织相比,Bmi1蛋白在PDAC癌中呈高表达,而且在胰腺炎和胰腺上皮内瘤样病变组织中, Bmi1的表达含量也升高[7], 提示Bmi1的过度表达可能与PDAC的发生有关。
通过分析Bmi1基因mRNA的表达与患者的病理参数之间的关系发现,Bmi1的表达与患者的年龄、性别以及分化无关,差异无统计学意义;而与肿瘤的TNM分期、淋巴结转移以及术后3年生存率有关,随着肿瘤浸润深度加深以及淋巴结转移,Bmi1基因的表达含量也随之升高,提示Bmi1的过度表达可能与PDAC恶性程度高和预后不良有关。在急性髓性白血病、食管癌患者中,Bmi1蛋白阳性表达者的生存时间明显比Bmi1蛋白阴性表达者生存时间明显缩短[11-12]。以上的研究表明,Bmi1可能作为一种癌基因与PDAC的发展及预后有关,具有重要的临床意义。
通过上述研究, Bmi1作为一种癌基因与PDAC的发生、发展及预后密切相关,但目前其分子发病机制还未完全阐明,是否可将其作为PDAC分子治疗的新靶点,将是未来需要研究的方向。
参考文献
[1]Singh M, Maitra A.Precursor lesions of pancreatic cancer: molecular pathology and clinical implication[J]. Pancreatology, 2007, 7(1): 9.
[2]0Dimri G P, Martinez J L, Jacobs J J, et al.The Bmi1 oncogene induces telomerase activity and immortalizes human mammary epithelial cells[J]. Cancer Res, 2002, 62(16): 4736.
[3]Dutton A, Woodman C B, Chukwuma M A, et al. Bmi1 is induced by the Epstein-Barr virus oncogen LMP1 and regulates the expression of viral target genes in Hodgkin lymphoma cells[J]. Blood, 2007, 109(6): 2597.
[4]Yoshikawa R, Tsujimura T, Tao L, et al.The oncoprotein and stem cell renewal factor Bmi1 associates with poor clinical outcome in oesophagesl cancer patients undergoing preoperative chemoradiotherapy[J]. BMC Cancer, 2012, 12(10): 461.
[5]Siddique H R, Parray A, Zhong W, et al. Bmi1, stem cell factor acting as novel serum-biomarker for causion and african-amercan prostate cancer[J]. Plos One, 2013, 8(1): e52993.
[6]Tateishi K, Ohta M, Kanai F, et al. Dysregulated expression of stem cell factor Bmi1 in precancerous lesions of the gastrointestinal tract[J]. Clin Cancer Res, 2006, 12(23): 6960.
[7]Martinez-Romero C, Rooman I, Skoudy A, et al. The epigenetic regulators Bmi1 and Ring1B are differentially regulated in pancreatitis and pancreatic ductal adenocarcinoma[J]. J Pathol, 2009, 219(2): 205.
[8]Zhou J, Xu Y, Hao P, et al. Inhibition of lung cancer stem cells self-renewal and tumorigenicity by lentivirus-delivered Bmil shRNA[J]. Chinese-German J Clin Oncol, 2011, 10(11): 636.
[9]Gil J, Bernard D, Peters G.Role of Polycomb group proteins in stem cell self-renewal and cacer[J]. DNA Cejj Biol, 2005, 24(2): 117.
[10]Cao L X, Bombard J, Cintron K, et al. Bmi1 as a novel target for drug discovery in cancer[J]. J Cell Biochem, 2011, 112(10): 409.
[11]Kimura M, Takenobu H, Akita N, et al. Bmil regulates fate via tumor suppressor WWOX repression in small-cell lung cancer cells[J]. Cancer Sci, 2011, 102(5): 983.
[12]Zhang X Y, Santuccione A, Leung C, et al. Differentiation of postnatal cerebellar glial progenitors is controlled by Bmi1 through BMP pathway inhibition[J]. Glia, 2011, 59(7): 1118.
Expression of Bmi1 gene in pancreatic cancer
and its clinical significance
LI Hui1, HE Hengpeng2, YU Wenting1, CUI Jixiang1
(1.Departmentofbloodtransfusion; 2.LaboratoryDepartment,TheFourthAffiliated
HospitalofChinaMedicalUniversity,Shenyang,Liaoning, 110032)
ABSTRACT:ObjectiveTo investigate the expression of Bmi1 gene in pancreatic cancer and adjacent tumor tissues. MethodsTissues of 86 cases of pancreatic cancer and 80 cases of adjacent tumor tissues were selected. Semi-quantitative RT-PCR was applied to detect the expression of Bmi1 gene mRNA, and its relationship with clinical pathological features and prognosis was analyzed. ResultsCompared to adjacent tumor tissues, Bmi1 mRNA expression level in pancreatic cancer tissues were higher. Bmi1 expression in pancreatic cancer was not correlated with the patient′s age, gender and differentiation (P>0.05), but there were correlations between Bmi1 expression and TNM stage, lymph node metastasis and 3-year survival rate (P=0.019, 0.006, 0.002). ConclusionThe content of Bmi1 gene mRNA is significantly correlated with the incidence, development and prognosis of pancreatic cancer occurrence.
KEYWORDS:Bmi1; pancreatic cancer; RT-PCR; clinical significance
收稿日期:2014-12-25
中图分类号:R 735.9
文献标志码:A
文章编号:1672-2353(2015)11-040-03
DOI:10.7619/jcmp.201511012

