窄带成像结合放大肠镜下Sano分型对结直肠肿瘤性和非肿瘤性病变的诊断价值
朱炳良, 沙 杰, 杨爱萍, 龚 洁
(江苏省靖江市人民医院 消化内科, 江苏 靖江, 214500)
窄带成像结合放大肠镜下Sano分型对结直肠肿瘤性和非肿瘤性病变的诊断价值
朱炳良, 沙杰, 杨爱萍, 龚洁
(江苏省靖江市人民医院 消化内科, 江苏 靖江, 214500)
摘要:目的探讨窄带成像结合放大肠镜下微血管形态Sano分型对结直肠肿瘤性和非肿瘤性病变预判的准确性。方法选择经病理确诊的结直肠增生性息肉、腺瘤和腺癌患者147例。采用窄带成像技术结合放大内镜观察病灶表面微血管,按Sano分型预判每个病灶的性质。结果Sano分型对结直肠肿瘤性病变(腺瘤、腺癌)的准确性、敏感性、特异性为97.5%(192/197)、98.1%(159/162)、94.3%(33/35), 阳性预测值、阴性预测值分别为98.8%(159/161)、91.7%(33/36)。结论窄带成像放大肠镜下Sano分型方法预判结直肠肿瘤和非肿瘤性病变很有效。
关键词:窄带成像; 放大肠镜; 微血管; Sano分型; 结直肠肿瘤
随着科技的进步,胃肠道的内镜观察更加微观,诊断更准确。窄带成像(NBI)技术结合放大内镜可辨别胃肠道黏膜病变的腺管开口和微血管形态,据此形态的不同可判断病变的性质[1-3]。正常结直肠黏膜和增生性病灶的毛细血管扩张不明显,而肿瘤性病灶(腺瘤或腺癌)几乎都伴有毛细血管扩张增粗,NBI模式下能观察到特有的棕色血管网结构[4-7]。因此,NBI技术对结直肠肿瘤、非肿瘤病灶的鉴别非常有效。Sano等[8]报道NBI结合放大内镜根据棕色血管网的有无来鉴别结直肠的肿瘤、非肿瘤性病灶的准确性可达93.4%,明显高于普通肠镜的79.1%,与染色内镜相当(93.4%)。内镜下预判结直肠病变的性质有实际临床意义,因内镜下息肉摘除或黏膜切除法(EMR)仍有一定风险,内镜下切除的息肉,有时难以回收标本,并延长操作时间,因此有学者提出息肉直径≤0.5 cm的非肿瘤性息肉可不做活检和切除,或行切除丢弃,进行上述处理要求内镜下息肉的肿瘤性诊断与病理结果的符合率要高于90%,且对肿瘤的阴性预测值要高于90%[9-11]。本文采用窄带成像结合放大肠镜观察结直肠病变表面微血管,按Sano分型对病变的性质进行预判,并与病理学结果进行比较,检验其准确性、敏感性、特异性、阳性预测值、阴性预测值,现报告如下。
1资料与方法
1.1 临床资料
选取2014年7—12月本院内镜中心完成经病理诊断的结直肠增生性息肉、腺瘤和腺癌的NBI放大肠镜检查患者共147例。其中息肉患者(增生性息肉、腺瘤性息肉)122例,男81例,女41例,平均年龄51.2岁;癌患者25例,男16例,女9例,平均年龄57.5岁。主要症状:腹痛71例,腹泻35例,腹胀23例,便秘22例,便血18例,贫血2例。
1.2 器材与检查方法
日本OLYMPUS CF-H260AZI 电子放大肠镜,OLYMPUS CV-260SL处理器。白光下发现病灶后予西甲硅油3 mL+注射用水20 mL混合液冲洗表面,后切换到NBI模式,构造强调等级选择A3,并启用放大器,放大指数设定4,镜头由远而近逐渐接近病灶,图像最清晰时拍照保存。取活检标本或病灶切除标本送病理检查。
1.3 Sano分型
根据毛细血管结构的表现,如血管网的可见度、直径变异、有无分支盲端及分布均一性等将病灶分为4种类型:Ⅰ型,Ⅱ型,ⅢA型和ⅢB型。Ⅰ型病灶无法观察到明显的网络样毛细血管;Ⅱ型病灶可以观察到均匀分布的毛细血管,围绕在腺体开口周围;ⅢA型病灶的网络样毛细血管为分支样,有盲端,分布缺乏均匀性,毛细血管网的密度增加;ⅢB型病灶的微血管粗细及毛细血管网分布更不规则,出现疏松血管网甚至无血管区域。Ⅰ型提示正常黏膜或增生性息肉。Ⅱ型主要提示腺瘤性息肉,也包括部分较大或伴有锯齿状病变的增生性息肉。ⅢA型多为黏膜内癌或黏膜浅层浸润癌。ⅢB型提示黏膜深层浸润癌[12]。所有NBI放大肠镜图像在内镜检查后由1位研究人员进行评价分型。取30张图像由2位内镜医师独立观察微血管形态,进行组织学预判,并计算预测结直肠肿瘤性病变(腺瘤、腺癌)的敏感度和特异度,以评价观察结果的一致性。
1.4 统计学分析
采用SPSS 13.0统计软件进行统计分析。观察者间一致性评价行Kappa检验[13]。一致性强度评价分为差(Kappa值0.01~0.20)、较差(0.21~0.40)、中等(0.41~0.60)、较好(0.61~0.80)、好(0.81~1.00)。
2结果
2.1 结直肠息肉统计情况
共171个病灶,部位以乙状结肠、横结肠、升结肠及直肠多发,病理类型以管状腺瘤和增生性息肉多见。见表1。
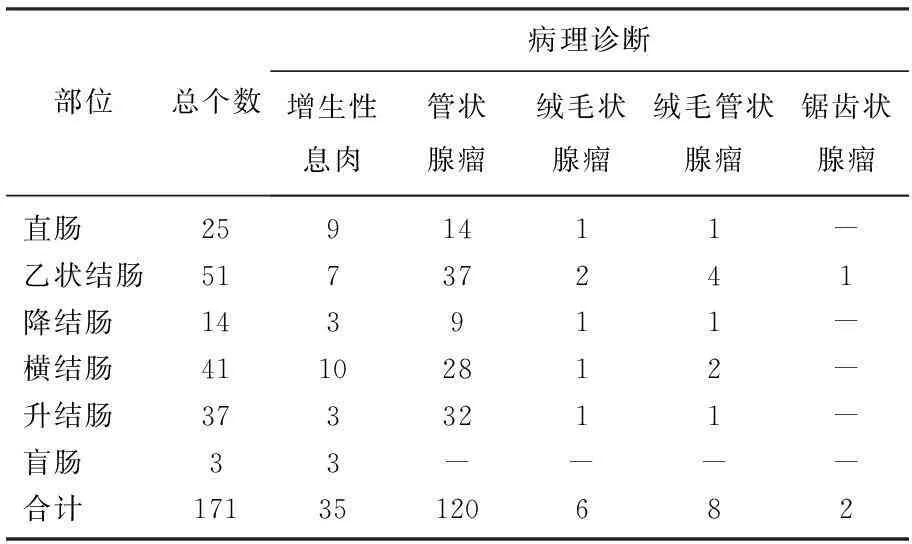
表1 结直肠息肉统计表
2.2 结直肠癌情况统计
共25例。病灶数26个:直肠6个,直肠乙状结肠交界处9个,乙状结肠4个,降结肠1个,横结肠2个,回盲部4个。其中1例为回盲部及直肠同时性重复癌。早期直肠癌2例,侵及黏膜下层。
2.3 Sano分型与病理诊断对照
NBI结合放大肠镜观察结直肠病变微血管形态, Sano分型与病理诊断对照见表2。
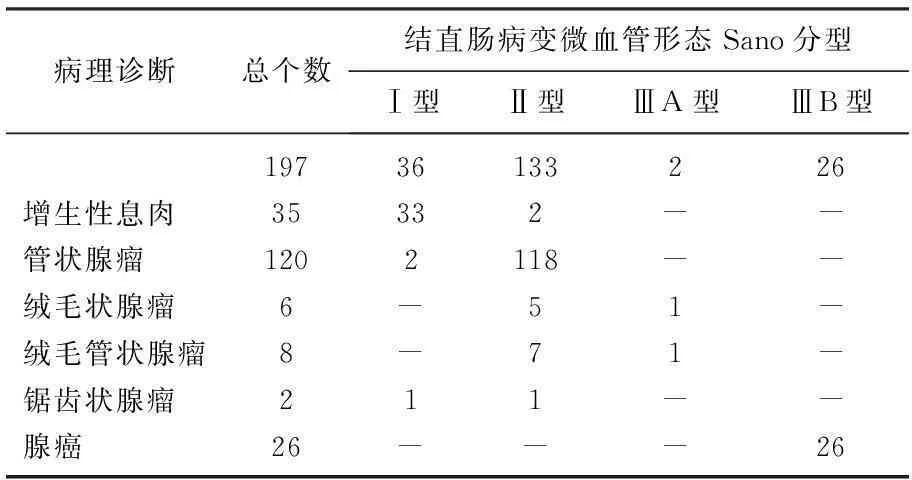
表2 NBI结合放大肠镜观察结直肠病变微血管形态
Ⅰ型病灶36个,其中增生性息肉33个、管状腺瘤2个、锯齿状腺瘤1个。Ⅱ型病灶133个,其中腺瘤131个、增生性息肉2个。Ⅲ型病灶28个,ⅢA型共2 个,分别为绒毛状腺瘤1个、绒毛管状腺瘤1个。ⅢB 26个全部为腺癌。Sano分型对结直肠肿瘤性病变(腺瘤、腺癌)的准确性、敏感性、特异性为97.5%(192/197)、98.1%(159/162)、94.3%(33/35)。阳性预测值、阴性预测值分别为98.8%(159/161)、91.7%(33/36)。
2.4 观察者间一致性的评价
观察者间一致性评价平均Kappa值及其95%可信区为0.765和0.451~0.938,一致性评价强度为较好。
3讨论
普通内镜对结直肠进展期癌有良好的预判能力,但对息肉非肿瘤性和肿瘤性的鉴别较困难。放大内镜的放大倍数可达60~150倍,接近实体显微镜的放大倍数[14],但白光下腺管开口不醒目,形态难辨,微血管也难以显示。NBI结合放大肠镜下,无论是腺管开口,还是微血管其清晰可辨程度都有质的提升,微血管形态显示效果尤为突出。文献[15]报道对于结直肠息肉非肿瘤性和肿瘤性的内镜下鉴别采用腺管开口形态和微血管形态两种方法其准确率、敏感度特异度均较高,二者差异无统计学意义。本研究采用NBI技术结合放大内镜观察结直肠病灶表面微血管,显示效果十分理想,完全满足分型需要。按Sano分型预判结直肠肿瘤性病变(腺瘤、腺癌)的准确性、敏感性、特异性、阳性预测值、阴性预测值均在90%以上,可满足临床上实现新治疗策略的需要。如内镜下判断为增生的病灶可以随访或切除后丢弃,腺瘤性的病灶采取内镜下治疗,癌性病灶根据浸润深度可选择内镜下或转外科手术治疗,而肿瘤浸润深度不明时,可以进行染色内镜或其他检查。
本文腺癌病灶均表现为ⅢB型,未见ⅢA型,说明结肠癌患者在极早期阶段(黏膜内癌或黏膜浅层浸润癌)就诊者极少,有必要加强相关知识普及,有症状者或达到一定年龄需进行结肠镜检查,结直肠存在潜在恶变病灶者要定期随访,以使该病患者得到及早诊断和治疗。表现为ⅢA型的2个病灶病理结果分别为绒毛状腺瘤和绒毛管状腺瘤。虽是假阳性,但这2种腺瘤均容易癌变,仍提示ⅢA型病变较重要。在发现ⅢA型病灶时可结合腺管开口形态及病灶大体形态(表面光滑度、规整性等)帮助鉴别腺瘤与腺癌。
内镜新技术的发展改变了结直肠疾病的诊治流程。NBI放大肠镜下Sano分型方法十分简便,预判结直肠肿瘤和非肿瘤性病变准确率高,对提高早癌的诊断率有很大帮助,可作为实施新治疗策略的重要依据。
参考文献
[1]Kato M, Kaise M, Yonezawa J, et al. Magnifying endoscopy with narrow band imaging achieves superior accuracy in the differential diagnosis of superficial gastric lesions identified with white-light endoscopy:a prospective study[J]. Gastrointestinal Endoscopy, 2010, 72(3): 523.
[2]Masayuki K, Mitsuru K, Jin Y, et al. Trimodal imaging endoscopy may improve diagnostic accuracy of early gastric neoplasia:a feasibility study[J]. Gastrointestinal Endoscopy, 2009, 70(5): 899.
[3]Sano Y, Kobayashi M, Hamamoto Y, et al. New diagnostic method based on color imaging using narrow band imaging system for gastrointestinal tract[J]. Gastrointest Endosc, 2001, 53(5): 125.
[4]Oka S, Tanaka S. Clinical usefulness of narrow band imaging magnifying classification for colorectal tumors based on both surface pattern and microvessel features[J]. Dig Endosc, 2011, 23(1): 101.
[5]Wada Y, Kudo SE, Misawa M, et al. Vascular pattern classification of colorectal lesions with narrow band imaging magnifying endoscopy[J]. Dig Endosc, 2011, 23(1): 106.
[6]Uraoka T, Higashi R, Saito Y, et al. Impact of narrow band imaging in screening colonoscopy[J]. Dig Endosc, 2010, 22(1): 54.
[7]Ng S C, Lau J Y. Narrow band imaging in the colon:limitations and potentials[J]. J Gastroenterol Hepatol, 2011, 26(11): 1589.
[8]Chiu H M, Chang C Y, Chen C C, et al. A prospective comparative study of narrow-band imaging,chromoendoscopy, and conventional colonoscopy in the diagnosis of colorectal neoplasia[J]. Gut, 2007, 56(3): 373.
[9]Adler A, Aschenbeck J, Yenerim T, et al. Narrow-band versus white-light high definition television endoscopic imaging for screening colonoscopy: a prospective randomized trial[J]. Gastroenterology, 2009, 136(2): 410.
[10]Ignjatovic A, East J E, Suzuki N, et al. Optical diagnosis of small colorectal polyps at routine colonoscopy (Detect InSpect ChAracterise Resect and Discard; DISCARD trial): a prospective cohort study[J]. Lancet Oncol, 2009, 10(12): 1171.
[11]Butterly L F, Chase M P, Pohl H, et al. Prevalence of clinically important histology in small adenomas[J]. Clin Gastroenterol Hepatol, 2006, 4(3): 343.
[12]Uraoka T, Saito Y, Ikematsu H, et al. Sano-s capillary pattern classification for narrow-band imaging of early colorectal lesions[J]. Dig Endosc, 2011, 23(1): 112.
[13]Kundel H L, Polansky M. Measurement of observer agreement[J]. Radiology, 2003, 228(2): 303.
[14]王静蓉. 放大-染色肠镜临床应用及发展[J]. 云南医药, 2007, 28(6): 597.
[15]王善娟, 陈世耀, 峻岭, 等. 带成像技术预测结直肠小息肉肿瘤性病变的准确性评估[J]. 中华消化杂志, 2014, 34(9): 622.
Value of Sano classification under magnifying narrow-band
imaging in the diagnosis of colorectal polyps
ZHU Bingliang, SHA Jie, YANG Aiping, GONG Jie
(DepartmentofGastroenterology,JingjiangPeople'sHospital,Jingjiang,Jiangsu,214500)
ABSTRACT:ObjectiveTo explore the diagnostic value of magnifying narrow-band imaging in distinguishing neoplastic from non-neoplastic colorectal polyps by using Sano classification system. MethodsA total of 197 lesions confirmed by pathology were selected in this study. Each lesion was observed in microvascular architecture by magnifying narrow-band imaging, and the histology was predicted according to Sano classification system. ResultsThe diagnostic accuracy, sensitivity, specificity, PPV, and NPV of magnifying narrow-band imaging were 97.5%(192/197), 98.1%(159/162), 94.3%(33/35), 98.8%(159/161), 91.7%(33/36) respectively. ConclusionSano classification with magnifying narrow-band imaging is effective in distinguishing neoplastic from non-neoplastic colorectal lesions.
KEYWORDS:narrow-band imaging; magnifying endoscopy; microvascular; Sano classification; colorectal neoplasm
收稿日期:2015-05-09
中图分类号:R 735.3
文献标志码:A
文章编号:1672-2353(2015)19-070-03
DOI:10.7619/jcmp.201519021

