替比夫定治疗慢性HBV感染孕妇分娩停药后生化学和病毒学研究
替比夫定治疗慢性HBV感染孕妇分娩停药后生化学和病毒学研究
王习习1,2, 韩国荣1, 王翠敏1, 丁祎1
(1. 东南大学附属第二医院 妇产科, 江苏 南京, 210003; 2. 江苏省江阴市妇幼保健院(所), 江苏 无锡, 214400)
关键词:替比夫定; 乙型肝炎; 妊娠; 肝功能
母婴传播阻断失败的独立危险因素是孕妇体内高水平的病毒载量。越来越多的临床研究[1]显示,对于高病毒载量的慢性HBV感染孕妇来说,有效的阻断方法是在主动-被动联合免疫的基础上给予抗病毒治疗。本科前期研究结果显示,对于高病毒载量、HBsAg和HBeAg双阳的孕妇,于妊娠20周开始替比夫定干预治疗,在阻断乙型肝炎病毒(HBV)宫内感染方面疗效显著[2]。有关孕期应用替比夫定分娩停药后孕产妇生化学与病毒学方面的变化研究目前较少。本研究探讨替比夫定停药后孕产妇的病毒学和生化学方面的变化,现报告如下。
1资料与方法
选取2011年1月—2014年3月在东南大学附属第二医院妇产科分娩及定期随访的慢性HBV感染孕妇共286例,经院方伦理委员会批准,孕妇知情并签署同意书。治疗组于孕中晚期开始服替比夫定至分娩后1~3个月停药,停药时检测HBV DNA阳性、HBeAg阳性、肝功能正常而停止服药或自行停药。对照组孕期不予抗病毒治疗。2组孕妇分娩/停药后肝功能异常者应用常规保肝药复方甘草酸苷片治疗。孕妇年龄21~37岁,平均(27.9±2.9)岁,分娩孕周34~40周,三维B超排除胎儿表面畸形。HBsAg和HBeAg均持续阳性>6个月且HBV DNA≥106copies/mL。孕期ALT和AST保持正常或仅ALT/AST升高1次且<1.5倍正常值上限(<60 U/L)。孕早期无保胎史。孕期无严重妊娠合并症和产后并发症。孕期或产后未使用其他药物免疫抑制剂、细胞毒性药物和抗病毒药物。血清甲、丙、丁、戊型肝炎标志物和HIV血清抗体检查呈阴性。
将286例孕妇根据孕期是否应用替比夫定干预治疗分为治疗组165例和对照组121例。治疗组于孕中晚期开始服替比夫定(600 mg/d)至分娩后1~3个月,检测HBV DNA阳性、HBeAg阳性、肝功能正常达到停药标准而停止服药或自行停药。对照组121例孕期不予任何抗病毒治疗。2组孕妇分娩/停药后肝功能异常者应用常规保肝药复方甘草酸苷片治疗。2组孕妇分别于分娩,停药后1、3、6个月检测肝功能生化指标(ALT和AST)、HBV DNA定量。
2结果
2.1 一般情况
2组孕妇年龄、孕产次、分娩孕周、分娩方式、治疗前HBV DNA定量和HBeAg平均水平、孕期ALT/AST均值、新生儿基线情况等差异均无统计学意义。两组孕妇共分娩287例活婴,治疗组一对双胞胎。
2.2 2组孕产妇分娩/停药后ALT检测结果
治疗组分娩停药后1、3、6个月时的ALT异常发生率分别为13.94%、7.27%、4.85%, 对照组产后1、3、6个月时的ALT异常发生率分别为31.4%、44.63%、19.01%。2组孕妇分娩/停药后ALT异常发生率比较,差异有统计学意义(P<0.01),见表1。治疗组停药后6个月内无1例发生重度肝功能异常,停药6个月时仅8例发生轻度肝功能异常。对照组3个月内有4例发生重度肝功能异常,产后6个月时有23例发生轻中度肝功能异常(60~249 U/L)。2组孕产妇主要在分娩/停药后3个月内发生肝功能异常。因此,孕产妇尤其要在停药/产后的3个月内定期检测肝功能,对肝功异常者需定期随访并行保肝干预治疗,以防重症肝炎的发生。
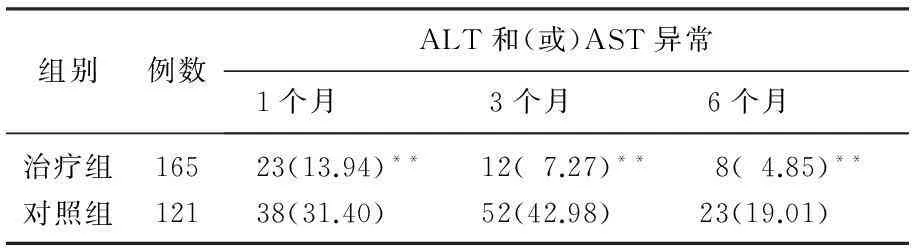
表1 2组孕产妇分娩/停药后ALT和(或)AST异常率比较[n(%)]
与对照组比较,**P<0.01。
2.3 2组孕产妇分娩/停药后HBV DNA检测结果
HBV DNA病毒定量,对照组分娩后1、3、6个月和治疗组停药后同期相比,差异无统计学意义(P>0.05),见表2。治疗组分娩前与停药后1、3、6个月HBV DNA病毒定量相比,差异有统计学意义(P<0.05),对照组则无显著差异。孕期治疗前与停药后1、3、6个月HBV DNA病毒定量相比,2组均无显著差异(P>0.05)。停药1个月时,HBV DNA病毒定量基本恢复至治疗前水平。治疗组停药后1个月有163例反弹至抗病毒治疗前水平,有2例HBV DNA定量持续转阴,随访至停药后6个月仍保持HBV DNA阴性,2组各有1例患者于产后3月爆发中-重度肝功能异常,接受抗病毒治疗,于停药/产后6月复查发现HBV DNA转阴,对照组其余患者均未发生HBV DNA转阴。

表2 2组孕产妇孕期与分娩/停药后HBV DNA水平的比较(log copies/mL)
与同组分娩前比较,*P<0.05; 与同期对照组比较,#P<0.05。
2.4 2组孕产妇分娩/停药后随访结局
治疗组产妇停药后肝功能异常发生率明显低于对照组。2组孕产妇肝功能异常者接受常规保肝药复方甘草酸苷片治疗或自行恢复。治疗组停药后1个月时,有23例发生轻度肝功能异常(64.5~141.6 U/L); 停药后3个月时,有3例出现中度肝功能异常,其中1例再次接受抗病毒治疗,至停药后6月复查发现肝功复常、HBV DNA转阴和HBeAg转阴;随访至1年时,仅有2例轻度肝功能异常(67.2~80 U/L), 目前仍在口服保肝药及随访中。对照组产后1个月时,肝功能异常者34例,其中中度和重度异常者各4例(61~599.1 U/L); 至产后3个月时发生中度和重度肝功异常者各3例,其中1例重度肝功能异常患者接受恩替卡韦抗病毒治疗,于产后1年复查发现肝功复常和HBV DNA转阴;产后6个月时仍有5例中度异常者,予抗病毒或干扰素治疗,随访至产后1年时复查发现有3例肝功能复常, 2例轻度肝功异常(63.9~197.8 U/L), 后期继续治疗与随访。对照组肝功能复常后失访9例。
3讨论
在中国,母婴垂直传播感染HBV所致的比例占一半以上,而且慢性HBV感染是与年龄成反比的,如婴幼儿时期的HBV感染有25%~30%将发展为慢性,而围产期感染发展为慢性感染的比率可升至90%[3-4]。慢性HBV感染可向肝硬化、原发性肝癌等方向进展。阻断母婴垂直传播的重点和难点是宫内感染的阻断。宫内新生儿HBV感染主要与孕妇血清内HBV DNA的高载量有关。目前,全球多中心临床试验和临床应用[5-7]显示,e抗原阳性的高病毒含量的慢性HBV感染孕妇,于妊娠期接受替比夫定抗病毒治疗,从而有效降低新生儿HBV感染,且收到理想的耐受性和安全性。
替比夫定阻断HBV母婴传播的机制主要是快速而有效地降低孕妇血清HBV DNA含量[8-9],使病毒复制繁殖停止,从而达到预防宫内感染的目标。本研究结果显示,治疗组分娩前血清HBV DNA的浓度明显低于治疗前水平,分娩后1~3个月停药。停药1个月时,治疗组165例患者HBV DNA病毒定量基本恢复至治疗前水平,有163例反弹至抗病毒治疗前水平,有2例HBV DNA定量持续转阴,随访至停药后6个月仍保持HBV DNA阴性,其中1例分娩前HBV DNA已转阴,至产后1个月停药后持续保持阴性;另1例分娩即停药,产后1月检测HBV DNA已转阴并保持。对照组分娩前后血清HBV DNA的浓度差异无统计学意义,除了有1例患者于产后3月爆发重度肝功能异常接受抗病毒治疗,于产后6月复查发现HBV DNA转阴和HBeAg转阴外,其余均未发生HBV DNA转阴。陈蓉等[10]也报道妊娠25周开始口服替比夫定100 mg/d, 分娩后4、12周停药者,停药后1个月均达到抗病毒治疗前水平,未用药者产后HBV DNA定量无明显变化。
一旦妊娠,机体更加倾向于免疫耐受状态,细胞因子Th1/Th2型在这一免疫耐受背景的维持中发挥相当的作用,呈Th2型细胞因子分泌增多而Th1型细胞因子分泌减少的状态,即Th2优势应答,使得母亲的免疫应答得以逃避[11-12]。所以,即使妊娠后母体内激素水平的变化和肝脏负担的加重,但ALT一般仍能保持持续正常和高水平的HBV DNA复制,若出现ALT波动,则提示机体进入免疫活化状态即清除HBV[13]。而分娩时的生理需要与变化等因素亦可加重肝脏负担,导致产后肝功能相关指标随之发生异常。本研究结果显示,对照组免疫耐受期的孕妇,产后1、3个月时的ALT异常发生率分别为31.4%、42.98%。另有报道[14]显示,免疫耐受期HBV感染的妊娠妇女产后ALT升高的发生率为32.6%, 也与本研究基本一致。本研究重在分析产后不同时间点的发生率,而不是所有孕产妇中产后发生异常的个体与总体的比较。Tan等[15]报道指出,HBV感染的孕妇有一半以上产后会发生ALT升高,HBsAg和HBeAg双阳母亲产后ALT异常者高达66.7%, 该报道中部分母亲处于免疫活化状态,孕期ALT异常升高,而本研究中对照组所有产妇均为免疫耐受期,这就和产后ALT异常发生率偏高有关。孕期肝功能波动或者升高者,产后ALT发生异常率可有所升高。本研究中替比夫定于妊娠中晚期应用,分娩停药后ALT异常发生率明显低于对照组,差异有统计学意义(P<0.01)。治疗组停药后半年内无1例发生重度肝功能异常,与陈蓉等[12]研究结果一致。而对照组产后1个月时,重度异常者4例(61~599.1 U/L); 至产后3个月时,重度肝功能异常者3例。可见替比夫定降低HBV DNA含量的同时还有一定的免疫调节作用,除了能更好地复常孕期肝功能,还能稳定分娩停药后的肝功能变化,减少重度肝功异常的发生。
参考文献
[1]Singh A E, Plitt S S, Osiowy C, et al. Factors associated with vaccine failure and vertical transmission of hepatitis B among acohort of Canadian mothers and infants[J]. J Viral Hepat, 2011, 18: 468.
[2]Han G R, Cao M K, Zhao W, et al.A prospettive and open-label study for the efficacy of and safety of telbivudine in pregnancy for the prevention ofperinatal transmission of hepatitis B virus infection[J]. JHepatol, 2011, 55: 1215.
[3]Tran T T. Management of hepatitis B in pregnancy: weighing the options[J]. Cleve Clin J Med, 2009, 76 (Suppl 3): S25.
[4]卢永平, 陈友鹏, 梁旭竞. 替比夫定阻断乙型肝炎病毒宫内感染的研究进展[J]. 中华传染病杂志, 2013, 31(4): 254.
[5]HAN G R, JIANG H X, WANG G J, et al.Efficacy and safety of telbivudine in pregnant women to prevent perinatal transmission of hepatitis B virus[J]. Chin J Hepatol, 2012, 20(3): 201.
[6]PAN C Q, HAN G R, JIANG H X, et al. Telbivudine prevents vertical transmission from HbeAg-positive women with chronic hepatitis B[J]. Chin J Hepatol, 2012, 10(5): 520.
[7]孙维会, 初蕾蕾, 柳维林, 等. 替比夫定阻断HBV DNA高载量孕妇母婴传播的疗效和安全性观察[J]. 临床肝胆病杂志, 2013, 29(8): 596.
[8]姜捷, 丁登森, 刘国庆.替比夫定与阿德福韦酯治疗慢性乙型肝炎近期病毒学和生化学应答比较[J]. 山东医药.2010, 50(13): 47.
[9]黄鸿菲, 何登明, 吴全新, 等. HBeAg阳性慢性乙型肝炎孕妇替比夫定治疗前后血清Th1/Th2型细胞因子的水平变化[J]. 临床肝胆病杂志, 2014, 30(6): 522.
[10]陈蓉, 刘寿荣, 张素英, 等. 替比夫定阻断乙型肝炎病毒母婴垂直传播及分娩后停药时间对母亲安全性的影响[J]. 中华肝脏病杂志, 2012, 20(9): 703.
[11]BETZ A G. Immunology: tolerating pregnancy[J]. Nature, 2012, 490: 47.
[12]YUE L, TAN J Y, LI S H, et al. Research advances in mechanisms of immune tolerance during pregnancy[J]. Meteral Child Health Care, 2012, 27(5): 784.
[13]HAY JE.Liver disease in pregnancy[J]. Hepatology, 2008, 47(3): 1067.
[14]曹彦君, 易为, 刘敏, 等. 免疫耐受期HBV感染的孕妇产后肝功能变化的观察[J]. 中华实验和临床感染病杂志, 2013, 7(3): 444.
[15]Tan H H, Lui H F, Chow W C. Chronic hepatitis B virus (HBV) infectionin pregnancy[J]. Hepatol Int, 2008, 2(3): 370.
收稿日期:2014-09-16
中图分类号:R 512.6
文献标志码:A
文章编号:1672-2353(2015)07-136-03DOI: 10.7619/jcmp.201507044

