Hp阳性消化性溃疡患者血清TGF-β1、α-防御素和IL-17表达的临床研究
何小谷, 方向明, 汪 勇, 陈 时, 邓 琴
(湖北省武汉市普仁医院 消化内科, 湖北 武汉, 430081)
Hp阳性消化性溃疡患者血清TGF-β1、α-防御素和IL-17表达的临床研究
何小谷, 方向明, 汪勇, 陈时, 邓琴
(湖北省武汉市普仁医院 消化内科, 湖北 武汉, 430081)
摘要:目的探讨幽门螺旋杆菌(Hp)检测阳性的消化性溃疡患者血清转化生长因子-β1(TGF-β1)、α-防御素和白细胞介素-17(IL-17)的表达水平变化的临床意义。方法选取Hp阳性消化性溃疡患者45例为消化性溃疡组,同期体检无消化系统疾病者45例为健康对照组。检测2组血清中TGF-β1、α-防御素和IL-17水平。结果与健康对照组相比,消化性溃疡组血清TGF-β1和IL-17的水平显著升高(P<0.05或P<0.01), α-防御素水平显著下降(P<0.01)。根据消化性溃疡部位分组,复合型溃疡组血清IL-17的水平较胃溃疡组和十二指肠溃疡高,差异有统计学意义(P<0.05或P<0.01)。结论TGF-β1、α-防御素和IL-17均参与Hp阳性消化性溃疡炎症反应,不同部位消化性溃疡患者血清IL-17表达水平不同。
关键词:消化性溃疡; 幽门螺旋杆菌; 血清转化生长因子-β1; 白细胞介素-17; α-防御素
消化性溃疡包括胃和十二指肠溃疡,是一种消化系统炎症疾病近年来,随着人们生活质量提高以及生活压力增大,消化性溃疡的发病率呈现上升趋势[1]。消化性溃疡发生通常由胃黏膜损害因素和防御因素间失衡导致,其中幽门螺杆菌(Hp)感染损害胃黏膜屏障被认为是导致消化性溃疡的一个重要因素[2-3]。相关研究[4]显示,Hp阳性者一生中患消化性溃疡的风险是阴性者的3倍以上。Hp感染后,可介导体内产生异常的细胞免疫,引起溃疡的进一步形成[5-6], 而转化生长因β1(TGF-β1)、α-防御素和白细胞介素17(IL-17)均参与了细胞免疫调节过程。本研究通过对HP检测阳性消化性溃疡患者血清TGF-β1、α-防御素和白细胞介素17(IL-17)表达水平进行检测,旨在探讨其与消化性溃疡发生发展的关系。
1资料与方法
1.1 一般资料
选取2013年4月—2014年4月武汉市普仁医院消化内科收治,且通过快速尿素酶检测及病理活检证实为Hp阳性的消化性溃疡患者45例为消化性溃疡组,其中男27例,女18例,年龄21~65岁。根据溃疡发生部位具体细分为胃溃疡21例、十二指肠溃疡15例和复合性溃疡9例。随机抽取同期入院体检健康者45例,均无消化系统疾病,其中男29例,女16例,年龄19~70岁。排除其他脏器或淋巴肿瘤、心血管系统疾病、免疫系统疾病、感染性疾病、肝、肾功能不全患者。2组性别、年龄等一般资料差异无统计学意义(P>0.05),见表1。
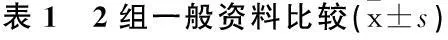
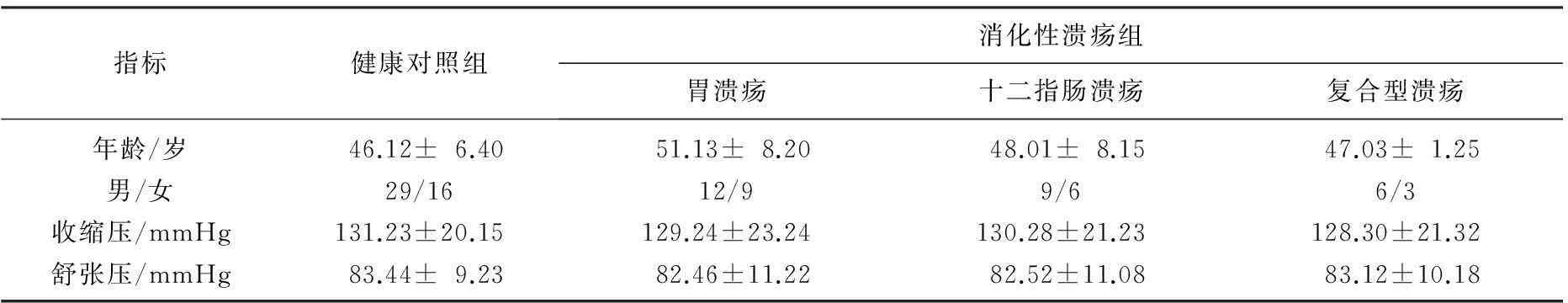
指标健康对照组消化性溃疡组胃溃疡十二指肠溃疡复合型溃疡年龄/岁46.12±6.4051.13±8.2048.01±8.1547.03±1.25男/女29/1612/99/66/3收缩压/mmHg131.23±20.15129.24±23.24130.28±21.23128.30±21.32舒张压/mmHg83.44±9.2382.46±11.2282.52±11.0883.12±10.18
1.2 方法
1.2.1主要试剂及仪器:人TGF-β1酶联免疫分析试剂盒(上海复蒙基因生物科技有限公司);人IL-17酶联免疫分析试剂盒(碧云天生物技术研究所);人α-防御素检测试剂盒(上海科呈生物科技有限公司); SH-100 Lab全波长酶标仪(日本日立公司); 5840R型台式冷冻高速离心机(德国Eppendorf公司)。
1.2.2样本采集:研究对象均在体检当日清晨抽取空腹静脉血4 mL,采集后在常温下放置30 min, 3 000转/min离心10 min, 剔除溶血标本,吸取上清液,于-20 ℃冰箱中保存备检。使用SH-100 Lab全波长酶标仪,采用ELISA法检测血清中TGF-β1、α-防御素和IL-17的浓度,严格按照试剂盒说明书进行操作。
1.3 观察指标
观察消化性溃疡组和健康对照组受试者血清TGF-β1、α-防御素和IL-17表达水平,以及不同部位消化性溃疡患者IL-17表达水平的差异。
2结果
2.1 2组血清TGF-β1、α-防御素和IL-17表达水平
消化性溃疡组血清TGF-β1和IL-17表达水平显著高于健康对照组(P<0.05或P<0.01); 血清α-防御素表达水平显著低于健康对照组(P<0.01), 见表2。
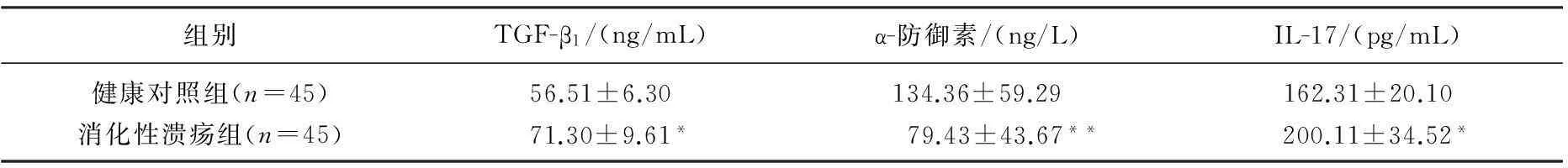
组别TGF-β1/(ng/mL)α-防御素/(ng/L)IL-17/(pg/mL)健康对照组(n=45)56.51±6.30134.36±59.29162.31±20.10消化性溃疡组(n=45)71.30±9.61*79.43±43.67**200.11±34.52*
与健康对照组比较, *P<0.05; **P<0.01。
2.2 不同部位消化性溃疡患者血清IL-17水平比较
血清IL-17表达水平在胃溃疡、十二指肠溃疡和复合型溃疡患者中分别为(195.31±19.60)、(197.32±22.40)和(218.02±21.50) pg/mL, 均显著高于健康对照组的(162.31±20.10) pg/mL(P<0.05或P<0.01)。不同部位消化性溃疡比较,复合型溃疡患者血清IL-17表达水平显著高于胃溃疡和十二指肠溃疡患者(P<0.05或P<0.01)。
3讨论
消化性溃疡多由物理或化学因素损伤而导致胃黏膜屏障被破坏,引起胃肠道粘膜修复机制失衡,继而引起溃疡等一系列炎症反应。消化性溃疡损害因素众多,包括胃酸、Hp感染、药物因素、胆盐等,其中Hp感染与消化性溃疡密切相关[7-8]。Hp是一种革兰阴性微量需氧菌,研究认其分泌的毒素引起胃黏膜损害、宿主免疫应答介导胃黏膜损伤及感染所致的胃酸分泌和调节异常是主要致病机制[9]。此外,除幽门部位,Hp也存在于胃的其他部位以及十二指肠等处,但不论哪一种消化性溃疡,都和Hp导致的黏膜屏障的损害有关[10]。
消化性溃疡患者多存在免疫调节紊乱,体内释放多种细胞因子。TGF-β1属于TGF-β超家族的一员,由两个结构相同或者相近的亚单位同孤傲二硫键链接而成,分子量25 kD。TGF-β1具有调节细胞生长和分化的能力,可以抑制免疫活性细胞增殖及细胞因子产生,抑制免疫应答和炎症反应[11-12]。α-防御素是一种小分子抗菌肽,具有免疫调节作用,其通过诱导细胞因子的释放以细胞间信号传导及介导其他分子协同反应来活化T细胞,间接引起特异性免疫应答[13], 有研究[14]显示,Hp感染会导致人中性粒细胞分泌α-防御素。IL-17是Th17细胞的主要效应因子,属于T细胞来来源的致炎因子,其可以作用与IL-6、IL-8等细胞因子,也可以激活补体系统产生反应蛋白,诱导炎症的发生[15-16]。本研究结果显示,与健康对照组相比,消化性溃疡组血清TGF-β1和IL-17水平显著升高, α-防御素水平显著降低。血清TGF-β1水平升高可能是由于患者免疫功能降低,免疫细胞被抑制所导致的;血清α-防御素表达水平降低可能和受到体内基因蛋白水平的调控所致有关,黎运西等[17]则报道了胃十二指肠溃疡活动期α-防御素基因相对表达水平较健康人群显著增高,因此α-防御素和消化性溃疡的关系仍需进一步研究。另外,不同部位消化性溃疡患者对比,复合型溃疡患者血清IL-17表达水平显著高于胃溃疡和十二指肠溃疡患者,与相关研究结果一致[18], 提示血清IL-17水平高低可能和消化性溃疡的病变程度有关。但由于本研究样本较小,因此之间关联需扩大样本进一步证明。
参考文献
[1]周虹, 吕农华. 消化性溃疡并出血高危因素的研究进展[J]. 世界华人消化杂志, 2010, 18(33): 3544.
[2]蓝菊慧. 幽门螺旋杆菌所致消化性溃疡的发病机制和治疗近况[J]. 临床合理用药杂志, 2012, 5(4): 161.
[3]Bashinskaya B, Nahed B V, Redjal N, et al. Trends in peptic ulcer disease and the identification of Helicobacter Pylori as a causative organism: population-based estimates from the US nationwide inpatient sample[J]. J Glob Infect Dis, 2011, 3(4): 366.
[4]Kang J M, Kim N, Lee B H, et al. Risk factors for peptic ulcer bleeding in terms of Helicobacter pylori, NSAIDs, and antiplatelet agents[J]. Scand J Gastroenterol, 2011, 46(11): 1295.
[5]Yang Y J, Chuang C C, Yang H B, et al. Lactobacillus acidophilus ameliorates H. pylori-induced gastric inflammation by inactivating the Smad7 and NFκB pathways [J]. BMC Microbiol, 2012, 12(1): 38.
[6]McColl K E L. Helicobacter pylori infection[J]. N Engl J Med, 2010, 362(17): 1597.
[7]Lau J Y, Sung J, Hill C, et al. Systematic review of the epidemiology of complicated peptic ulcer disease: incidence, recurrence, risk factors and mortality[J]. Digestion, 2010, 84(2): 102.
[8]翁志雄, 余志金, 乐胜, 等. 老年人消化性溃疡并发出血的危险因素分析[J]. 中国现代医生, 2010 (11): 127.
[9]胡伏莲. 消化性溃疡发病机制的现代理念[J]. 中华消化杂志, 2005, 25(3): 189.
[10]胡伏莲. 幽门螺杆菌相关性溃疡再认识[J]. 现代消化及介入诊疗, 2011, 16(3): 171.
[11]厉琴, 刘畅, 樊荣, 等. 消化性溃疡患者血清IL-2, IL-6和TGF-β1检测的临床意义[J]. 放射免疫学杂志, 2013, 26(2): 143.
[12]Serrano C A, Talesnik E, Pena A, et al. Inverse correlation between allergy markers and Helicobacter pylori infection in children is associated with elevated levels of TGF-β[J]. Eur J Gastroenterol Hepatol, 2011, 23(8): 656.
[13]杨玉荣, 刘占举, 梁宏德. 防御素在炎症性肠病中的作用机制[J]. 世界华人消化杂志, 2010, 18(29): 3101.
[14]Kocsis A K, Ocsovszky I, Tiszlavicz L, et al. Helicobacter pylori induces the release of α-defensin by human granulocytes [J]. Inflamm Res, 2009, 58(5): 241.
[15]刘亚普, 张艳. 白细胞介素-17 与幽门螺杆菌感染所致胃疾病的相关性研究[J]. 国际免疫学杂志, 2010, 33(4): 273.
[16]李金文, 刘毅, 赵莉. 血清IL-17在消化性溃疡患者体内水平变化的意义[J]. 中国医药指南, 2013, 11(24): 130.
[17]黎运西, 林超群, 申可, 等. α-防御素检测在消化性溃疡炎症评估中的作用[J]. 广东医学, 2013, 34(17): 2698.
[18]陈曦. 血清IL-17在消化性溃疡的水平变化及意义[J]. 现代预防医学, 2012, 39(7): 1756.
Clinical study on changes of serum TGF-β1、 α-defensin and IL-17 in patients with helicobacter pylori positive peptic ulcer
HE Xiaogu, FANG Xiangming, WANG Yong, CHEN Shi, DENG Qin
(DepartmentofGastroenterology,WuhanPurenHospital,Wuhan,Hubei, 430081)
ABSTRACT:ObjectiveTo investigate the changes in serum levels of transforming growth factor β1(TGF-β1)、α-defensin and interleukin-17 (IL-17) in patients with helicobacter pylori (Hp) positive peptic ulcer.MethodsForty five patients with Hp positive peptic ulcer and 45 healthy people without digestive system diseases were assigned to peptic ulcer group and healthy control group respectively. Serum levels of TGF-β1, α-defensin and IL-17 were measured and compared between two groups. ResultsCompared with the control group, the serum TGF-β1and IL-17 levels significantly elevated(P<0.05, P<0.01) and the α-defensin decreased(P<0.01) in the peptic ulcer group. Subdivided by the location of ulcer, patients with compound ulcer achieved higher serum levels of IL-17 when compared with those with gastric and duodenal ulcer (P<0.05, P<0.01). ConclusionTGF-β1, α-defensin and IL-17 are involved in inflammation of Hp positive peptic ulcer, and level of serum IL-17 is various based on different sites of peptic ulcer.
KEYWORDS:peptic ulcer; helicobacter pylori; TGF-β; IL-17; α-defensin
基金项目:中国高校医学期刊临床专项资金(11520696)
收稿日期:2014-12-11
中图分类号:R 364.1
文献标志码:A
文章编号:1672-2353(2015)07-047-03DOI: 10.7619/jcmp.201507013

