不同种类脂肪酸对巨噬细胞M1/M2极化的影响*
不同种类脂肪酸对巨噬细胞M1/M2极化的影响*
罗雯静隋永恒连敏华静#
上海交通大学医学院附属仁济医院消化内科上海市消化疾病研究所(200001)

*基金项目:国家自然科学基金(No. 81170374, No. 81470842)
背景:巨噬细胞表型和功能改变在非酒精性脂肪性肝病(NAFLD)的发生、发展中具有重要作用。近年研究发现不同种类脂肪酸在NAFLD中发挥不同作用。目的:探讨不同种类脂肪酸对巨噬细胞M1/M2极化的影响及其可能机制。方法:分别以脂多糖(LPS)、白细胞介素-4(IL-4)、饱和脂肪酸[棕榈酸(PA)]、多不饱和脂肪酸[二十二碳六烯酸(DHA)]、LPS/IL-4联合PA/DHA处理小鼠单核巨噬细胞RAW264.7细胞株,同时设立阴性对照组。采用real-time PCR检测M1型巨噬细胞极化基因[诱生型一氧化氮合酶2(iNOS2)、肿瘤坏死因子-α(TNF-α)]和M2型巨噬细胞极化基因[精氨酸酶1(ARG1)、甘露糖受体C2(MRC2)]表达;采用蛋白质印迹法检测过氧化物酶体增殖物激活受体γ(PPARγ)和磷酸化核因子-κBp65(pNF-κBp65)表达。结果:与阴性对照组比较,LPS组iNOS2、TNF-α表达显著升高(P<0.01;P<0.05),IL-4组ARG1、MRC2表达显著升高(P<0.01;P<0.05),PA组iNOS2、TNF-α、ARG1表达显著升高(P<0.05;P<0.01;P<0.05),DHA组iNOS2表达显著降低(P<0.01)。LPS+PA组和IL-4+PA组可进一步影响TNF-α、ARG1表达,但与LPS组、IL-4组比较差异无统计学意义(P>0.05)。与LPS组比较,LPS+DHA组iNOS2、TNF-α表达显著降低(P<0.05;P<0.05);与IL-4组比较,IL-4+DHA组ARG1表达显著降低(P<0.01)。与阴性对照组比较,PA组、DHA组PPARγ蛋白表达水平显著升高,PA组pNF-κBp65蛋白表达水平显著升高。结论:饱和脂肪酸能诱导巨噬细胞M1/M2混合型极化,而多不饱和脂肪酸则抑制巨噬细胞M1型极化。不同种类脂肪酸可能通过PPARγ/NF-κB相关信号通路参与巨噬细胞M1/M2极化的转化。
关键词脂肪酸类;巨噬细胞;过氧化物酶体增殖物激活受体;NF-κB;非酒精性脂肪性肝病
Non-Alcoholic Fatty Liver Disease
非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)是与胰岛素抵抗密切相关的遗传-环境-代谢应激性临床病理综合征。近年研究发现,不同种类脂肪酸在NAFLD中具有不同作用,饱和脂肪酸介导的肝内炎症-免疫紊乱在NAFLD的发生、发展中发挥重要作用[1],而多不饱和脂肪酸可减少肝内脂肪沉积,对NAFLD具有一定治疗效应[2-3]。巨噬细胞是机体免疫防御的重要组成成分,具有高度的异质性和可塑性,在体内外不同微环境作用下可分化为M1型巨噬细胞即经典活化的巨噬细胞(classically activated macrophages, CAM)和M2型巨噬细胞即替代活化的巨噬细胞(alternative activated macrophages, AAM)[4]。研究[5]指出,巨噬细胞表型和功能改变在NAFLD的发生、发展中具有重要作用。本研究旨在探讨不同种类脂肪酸对巨噬细胞M1/M2极化的影响及其可能机制。
材料与方法
一、细胞株和主要试剂
小鼠单核巨噬细胞RAW264.7细胞株购自中国科学院细胞库。DMEM培养基、胎牛血清(FBS)购自Gibco公司;脂多糖(lipopolysaccharide, LPS)、棕榈酸(palmitic acid, PA)、二十二碳六烯酸(docosahexaenoic acid, DHA)购自Sigma公司;白细胞介素-4(IL-4)购自PeproTech公司;Trizol试剂、逆转录试剂盒、PCR试剂盒购自Takara公司;PCR引物购自生工生物工程(上海)股份有限公司;兔抗鼠过氧化物酶体增殖物激活受体γ(PPARγ)抗体、兔抗鼠磷酸化核因子-κBp65(pNF-κBp65)抗体购自Cell Signaling Technology公司。
二、方法
1. 细胞培养:RAW264.7细胞培养于含10% FBS的DMEM培养基中(37 ℃、5% CO2),培养至第3代后调整细胞浓度至1×105/mL,接种于6孔板和12孔板,培养24 h使细胞密度达到80%。
2. 细胞处理:RAW264.7细胞培养24 h后换液,分别以含LPS(100 ng/mL)、IL-4(5 ng/mL)、PA(0.5 mmol/L)、DHA(50 μmol/L)、LPS+PA(100 ng/mL+0.5 mmol/L)、LPS+DHA(100 ng/mL+50 μmol/L)、IL-4+PA(5 ng/mL+0.5 mmol/L)、IL-4+DHA(5 ng/mL+50 μmol/L)的DMEM培养基培养,阴性对照组RAW264.7细胞以DMEM培养基培养。置于37 ℃、5% CO2培养箱内分别培养6 h和24 h,洗去培养液,收集细胞待测。
3. Real-time PCR法:取上述各处理组培养6 h的细胞,以Trizol试剂提取总RNA,逆转录合成cDNA,行real-time PCR检测M1型巨噬细胞极化基因表达水平,包括诱生型一氧化氮合酶2(inducible nitric oxide synthase 2, iNOS2)、肿瘤坏死因子-α(tumor necrosis factor-α , TNF-α);M2型巨噬细胞极化基因表达水平,包括精氨酸酶1(arginase 1, ARG1)、甘露糖受体C2(mannose receptor C type 2, MRC2)。iNOS2引物上游:5’-GTG TTC CAC CAG GAG ATG TTG-3’,下游:5’-CTC CTG CCC ACT GAG TTC GTC-3’;TNF-α引物上游:5’-TCT TCT CAT TCC TGC TTG TGG-3’,下游:5’-GGT CTG GGC CAT AGA ACT GA-3’; ARG1引物上游:5’-CTC CAA GCC AAA GTC CTT AGA G-3’,下游:5’-AGG AGC TGT CAT TAG GGA CAT C-3’;MRC2引物上游:5’-TAC AGC TCC ACG CTA TGG ATT-3’,下游:5’-CAC TCT CCC AGT TGA GGT ACT-3’;β-actin引物上游:5’-TGT TAC CAA CTG GGA CGA CA-3’,下游:5’-CTG GGT CAT CTT TTC ACG GT-3’。反应条件:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火30 s,40个循环。以2-△△Ct法计算目的基因mRNA相对表达量。
4. 蛋白质印迹法:取经LPS、IL-4、PA、DHA处理24 h以及相同培养时间的阴性对照组细胞,以细胞裂解液抽提细胞总蛋白。取蛋白样品行SDS-PAGE电泳,湿法电转至PVDF膜,5%脱脂牛奶封闭2 h,分别加入兔抗鼠PPARγ抗体(1∶500)、兔抗鼠pNF-κBp65抗体(1∶500)、兔抗鼠GAPDH抗体(1∶10 000),4 ℃孵育过夜,室温复温30 min,以TBS-T清洗后,加入HRP偶联的羊抗兔二抗(1∶10 000),室温孵育1 h,以ECL发光剂显色,置暗盒X线曝光,常规显影、定影。
三、统计学分析
结果
一、脂肪酸对M1/M2型巨噬细胞极化基因表达的影响
Real-time PCR检测结果显示,与阴性对照组比较,LPS组iNOS2、TNF-α表达显著升高(P<0.01;P<0.05),IL-4组ARG1、MRC2表达显著升高(P<0.01;P<0.05),PA组iNOS2、TNF-α、ARG1表达显著升高(P<0.05;P<0.01;P<0.05),DHA组iNOS2表达显著降低(P<0.01)(图1)。
二、脂肪酸联合LPS/IL-4对M1/M2型巨噬细胞极化基因表达的影响
Real-time PCR检测结果显示,与LPS组、IL-4组比较,LPS+PA组和IL-4+PA组可进一步影响TNF-α、ARG1表达,但差异无统计学意义(P>0.05);与LPS组比较,LPS+DHA组iNOS2、TNF-α表达显著降低(P<0.05;P<0.05);与IL-4组比较,IL-4+DHA组ARG1表达显著降低(P<0.01)(图2)。
三、脂肪酸对巨噬细胞PPARγ、pNF-κBp65蛋白表达的影响
蛋白质印迹法检测结果显示,与阴性对照组比较,LPS组、PA组、DHA组PPARγ蛋白表达水平有所升高,尤以PA组、DHA组为著;LPS组、PA组pNF-κBp65蛋白表达水平有所升高,尤以PA组为著;IL-4组、DHA组pNF-κBp65蛋白表达水平无明显变化(图3)。
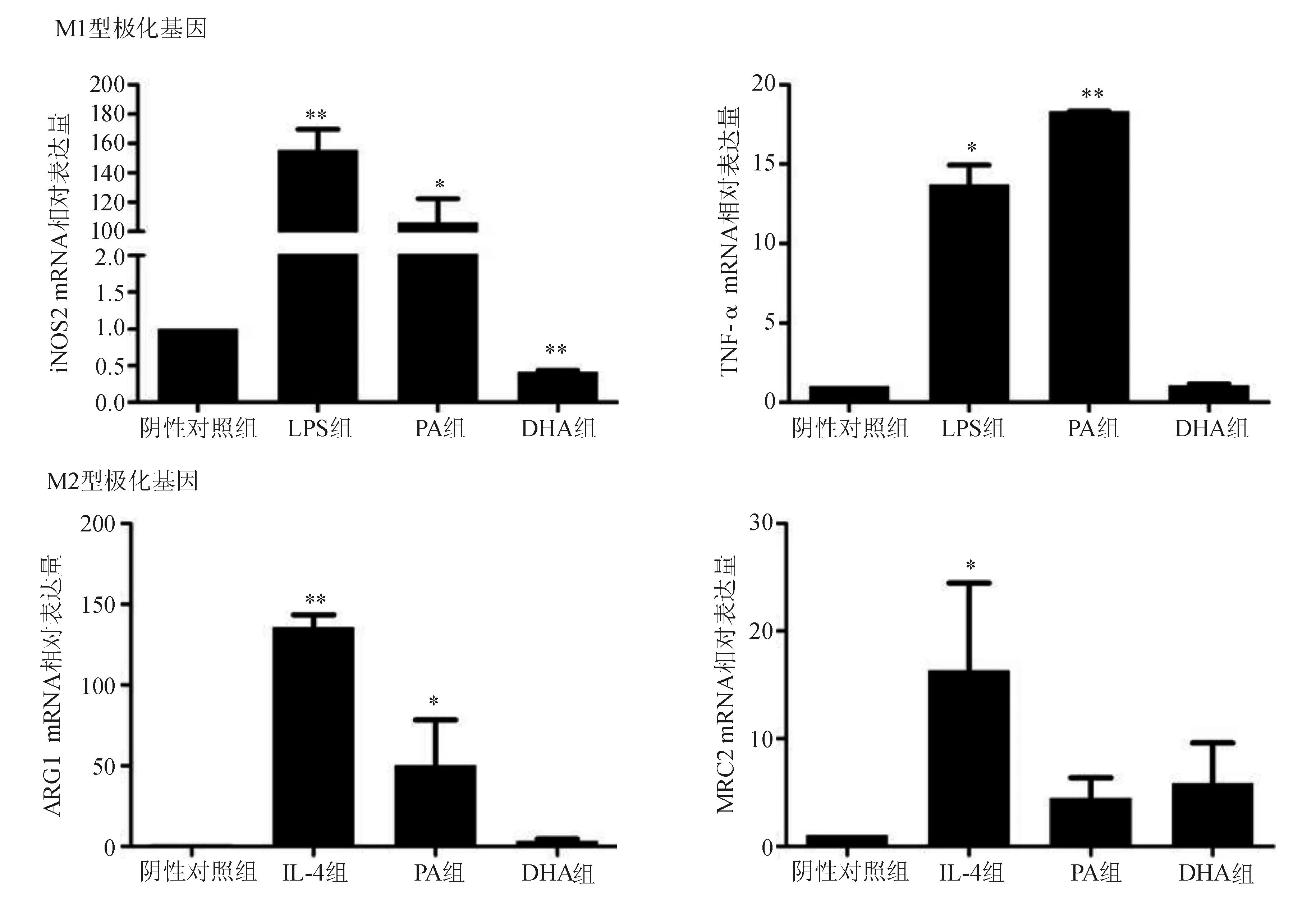
与阴性对照组比较,*P<0.05,**P<0.01

与LPS/IL-4组比较,*P<0.05,**P<0.01

图3不同种类脂肪酸对巨噬细胞PPARγ、pNF-κBp65蛋白表达的影响(蛋白质印迹法)
讨论
巨噬细胞是机体免疫防御机制中的重要成分,在天然免疫和适应性免疫中具有重要调节作用。巨噬细胞可针对不同刺激信号作出应答,并分化成为具有不同功能的表型细胞即极化,其极化类型主要包括经典活化的M1型和替代活化的M2型。M1型巨噬细胞由LPS、干扰素-γ(IFN-γ)、TNF等诱导活化,其活化标志包括iNOS2、单核细胞趋化蛋白-1(MCP-1)、TNF-α、IL-6等,与炎症反应的启动和维持有关;M2型巨噬细胞由IL-4、IL-13、IL-33、IL-21等诱导活化,其活化标志包括ARG1、MRC2、IL-10、Pdcd1lg2、CD163等,与炎症反应缓解、组织重塑和免疫调节有关[4]。近年研究指出,肥胖动物脂肪组织中M1型巨噬细胞浸润增加,与脂肪细胞功能障碍、胰岛素抵抗密切相关;而体瘦动物脂肪组织中的巨噬细胞以M2型为主,且高脂饮食致其肥胖后可引起M2型巨噬细胞向M1型转变[6-7]。此外,研究[8-9]显示小鼠肝内M1型巨噬细胞-Kupffer细胞极化可导致非酒精性脂肪性肝炎(NASH)程度加重,而消除Kupffer细胞则可预防肝脏脂肪变性和胰岛素抵抗的进展。上述结果提示,在肥胖、NAFLD的发生、发展过程中,脂肪组织、肝脏微环境的改变可能对巨噬细胞/Kupffer细胞极化产生重要影响。
不同种类的脂肪酸具有不同炎症-免疫调节功能。本研究组既往研究[10]发现,饱和脂肪酸与胰岛素抵抗、NAFLD进展相关,而多不饱和脂肪酸则对机体具有保护作用。本研究在此基础上进一步探讨不同种类脂肪酸对巨噬细胞极化的影响,结果显示饱和脂肪酸PA可诱导巨噬细胞M1/M2混合型极化,以M1型极化为著,而多不饱和脂肪酸DHA则能显著降低M1型巨噬细胞极化基因表达,并抑制LPS诱导的M1型巨噬细胞极化。本研究组近期研究[11]发现,体内外高脂环境(饱和脂肪酸为主)可诱导Kupffer细胞活化。由此推测,饱和脂肪酸可能通过诱导M1型巨噬细胞极化参与NAFLD的发生、发展,而多不饱和脂肪酸则通过抑制甚至逆转M1型巨噬细胞极化阻止NAFLD进展。
研究显示,饱和脂肪酸可通过Toll样受体4(TLR4)信号通路调节NF-κB等转录因子介导的炎症反应发生[12]。NF-κB是M1型巨噬细胞活化的关键转录因子,当NF-κB的作用受到抑制时,巨噬细胞可从M1型向M2型转化[13]。PPARγ亦参与巨噬细胞极化,与M2型巨噬细胞的诱导和维持有关。Odegaard等[14]的研究发现,PPARγ基因缺失小鼠的脂肪组织中缺乏M2型巨噬细胞,可致脂质代谢异常和胰岛素抵抗。PPARγ调节M2型巨噬细胞极化的机制尚未完全阐明。研究[15]指出,PPARγ可通过反向抑制作用干扰NF-κB信号通路,降低LPS诱导的巨噬细胞炎性信号途径活化,这可能是其发挥抗炎和免疫调节作用的关键机制。本研究发现,饱和脂肪酸PA可显著上调PPARγ和pNF-κBp65蛋白表达水平,而多不饱和脂肪酸DHA可增加PPARγ蛋白表达,对pNF-κBp65表达无影响。上述结果提示,饱和脂肪酸可能作为非微生物性危险信号启动巨噬细胞NF-κB炎性信号途径,并引起具有抗炎作用的PPARγ反馈性表达增加,因此巨噬细胞表现为M1/M2型混合型极化以抑制过度的炎症反应,而多不饱和脂肪酸作为PPARγ的重要天然配体诱导PPARγ表达增加,尽管未见其能显著诱导M2型巨噬细胞极化,但对M1型极化具有显著抑制作用,可能与上调PPARγ表达以干扰或调节NF-κB信号通路有关。
综上所述,不同种类饮食脂肪酸对巨噬细胞极化具有不同影响,饱和脂肪酸能诱导巨噬细胞M1/M2混合型极化,而多不饱和脂肪酸则抑制巨噬细胞M1型极化。不同种类脂肪酸可能通过PPARγ/NF-κB相关信号通路参与巨噬细胞M1/M2极化的转化。
参考文献
1 Maher JJ, Leon P, Ryan JC. Beyond insulin resistance: Innate immunity in nonalcoholic steatohepatitis[J]. Hepatology, 2008, 48 (2): 670-678.
2 Musso G, Gambino R, Cassader M, et al. A meta-analysis of randomized trials for the treatment of nonalcoholic fatty liver disease[J]. Hepatology, 2010, 52 (1): 79-104.
3 Parker HM, Johnson NA, Burdon CA, et al. Omega-3 supplementation and non-alcoholic fatty liver disease: a systematic review and meta-analysis[J]. J Hepatol, 2012, 56 (4): 944-951.
4 Biswas SK, Chittezhath M, Shalova IN, et al. Macrophage polarization and plasticity in health and disease[J]. Immunol Res, 2012, 53 (1-3): 11-24.
5 Sica A, Invernizzi P, Mantovani A. Macrophage plasticity and polarization in liver homeostasis and pathology[J]. Hepatology, 2014, 59 (5): 2034-2042.
6 Olefsky JM, Glass CK. Macrophages, inflammation, and insulin resistance[J]. Annu Rev Physiol, 2010, 72: 219-246.
7 Lumeng CN, Bodzin JL, Saltiel AR. Obesity induces a phenotypic switch in adipose tissue macrophage polarization[J]. J Clin Invest, 2007, 117 (1): 175-184.
8 Maina V, Sutti S, Locatelli I, et al. Bias in macrophage activation pattern influences non-alcoholic steatohepatitis (NASH) in mice[J]. Clin Sci (Lond), 2012, 122 (11): 545-553.
9 Huang W, Metlakunta A, Dedousis N, et al. Depletion of liver Kupffer cells prevents the development of diet-induced hepatic steatosis and insulin resistance[J]. Diabetes, 2010, 59 (2): 347-357.
10Hua J, Ma X, Webb T, et al. Dietary fatty acids modulate antigen presentation to hepatic NKT cells in nonalcoholic fatty liver disease[J]. J Lipid Res, 2010, 51 (7): 1696-1703.
11Tang T, Sui Y, Lian M, et al. Pro-inflammatory activated Kupffer cells by lipids induce hepatic NKT cells deficiency through activation-induced cell death[J]. PLoS One, 2013, 8 (12): e81949.
12Tateya S, Kim F, Tamori Y. Recent advances in obesity-induced inflammation and insulin resistance[J]. Front Endocrinol (Lausanne), 2013, 4: 93.
13Gordon S, Martinez FO. Alternative activation of macrophages: mechanism and functions[J]. Immunity, 2010, 32 (5): 593-604.
14Odegaard JI, Ricardo-Gonzalez RR, Goforth MH, et al. Macrophage-specific PPARgamma controls alternative activation and improves insulin resistance[J]. Nature, 2007, 447 (7148): 1116-1120.
15Glass CK, Saijo K. Nuclear receptor transrepression pathways that regulate inflammation in macrophages and T cells[J]. Nat Rev Immunol, 2010, 10 (5): 365-376.
(2014-09-02收稿)
Effects of Different Fatty Acids on Macrophage M1/M2 Polarization
LUOWenjing,SUIYongheng,LIANMin,HUAJing.DivisionofGastroenterologyandHepatology,RenJiHospital,SchoolofMedicine,ShanghaiJiaoTongUniversity;ShanghaiInstituteofDigestiveDisease,Shanghai(200001)
Correspondence to: HUA Jing, Email: hua-jing88@hotmail.com
Background: The alterations of macrophage phenotype and function play an important role in the development of non-alcoholic fatty liver disease (NAFLD). Recent studies have shown that different types of fatty acids have different effects on NAFLD. Aims: To investigate the effects of different fatty acids on macrophage M1/M2 polarization and the possible mechanisms. Methods: Murine RAW264.7 macrophages were treated with lipopolysaccharide (LPS), interleukin-4 (IL-4), saturated fatty acid [palmitic acid (PA)], polyunsaturated fatty acid [docosahexaenoic acid (DHA)] as well as LPS/IL-4 combined with PA/DHA, respectively, and a negative control group was established. Expressions of M1 phenotype markers [inducible nitric oxide synthase 2 (iNOS2) and tumor necrosis factor-α (TNF-α)] and M2 phenotype markers [arginase 1 (ARG1) and mannose receptor C type 2 (MRC2)] were determined by real-time PCR. Expressions of peroxisome proliferator-activated receptor γ (PPARγ) and phosphorylated nuclear factor-κBp65 (pNF-κBp65) were determined by Western blotting. Results: Compared with negative control group, expressions of iNOS2 and TNF-α were significantly increased in LPS group (P<0.01;P<0.05), expressions of ARG1 and MRC2 were significantly increased in IL-4 group (P<0.01;P<0.05), expressions of iNOS2, TNF-α and ARG1 were significantly increased in PA group (P<0.05;P<0.01;P<0.05), however, expression of iNOS2 was significantly decreased in DHA group (P<0.01). LPS+PA and IL-4+PA could further affect expressions of TNF-α and ARG1, but no significant difference was seen between LPS+PA, IL-4+PA groups and LPS, IL-4 groups (P>0.05). Compared with LPS group, expressions of iNOS2 and TNF-α were significantly decreased in LPS+DHA group (P<0.05;P<0.05). Expression of ARG1 was significantly decreased in IL-4+DHA group when compared with IL-4 group (P<0.01). Compared with negative control group, expression of PPARγ was significantly increased in PA and DHA groups, and expression of pNF-κBp65 was significantly increased in PA group. Conclusions: Saturated fatty acid induces macrophage M1/M2 mixed polarization, while polyunsaturated fatty acid inhibits macrophage M1 polarization. Different types of fatty acids are involved in the transition of macrophage M1/M2 polarization which may mediate by PPARγ/NF-κB signaling pathways.
Key wordsFatty Acids;Macrophages;Peroxisome Proliferator-Activated Receptors;NF-kappa B;
通信作者#本文,Email: hua-jing88@hotmail.com
DOI:10.3969/j.issn.1008-7125.2015.01.007

