电镀法制备合金催化剂用于硼氢化钠水解制氢实验
郭跃萍, 崔振凯, 徐向阳, 冯庆华
(兰州大学 化学化工学院,甘肃 兰州 730000)
电镀法制备合金催化剂用于硼氢化钠水解制氢实验
郭跃萍, 崔振凯, 徐向阳, 冯庆华
(兰州大学 化学化工学院,甘肃 兰州 730000)

利用电镀法制备合金催化剂,并将其用于硼氢化钠水解制氢气的催化反应,制备的氢气可以充当质子交换膜燃料电池的氢源。通过改变镀液的pH值、电流密度,沉积时间等工艺参数,考察了各项工艺参数对制氢速率的影响。实验发现,随着镀液中的pH值变化,载体表面得到具有不同形貌的催化剂颗粒,当pH6.5时,得到的催化剂颗粒最小,得到最大的制氢速率。同样考察了电流密度和沉积时间对制氢速率的影响,发现电流密度0.1 A/cm2、沉积时间2.5 min时得到的催化剂具有最佳的制氢效率。
电镀法; 硼氢化钠; 制氢; 实验设计
0 引 言
电镀工艺是用电解电镀液的方法在基底上沉积一层具有一定形态和性能的金属或合金沉积层的制备工艺。电镀学科分属于化学工艺学科,而电化学实验是化学化工专业综合实验中必做的实验之一。对于传统的电镀金属,其目的通常是出于美化和保护的,通过电镀改善基底材料的外观、耐腐蚀性[1]和耐磨损性等。现在,电镀这一古老的技术正越来越具有有别于传统的其他重要作用,如利用电镀工艺用于制备磁记录材料[2-4]、纳米材料[5]、微波吸收材料[6-7]以及催化材料[8]等功能性材料。
制氢技术是化学工艺的重要过程之一,一般传统的制氢手段,如天然气蒸汽转化制氢、电解水制氢、水蒸汽重整制氢等,本校化工综合实验开设的制氢实验就是甲醇水蒸气重整制氢。而硼氢化钠制氢技术是近年来开发的可供质子交换膜燃料电池(PEMFC)现场制氢的新型技术。但是,由于其传统催化剂是粉末状,不利于回收利用,所以通过电镀的方法开发薄膜催化剂被一些学者研究,并得到认可[9-12]。本实验设计通过将电镀工艺和制氢工艺两个化学工艺过程的有机结合,使得学生在做此实验时,不仅可以深化认识两种工艺过程的基本概念,强化工艺的操作能力,还可以通过不同工艺的结合培养学生的学科交叉的思想以及综合应用的能力,并引导学生了解科学研究的前沿动态,达到提高学生综合素质的能力。
1 实验部分
1.1 实验仪器与药品
1.1.1 实验仪器
为了降低成本选用直流电镀,选用型号为LP3005D型的恒流电源。表面形貌用JSM-5600LV/KEVEX Sigma型的场发射扫描电镜(FE-SEM)观察,镀层的成分组成用其相配套的能量色散X射线能谱(EDX)分析。
1.1.2 实验药品
Co基催化剂在硼氢化钠制氢中具有良好的催化性能[13-14],所以实验采取Co-Ni-P合金薄膜作为硼氢化钠制氢的催化剂。试验中所用的基底是Cu基底,阳极为惰性石墨棒电极。
镀液中各化合物浓度及操作条件分别为:CoSO4(7H2O) 0.11 mol/L,NiSO4(6H2O) 0.04 mol/L,NaH2PO2(H2O) 0.8 mol/L,C6H5Na3O7(2H2O) 0.3 mol/L,(NH4)2SO40.3 mol/L;温度27 ℃;pH 5.0,
6.5,0.8;电流密度0.05、0.1、0.15 A/cm2;沉积时间1、2.5、5、10 min。
1.2 实验步骤
通过电镀法制备合金镀层,称量法确定镀片上催化剂的质量,将制得的催化剂投入已配制好20 mL的质量百分数分别为10% NaBH4和10% NaOH的混合溶液中,在30 ℃的恒温槽中恒温30 min,检查系统的气密性,打开天平。每隔1 min记录天平的读数,最后将水的质量换算成氢气的体积,将取样时间作为横坐标做图。实验所用的相关测量示意图如图1所示。
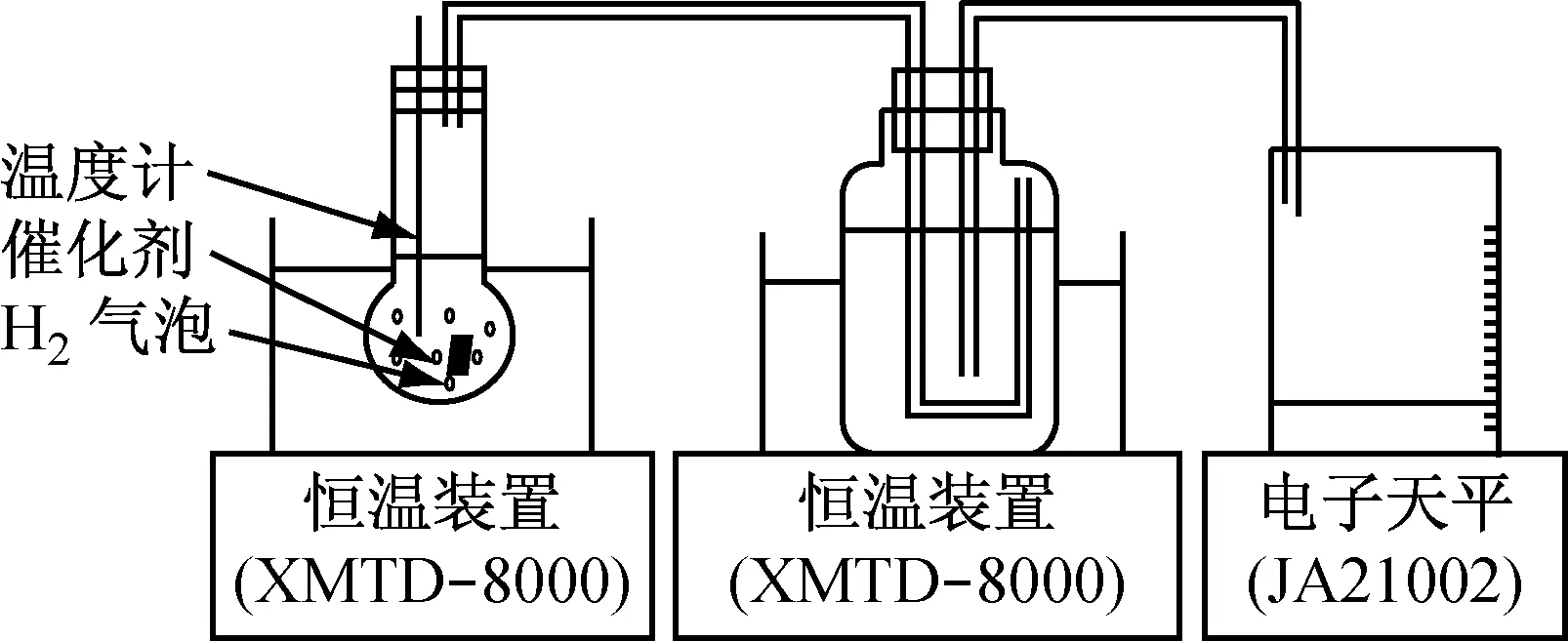
图1 氢气制备测量系统图
2 实验结果与分析
2.1 不同pH值下得到的合金催化剂SEM表征与EDS分析
图2是镀液pH值分别为5.0、6.5和8.0时得到的催化剂镀层的表面形貌图。从图中可以看到,沉积得到的合金薄膜有两层结构:内部的层状和外部的颗粒状结构的催化剂。在内部层状的Co-Ni-P催化剂合金薄膜上发现有裂痕,说明表面沉积的薄膜有内应力。从图中还可以发现,镀液的pH6.5时得到的催化剂表面颗粒粒径最小。且从破碎的颗粒中可以发现,得到的催化剂具有中空结构,电沉积过程中产生的氢气是产生这种中空结构的活性模板[15]。

(a) pH5.0
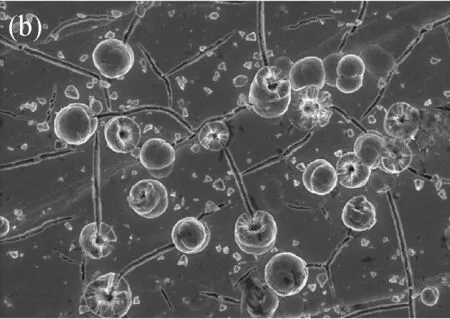
(b) pH6.5

(c) pH8.0
表1是不同pH值下所得的催化剂的成分表。由表中可见,随着pH值增大,所得合金催化剂的Co含量降低,Ni含量增加,P含量增加,但是pH5.0和pH6.5得到的催化剂成份基本不变。

表1 不同pH值下所得的催化剂的成份表 %
2.2 不同pH值下得到的合金催化剂制氢
图3显示了不同pH下得到Co-Ni-P薄膜催化剂在10% NaBH4和10% NaOH的溶液中的制氢图。从图中可以发现,当镀液中的pH6.5时得到最大的制氢速率,在20 min内制得了230 mL氢气。制氢速率高的原因,主要是由于此时的催化剂外部颗粒尺寸最小和催化剂Co含量最多导致的催化剂比表面积大和催化活性位多。
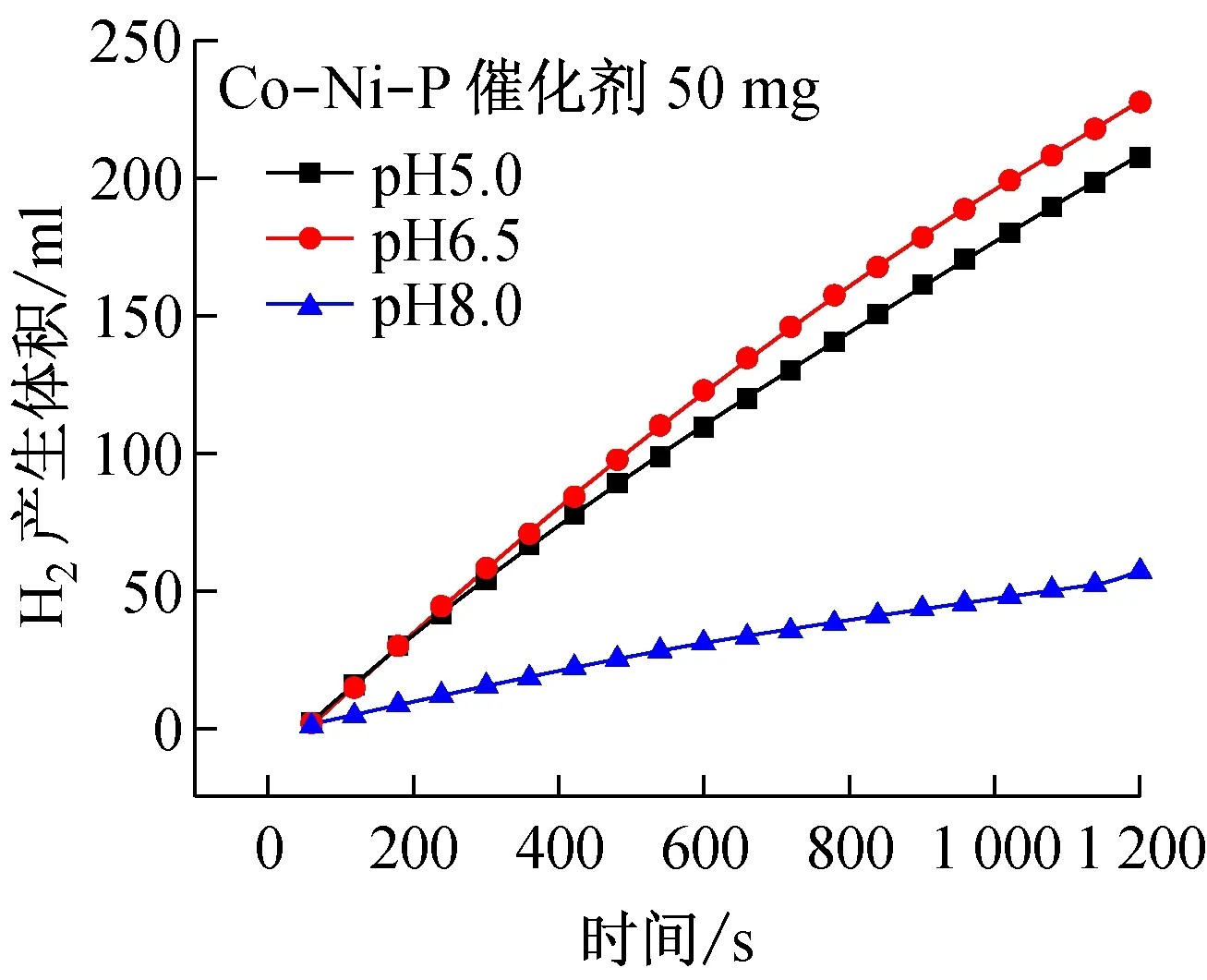
图3 不同pH下得到的催化剂制氢速率图
2.3 不同沉积时间得到的合金催化剂制氢
图4显示了不同沉积时间下得到Co-Ni-P薄膜催化剂在10% NaBH4和10% NaOH的溶液中的制氢图。从图中可以发现,随着沉积时间得增加,每mg催化剂的制氢速率在增加,当沉积时间为2.5 min时得到最大的制氢速率,每mg催化剂在30 min内制得了66 mL氢气。但是随着沉积时间的进一步增加,制氢速率反而降低,这主要是由于随着沉积时间的增加,催化剂沉积的层数增加,内层催化剂不能参与反应,使得所得的每mg催化剂的制氢速率降低[16]。

图4 不同沉积时间得到的催化剂制氢速率图
2.4 不同电流密度下得到的合金催化剂制氢
图5列出了不同阴极电流密度下得到的Co-Ni-P薄膜催化剂在10% NaBH4和10% NaOH的溶液中的制氢图。从图中可以发现,随着电流密度的增加,所得的催化剂制氢速率在增加,当电流密度0.1 A/cm2时得到的催化剂制氢速率最大。但是当电流密度增加到0.5 A/cm2时所得催化剂的制氢速率反而降低。这主要是由于电流增加电沉积得到的催化剂表面堆积比较严重,导致其比表面积降低,使得其催化性能降低。

图5 不同电流密度得到的催化剂制氢速率图
3 结 语
实验将电沉积时不同工艺条件(pH值、电流密度、沉积时间)下得到的催化剂进行了制氢速率对比分析,得到了电沉积最佳的工艺参数。对于本科生综合实验来说,通过pH值、电流密度、沉积时间等工艺参数的练习操作,使学生在熟悉参数控制的实验手段同时,锻炼了分析实验数据的能力。另外,还可以根据实验学时数的不同,灵活选择需要改变的参数,使实验开设的时间具有灵活性。对于催化剂来说,对其寿命的研究也是必不可少的。所以还可以通过循环实验研究催化剂的耐久性。通过设定不同的实验内容,可以让学生全方位、多层次的认识电镀以及催化的相关工艺过程。
[1] Afroukhteh S, Dehghanian C, Emamy M. Preparation of the Ni-P composite coating co-deposited by nano TiC particles and evaluation of it’s corrosion property[J].Applied Surface Science,2012,258:2597-2601.
[2] Rivero G, Multigner M, Garcia J M. Magnetic and structural properties of electrodeposited Co-Ni-P amorphous ribbons[J].Journal of Magnetism and Magnetic Materials, 1998,177-181:119-120.
[3] Pattanaik G, David M, Xu X,etal. Electrodeposition of hard magnetic films and microstructures[J].Electrochimica Acta,2007,52:2755-2764.
[4] Abdel Aal A, Shaaban A, Hamid Z Z. Nanocrystalline soft ferromagnetic Ni-Co-P thin film on Al alloy by low temperature electroless deposition[J].Applied Surface Science,2008,254: 1966-1971.
[5] 宋振兴. Co/Cu多层纳米线的电化学制备和性能研究[D].天津:天津大学,2006.
[6] Pan X F, Mu G H, Shen H G. Preparation and microwave absorption properties of electroless Co-Ni-P coated strontium ferrite powder[J].Applied Surface Science,2007,253:4119-4122.
[7] Ma Z, Wang J B, Liu Q F. Microwave absorption of electroless Ni-Co-P coated SiO2powder[J].Applied Surface Science,2009,255:6629-6633.
[8] Kim D R, Cho K W, Cho Y. Fabrication of porous Co-Ni-P catalysts by electrodeposition and their catalytic characteristics for the generation of hydrogen from an alkaline NaBH4solution[J].International Journal of Hydrogen Energy,2009,34:2622-2630.
[9] Chamoun R, Demirci U B, Cornu D. Cobalt-supported alumina as catalytic film prepared by electrophoretic deposition for hydrogen release applications[J].Applied Surface Science, 2010,256:7684-7691.
[10] Cho K W, Kwon H S. Effects of electrodeposited Co and Co-P catalysts on the hydrogen generation properties from hydrolysis of alkaline sodium borohydride solution[J].Catalysis Today,2007,120:298-304.
[11] Liu C H, Chen B H, Hsueh C L. Hydrogen generation from hydrolysis of sodium borohydride using Ni-Ru nanocomposite as catalysts[J].International Journal of Hydrogen Energy,2009,34:2153-2163.
[12] Liang Y, Dai H B, Ma L P. Hydrogen generation from sodium borohydride solution using a ruthenium supported on graphite catalyst[J].International Journal of Hydrogen Energy,2010,35:3023-3028.
[13] Guo Y P, Feng Q H, Ma J T. The hydrogen generation from alkaline NaBH4solution by using electroplated amorphous Co-Ni-P film catalysts[J]. Applied Surface Science, 2013,273:253-256.
[14] Rakap M, Kalu E E, Özkar S. Cobalt-nickel-phosphorus supported on Pd-activated TiO2(Co-Ni-P/Pd-TiO2) as cost-effective and reusable catalyst for hydrogen generation from hydrolysis of alkaline sodium borohydride solution[J].Journal of Alloys and Compounds, 2011,509:7016-7021.
[15] Kim D R, Cho K W, Cho Y,etal. Fabrication of porous Co-Ni-P catalysts by electrodeposition and their catalytic characteristics for the generation of hydrogen from an alkaline NaBH4solution[J]. International Journal of Hydrogen Energy,2009, 34:2622-2630.
[16] Zhang X W, Zhao J Z, Cheng F Y,etal. Electroless-deposited Co-P catalysts for hydrogen generation from alkaline NaBH4solution[J]. International Journal of Hydrogen Energy, 2010, 35: 8363-8369.
Hydrogen Generation from NaBH4Solution with Electroplated Alloy Catalysts
GUOYue-ping,CUIZhen-kai,XUXiang-yang,FENGQing-hua
(School of Chemistry and Chemical Engineering, Lanzhou University, Lanzhou 730000, China)
The alloy catalysts were electroplated and were used in the hydrogen generation from NaBH4solution, and were the hydrogen supply for PEMFC utilization. The impact of pH, the cathodic current and deposition time were investigated. The experimental results revealed that the shape of the catalysts was changed by changing pH, and the optimized pH value was 6.5. And the optimized cathodic current density was 0.1 A/cm2, and the deposition time was no longer than 2.5 min. The experimental design combined traditional preparation technology of chemistry and chemical engineering with the frontiers scientific research. It can be applied in comprehensive experiment training for the professional of chemistry and chemical engineering. The experiment helped students to be familiar with the traditional process and understand its new applications in the scientific frontier.
electrodeposition; sodium borohydride; hydrogen generation; experimental design
2014-03-03
中央高校基本科研业务费专项基金(lzujbky-2014-180);兰州大学磁学与磁性材料教育部重点实验室开放课题(LZUMMM2014004)
郭跃萍(1980-),女,山西浑源人,博士,工程师,主要从事工业催化制氢研究。Tel.:13919032783; E-mail:guoyp@lzu.edu.cn
TQ 016.1
A
1006-7167(2015)01-0014-04

