肿瘤出芽对胃腺癌的临床病理诊断及预后价值
陈军芳,景玉萍,闵 静,陈争春,戴一菲
·临床诊疗提示·
肿瘤出芽对胃腺癌的临床病理诊断及预后价值
陈军芳,景玉萍,闵 静,陈争春,戴一菲
目的 探讨肿瘤出芽在胃腺癌临床病理诊断和预后中的价值。方法 收集湖北航天医院、孝感市中心医院和孝感市第一人民医院外科2005年1月—2008年12月行手术切除的胃腺癌患者108例,光镜下观察胃腺癌标本出芽情况,并随访患者;分析肿瘤出芽与胃腺癌临床病理指标及预后之间的关系。结果 108例胃腺癌患者中61例发生了肿瘤出芽(56.5%)。肿瘤出芽的发生与胃腺癌的分化程度、浸润深度、淋巴结转移、TNM分期及术后早期复发均密切相关(P<0.05)。胃腺癌的分化程度(χ2=7.543,P=0.023),肿瘤出芽(χ2=29.631,P<0.001),浸润深度(χ2=10.202,P=0.016),淋巴结转移(χ2=28.287,P<0.001),TNM分期(χ2=18.259,P<0.001)与患者术后生存率相关;Cox回归模型分析显示,肿瘤出芽是胃腺癌患者预后的影响因素〔HR=2.875,95%CI(1.806,4.578),P<0.001〕。结论 肿瘤出芽与反映胃腺癌侵袭性的临床病理指标密切相关,是预后的重要影响因子。
胃肿瘤;肿瘤出芽;病理学;诊断技术和方法;存活率分析;预后
陈军芳,景玉萍,闵静,等.肿瘤出芽对胃腺癌的临床病理诊断及预后价值[J].中国全科医学,2015,18(14):1700-1704.[www.chinagp.net]
Chen JF,Jing YP,Min J,et al.Value of tumor budding in clinical pathological diagnosis and prognosis of gastric adenocarcinoma[J].Chinese General Practice,2015,18(14):1700-1704.
胃癌是我国最常见的消化道恶性肿瘤,发病率和病死率均高于世界平均水平[1]。根据2008年全球肿瘤流行病统计数据,全球每年胃癌新发病例98.9万,中国为46.3万(46.8%);同期全球胃癌死亡病例共73.7万,中国为35.2万(47.8%)[2]。近年来,肿瘤出芽现象受到关注,有研究表明结直肠癌中肿瘤出芽与淋巴结转移和预后密切相关[3-5]。胃癌最常见的组织学类型是腺癌,目前尚无关于胃腺癌中肿瘤出芽的研究。本研究收集并分析了孝感市三家综合医院108例胃腺癌患者的临床资料,探讨肿瘤出芽在胃腺癌临床病理诊断及预后中的价值,为胃腺癌的临床诊治提供参考。
1 资料与方法
1.1 临床资料 收集湖北航天医院、孝感市中心医院和孝感市第一人民医院外科2005年1月—2008年12月行手术切除的胃腺癌患者108例,其中男77例,女31例;年龄36~81岁,平均(59.0±8.4)岁,中位年龄61岁。入选患者均成功施行胃癌根治术,术前未行放化疗,术后由2名副主任医师级别以上的病理医师确诊为胃腺癌并判断各项临床病理指标。患者病历资料完整。
1.2 方法 手术标本均经10%中性甲醛溶液固定,上行梯度酒精脱水,二甲苯透明,常规石蜡包埋,3 μm厚连续切片,HE染色,再脱水透明,环氧树脂封片,置于10×20或10×40倍光镜下观察。在10×20倍光镜下(视野面积为0.785 mm2)计数肿瘤出芽数量,同时采用CK标记肿瘤细胞,对出芽的肿瘤细胞进行确认。
1.3 肿瘤出芽的判断 肿瘤出芽的判断参照Ueno等[6]标准,以肿瘤浸润前沿的间质内见到单个孤立的肿瘤细胞或不足5个的小灶状肿瘤细胞群判断为肿瘤出芽。当肿瘤浸润的前沿间质内未见单个或小的群集肿瘤细胞时则判断为无肿瘤出芽。
1.4 随访 通过电话、短信及门诊方式随访;随访起始时间为手术时间,截止时间为2014-01-01,随访终点定为因胃癌死亡。生存时间以手术时间至死亡时间或最后随访截止时间为准。早期复发定义为术后2年内复发,经病理、CT、B超或X线中至少一项检查证实。
1.5 统计学方法 采用SPSS 19.0统计软件进行分析。计数资料的分析采用χ2检验;采用Kaplan-Meier法分析生存时间,Log-Rank法检验各组生存率的差异;采用Cox回归模型分析胃腺癌患者预后的影响因素。以P<0.05为差异有统计学意义。
2 结果
2.1 胃腺癌患者临床病理指标 入选的108例患者术后均经病理检查确诊为胃腺癌(不包括印戒细胞癌),肿瘤直径2~7 cm,平均4.2 cm;其中发生在胃底或贲门35例,胃体27例,胃窦或幽门46例;高分化14例,中分化35例,低分化59例。胃癌TNM分期采用UICC/AJCC标准(2010),T1期10例,T2期31例,T3期59例,T4期8例;N0期33例,N1期31例,N2期25例,N3期19例;Ⅰ期24例,Ⅱ期43例,Ⅲ期39例,Ⅳ期2例。
2.2 胃腺癌中肿瘤出芽现象 在10×20倍光镜下,可清晰看到胃腺癌浸润前缘与正常组织交界区域的纤维间质内单个或小灶性(<5个)癌细胞群组成的芽孢,为肿瘤出芽(见图1);而未发生肿瘤出芽的胃腺癌前缘光滑。10×40倍光镜下见芽孢由单个或2~4个细胞成团组成,胞质融合,嗜酸性,核型不规则,异型性显著,核较间质细胞深染(见图2)。部分出芽的肿瘤细胞可见核分裂像。
2.3 胃腺癌肿瘤出芽与临床病理指标的关系 108例胃腺癌中肿瘤出芽者61例,无肿瘤出芽者47例,肿瘤出芽率为56.5%。肿瘤出芽的发生与患者性别、年龄、肿瘤直径及发生部位均无关(P>0.05),而与胃腺癌的分化程度、浸润深度、淋巴结转移、TNM分期及术后早期复发相关(P<0.05,见表1)。
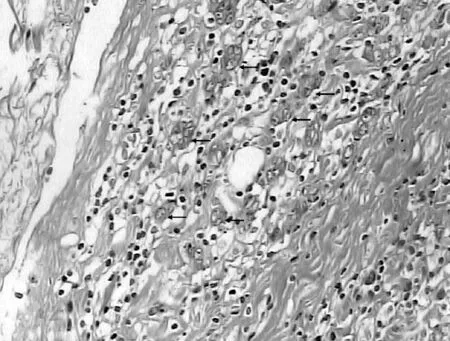
注:箭头所示为肿瘤出芽
图1 胃腺癌(HE,×200)
Figure 1 Gastric adenocarcinoma
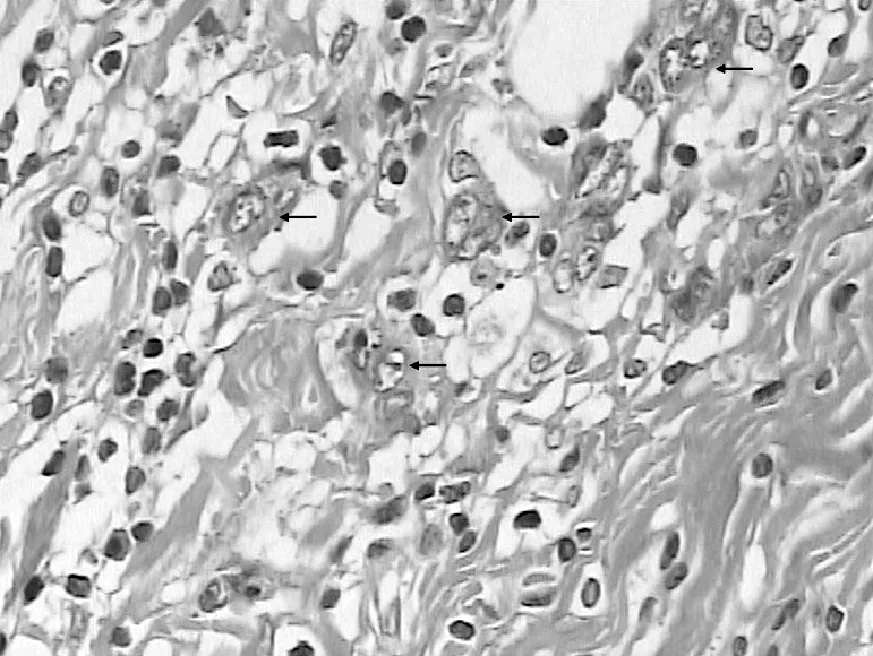
注:箭头所示为肿瘤出芽
图2 胃腺癌(HE,×400)
Figure 2 Gastric adenocarcinoma
2.4 肿瘤出芽对胃腺癌患者术后生存率的影响 截止到2014-01-01,随访时间为3~107个月,108例患者存活16例,中位生存时间28个月。29例患者生存时间满5年,5年累积生存率为26.9%。根据随访情况,将各项临床病理指标按分组资料的Kaplan-Meier法分析生存时间,用Log-Rank法检验各组生存率间的差异,结果显示与胃腺癌预后相关的因素包括分化程度、浸润深度、淋巴结转移、TNM分期、肿瘤出芽(P<0.05,见表2,图3~7)。
为消除各因素之间的交互影响作用,本研究采用多因素COX风险比例函数模型分析,将单因素分析中有统计学意义的5个变量(分化程度、浸润深度、淋巴结转移、TNM分期及肿瘤出芽)纳入Cox回归模型,全部变量应用Enter法。结果显示,肿瘤出芽、TNM分期、淋巴结转移是胃腺癌预后的独立因素(P<0.05),其中肿瘤出芽对预后的影响超过了和TNM分期和淋巴结转移(见表3)。
表1 胃腺癌肿瘤出芽与临床病理指标的关系(n=108)
Table 1 Relation between tumor budding and clinical pathological indexes in gastric adenocarcinoma
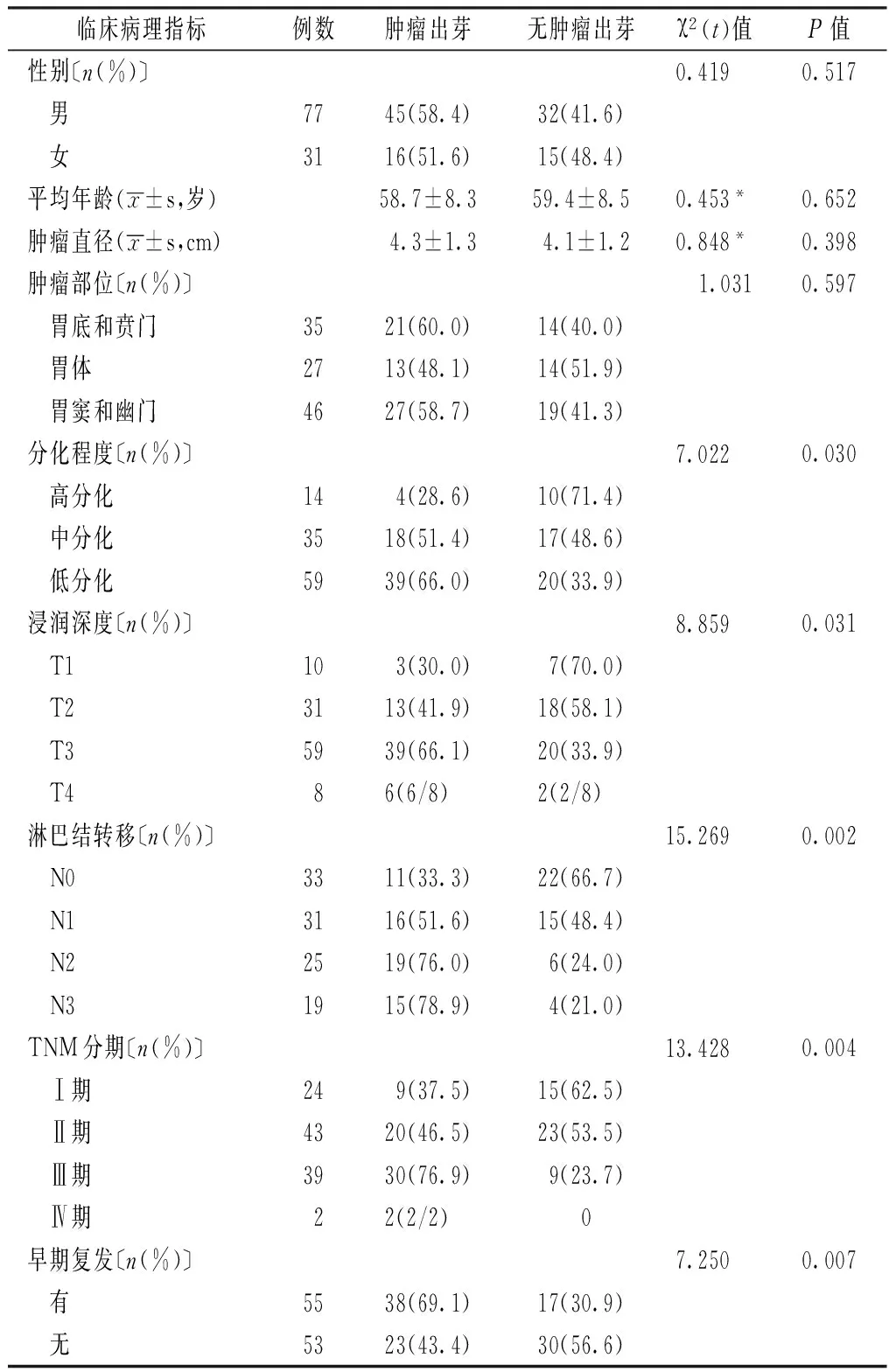
临床病理指标例数肿瘤出芽无肿瘤出芽χ2(t)值P值性别〔n(%)〕0.419 0.517 男7745(58.4)32(41.6) 女3116(51.6)15(48.4)平均年龄(x±s,岁)58.7±8.359.4±8.50.453*0.652肿瘤直径(x±s,cm)4.3±1.34.1±1.20.848*0.398肿瘤部位〔n(%)〕1.0310.597 胃底和贲门3521(60.0)14(40.0) 胃体2713(48.1)14(51.9) 胃窦和幽门4627(58.7)19(41.3)分化程度〔n(%)〕7.022 0.030 高分化144(28.6)10(71.4) 中分化3518(51.4)17(48.6) 低分化5939(66.0)20(33.9)浸润深度〔n(%)〕8.859 0.031 T1103(30.0)7(70.0) T23113(41.9)18(58.1) T35939(66.1)20(33.9) T486(6/8)2(2/8)淋巴结转移〔n(%)〕15.269 0.002 N03311(33.3)22(66.7) N13116(51.6)15(48.4) N22519(76.0)6(24.0) N31915(78.9)4(21.0)TNM分期〔n(%)〕13.428 0.004 Ⅰ期249(37.5)15(62.5) Ⅱ期4320(46.5)23(53.5) Ⅲ期3930(76.9)9(23.7) Ⅳ期22(2/2)0早期复发〔n(%)〕7.250 0.007 有5538(69.1)17(30.9) 无5323(43.4)30(56.6)
注:*为t值
表3 胃腺癌患者预后影响因素的Cox回归模型分析
Table 3 Cox regression analysis on influencing factors for the prognostic factors of gastric adenocarcinoma patients
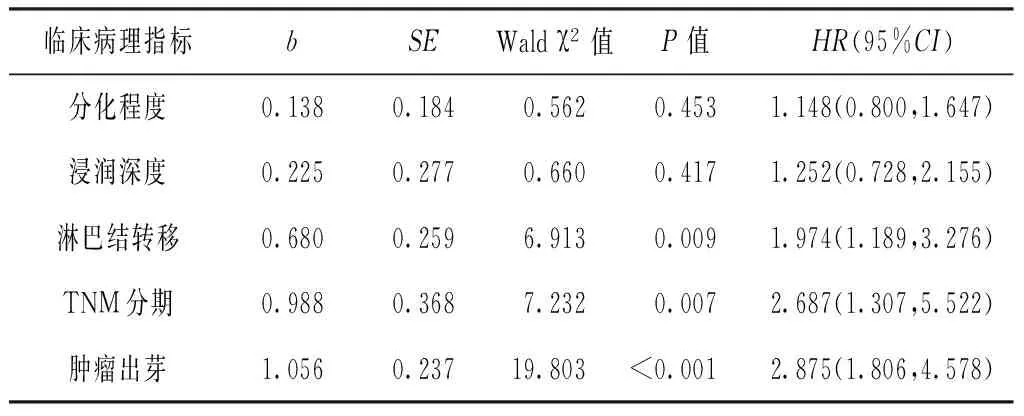
临床病理指标bSEWaldχ2值P值HR(95%CI)分化程度0.1380.1840.5620.4531.148(0.800,1.647)浸润深度0.2250.2770.6600.4171.252(0.728,2.155)淋巴结转移0.6800.2596.9130.0091.974(1.189,3.276)TNM分期0.9880.3687.2320.0072.687(1.307,5.522)肿瘤出芽1.0560.23719.803<0.0012.875(1.806,4.578)
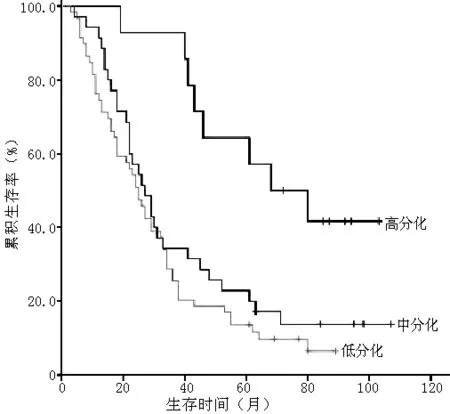
图3 不同分化程度患者的生存曲线
Figure 3 Survival curves of patients with different degrees of differentiation
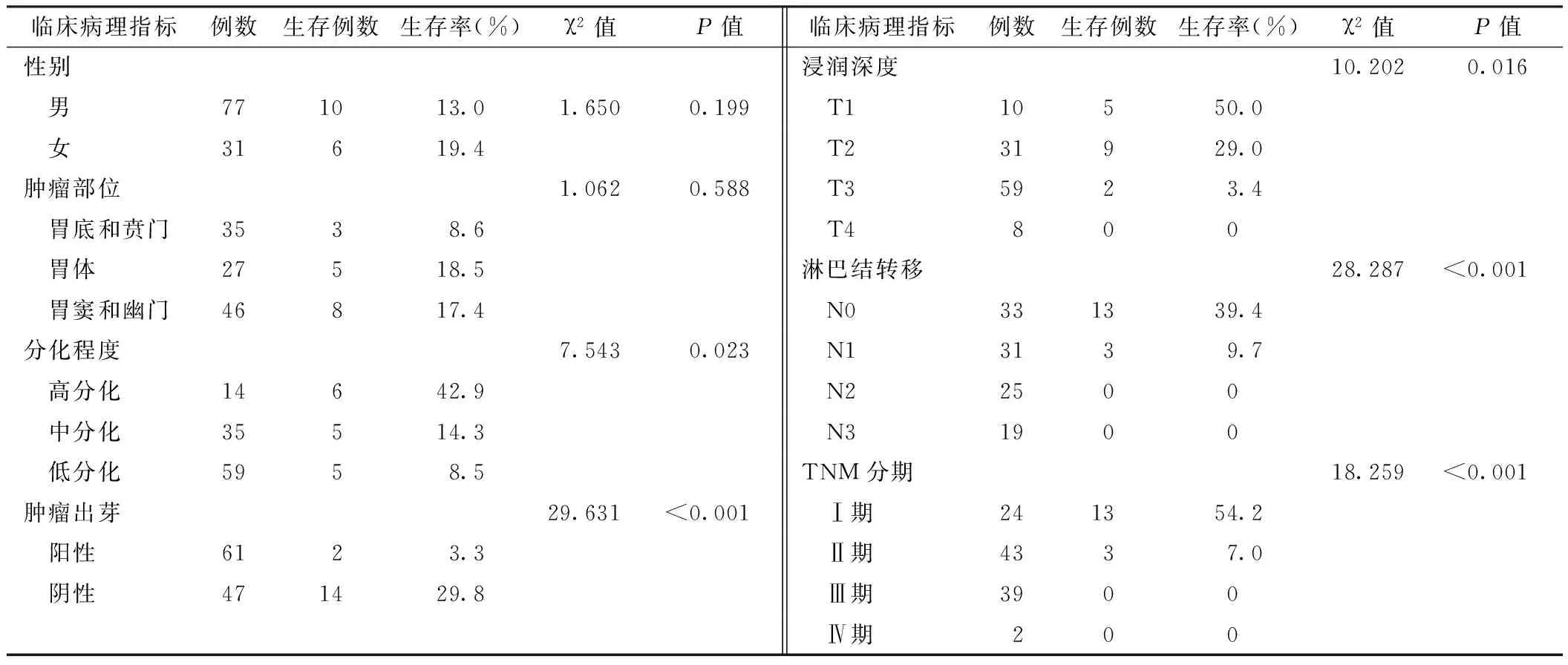
表2 不同临床病理指标对患者胃癌术后生存率的影响
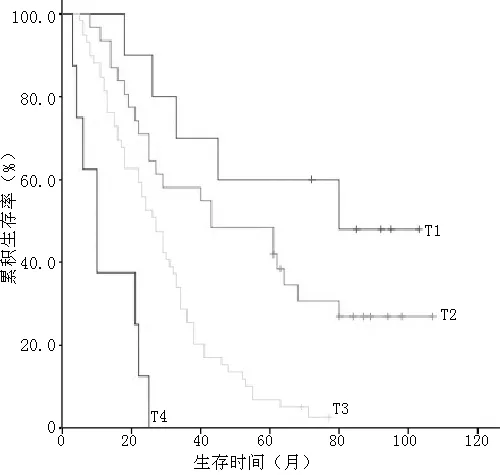
图4 不同浸润深度患者的生存曲线
Figure 4 Survival curves of patients with different depth of infiltration
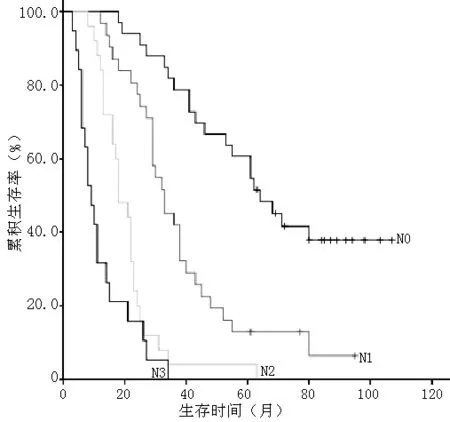
图5 不同淋巴结转移程度患者的生存曲线
Figure 5 Survival curves of patients with different degree of lymph node metastasis
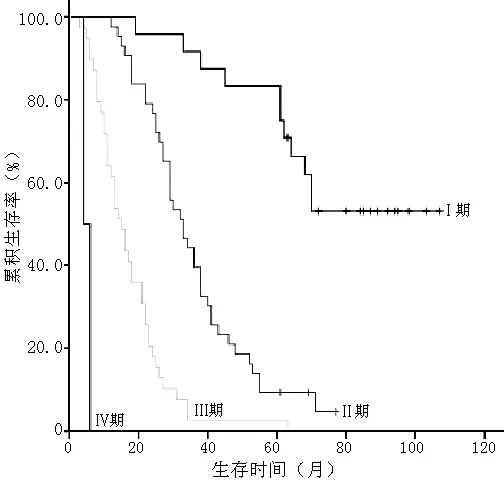
图6 不同TNM分期患者的生存曲线
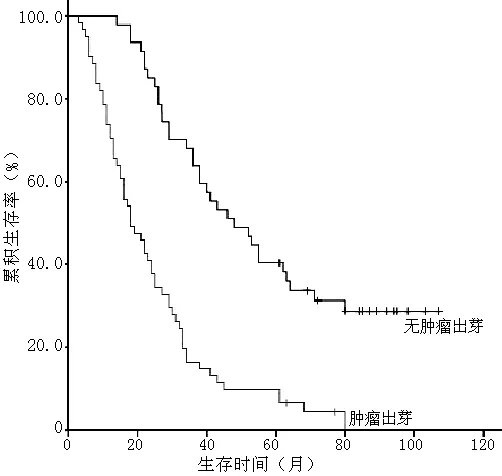
图7 有无肿瘤出芽患者的生存曲线
3 讨论
肿瘤出芽现象于1954年由Imai[7]最早报道,Gabbert等[8]描述了其详细的形态学特征,发现伴有肿瘤出芽的肿瘤具有较高的恶性潜能。目前关于肿瘤出芽的研究主要集中在结直肠癌领域,多项研究表明肿瘤出芽不仅能预测结直肠癌中淋巴结转移,同时也是患者术后生存最有意义的影响因子[3-6]。近年来,陆续发现肿瘤出芽与肺腺癌[9]、结直肠癌[10]等腺癌的转移和预后有关。
3.1 胃腺癌肿瘤出芽与临床病理指标的关系 实体瘤浸润和转移的第一步是浸润前缘的去分化和离解,随后肿瘤细胞移出主瘤体[8]。肿瘤体离解成孤立的肿瘤细胞,并且失去大部分分化的细胞学特征在肿瘤浸润转移过程中是一个重要事件,而肿瘤出芽恰好是浸润转移过程的首步,即癌细胞与原发癌灶脱离,因此肿瘤出芽被认为是肿瘤浸润性生长过程中关键步骤的形态学表达[11],出芽的芽孢被视为恶性干细胞,表现为肿瘤浸润前缘孤立的单个癌细胞或少于5个的癌细胞簇。本研究中,对胃腺癌组织行HE染色即可清晰观察到肿瘤出芽现象,肿瘤出芽率为56.5%,出芽率较高;肿瘤出芽表现为胃腺癌浸润的前沿间质中单个或小灶性癌细胞群组成的芽孢,芽孢由单个或2~4个细胞成团组成,胞质融合,嗜酸性,核型不规则,异型性显著,核较间质细胞深染,这与Gabbert等[8]描述一致。本研究显示,胃腺癌中肿瘤出芽与肿瘤分化程度、浸润深度、淋巴结转移、TNM分期及早期复发相关,表明胃腺癌发生肿瘤出芽预示其容易发生浸润转移,肿瘤出芽可能是胃腺癌侵袭性生长的重要因素。
3.2 肿瘤出芽预测胃腺癌患者预后的价值 目前胃腺癌治疗以手术为主,术后TNM分期系统是公认的反映其预后的可靠指标[12],但在临床实践中常发现一些相同TNM分期的胃腺癌患者术后生存率截然不同。因此,外科及病理学者们一直致力于寻找一种能够代表胃癌恶性病理学特征、反映其预后的敏感指标。有研究发现静脉血管侵犯[13]、阴性淋巴结数量[14]等可作为胃癌患者的预后指标,并建议将这些指标作为TNM分期系统中组织病理学指标的补充,然而在临床实际操作中评价这些指标的难度较大,因此未得到广泛应用。本研究显示,胃腺癌的分化程度、浸润深度、淋巴结转移、TNM分期和肿瘤出芽与患者的术后生存率相关;Cox回归模型分析结果显示,肿瘤出芽、TNM分期、淋巴结转移是影响胃腺癌患者预后的独立危险因素,肿瘤出芽的影响超过了TNM分期和淋巴结转移,提示肿瘤出芽是影响胃腺癌患者术后生存率、预测预后的重要因子。
总之,肿瘤出芽可反映胃腺癌的恶性侵袭性行为,与胃腺癌分化程度、浸润深度、淋巴结转移、TNM分期及早期复发密切相关,且肿瘤出芽是预测胃腺癌患者预后的独立危险因素。本研究具有实用价值,常规HE染色即可观察肿瘤出芽现象,临床操作简便易行,有经验的病理医师经过培训学习即可掌握。建议临床胃腺癌的病理诊断纳入肿瘤出芽这一参考指标,有肿瘤出芽的胃腺癌患者,应采取更积极的手术及治疗方法,以改善预后,提高生存率。
[1]Zheng ZX,Zheng RS,Chen WQ.An analysis of incifence and mortality of stomach cancer in China,2009[J].China Cancer,2013,22(5):327-332.(in Chinese) 郑朝旭,郑荣寿,陈万青.中国2009年胃癌发病与死亡分析[J].中国肿瘤,2013,22(5):327-332.
[2]Ferlay J,Shin HR,Bray F,et al.GLOBOGAN 2008,cancer incidence and mortality worldwide:IARC Cancer-Base No.10[EB/OL].(2011-02-20).http://globocan.iarc.fr.
[3]Okuyama T,Oya M,Yamaguchi M.Budding(Sprouting) as a useful prognostic marker in colorectal mucinous carcinoma[J].Jpn J Clin Oncol,2002,32(10):412-416.
[4]Okuyama T,Oya M,Ishikawa H.Budding as a useful prognostic marker in pT3 well-or moderately-differentiated rectal adenocarcinoma[J].J Surg Oncol,2003,83(1):42-47.
[5]Prall F,Nizze H,Barten M.Tumor budding as a prognostic factor in stageⅠ/Ⅱ colorectal carcinoma[J].Histopathology,2005,47(1):17-24.
[6]Ueno H,Murphy J,Jass JR,et al.Tumor "budding" as an index to estimate the potential of aggressiveness in rectal cancer[J].Hidtopathology,2002,40(2):127-132.
[7]Imai T.The growth of human carcinoma a morphological analysis(in Japanese)[J].Fukuoka Zasshi,1954(45):92.
[8]Gabbert H,Wagner R,Moll R,et al.Tumor dedifferentiation:an important step in tumor invasion[J].Clin Expl Met,1985,3(4):257-279.
[9]Yamaguchi Y,Ishii G,Kojima M,et al.Histopathologic features of the tumor budding in adenocarcinoma of the lung:tumer budding as an index to predict the potential aggressiveness[J].J Thorac Oncol,2010,5(9):1361-1368.
[10]Huang WB,Zhao JH,Huang Y,et al.Analysis between the malignant degree and tumor budding in colorectal[J].Acta Universitatis Medicinalis Nanjing:Natural Science,2007,27(12):1422-1424.(in Chinese) 黄文斌,赵建华,黄悦,等.结直肠癌组织中肿瘤出芽与恶性程度分析[J].南京医科大学学报:自然科学版,2007,27(12):1422-1424.
[11]Zheng NX,Chen LP,Du XD,et al.Expression and significance of CTGF and VEGF in gastric carcinoma[J].Jiangsu Med,2011,37(1):57-59.(in Chinese) 郑南翔,陈力平,杜旭东,等.CTGF和VEGF在胃癌组织中的表达及意义[J].江苏医药,2011,37(1):57-59.
[12]Li XB,Mei LY,Che XM.Prognostic factors for gastric cancer[J].Chinese Journal of General Surgery,2013,22(4):494-497.(in Chinese) 李小宝,梅乐园,车向明.影响胃癌预后因素的研究进展[J].中国普通外科杂志,2013,22(4):494-497.
[13]Maehara Y,Kabashima A,Koga T,et al.Vascular invasion and potential for tumor angiogenesis in gastric carcinoma[J].Surgery,2000,128(3):408-416.
[14]Xu D,Huang Y,Geng Q,et al.Effect of lymph node number on survival of patients with lymph node-negative gastric cancer according to the 7th edition UICC TNM system[J].PLoS One,2012,7(6):e38681.
(本文编辑:赵跃翠)
Value of Tumor Budding in Clinical Pathological Diagnosis and Prognosis of Gastric Adenocarcinoma
CHENJun-fang,JINGYu-ping,MINJing,etal.
MedicalCollegeofHubeiPolytechnicInstitute,Xiaogan432000,China
Objective To study the value of tumor budding in the clinical pathological diagnosis and prognosis of gastric adenocarcinoma.Methods We collected 108 cases of patients with gastric adenocarcinoma who underwent excision in the surgery departments of Hubei Hangtian hospital,Xiaogan Central Hospital and the First People′s Hospital of Xiaogan from January 2005 to December 2008.The specimens of gastric adenocarcinoma from the patients were collected and observed under the light microscope and the patients were followed up.Then the relation between tumor budding and clinical pathological indicators and prognosis of gastric adenocarcinoma was investigated.Results Tumor budding was found in 61 patients(56.5%).It was associated with tumor differentiation,infiltration depth,lymph node metastasis,TNM staging and early postoperative recurrence(P<0.05).Differentiation(χ2=7.543,P=0.023),tumor budding(χ2=29.631,P<0.001),infiltration depth(χ2=10.202,P=0.016),lymph node metastasis(χ2=28.287,P<0.001),TNM staging(χ2=18.259,P<0.001) were associated with the postoperative survival rate of gastric adenocarcinoma patients.Multivariate Cox regression analysis showed that that tumor budding was an important prognostic factor for gastric adenocarcinoma〔HR=2.875,95%CI(1.806,4.578),P<0.001〕.Conclusion Tumor budding is closely associated with the pathological indicators suggesting the invasiveness of gastric adenocarcinoma.It is also an important prognostic factor for gastric adenocarcinoma.
Stomach neoplasms;Tumor budding;Pathology;Diagnostic techniques and procedures;Survival analysis;Prognosis
湖北职业技术学院重点立项课题(2012A05)
432000湖北省孝感市,湖北职业技术学院医学院(陈军芳,景玉萍,闵静);湖北航天医院(陈争春);孝感市中心医院(戴一菲)
R 735.2
B
10.3969/j.issn.1007-9572.2015.14.024
2014-11-20;
2015-02-25)

