小白菊内酯干预骨髓基质细胞对Jurkat细胞黏附作用的影响及其机制研究
何玉婵,周思瑶,唐荣芳,农庆伟,蒋端凤,王晓桃
·论著·
小白菊内酯干预骨髓基质细胞对Jurkat细胞黏附作用的影响及其机制研究
何玉婵,周思瑶,唐荣芳,农庆伟,蒋端凤,王晓桃
目的 探讨急性淋巴细胞白血病(ALL)患者骨髓基质细胞(BMSCs)对Jurkat细胞的黏附作用及小白菊内酯(PTL)对此作用的干预机制。方法 采集2013年10月—2014年3月于桂林医学院附属医院经FAB分型及MICM分型确诊为ALL并经治疗后缓解的6例患者髂后上棘骨髓液,体外分离培养BMSCs。Jurkat细胞复苏后传代培养,取生长状态良好的细胞用于实验,建立BMSCs与Jurkat细胞共培养模型。设置Jurkat细胞组、BMSCs组、BMSCs+Jurkat细胞组、BMSCs+Jurkat细胞+PTL 4 μmol/L组、BMSCs+Jurkat细胞+PTL 8 μmol/L组、BMSCs+Jurkat细胞+PTL 12 μmol/L组、BMSCs+Jurkat细胞+PTL 16 μmol/L 组。黏附实验检测共培养24 h和48 h后各组黏附率,ELISA测定各组可溶性血管细胞黏附分子-1(sVCAM-1)表达水平,RT-PCR法检测BMSCs VCAM-1 mRNA 的相对表达量。结果 各组培养24 h和48 h后,黏附率与PTL浓度呈负相关(r=-0.95、-0.91,P<0.05)。各组sVCAM-1表达水平比较,差异有统计学意义(P<0.05),BMSCs+Jurkat细胞组、BMSCs+Jurkat细胞+PTL 4 μmol/L组、BMSCs+Jurkat细胞+PTL 8 μmol/L组和BMSCs+Jurkat细胞+PTL 12 μmol/L组sVCAM-1表达水平高于BMSCs组(P<0.05),各加入PTL组sVCAM-1表达水平低于BMSCs+Jurkat细胞组(P<0.05),各加入PTL组sVCAM-1表达水平与PTL浓度呈负相关(r=-0.994,P=0.001)。各组BMSCs VCAM-1 mRNA表达水平比较,差异有统计学意义(P<0.05),BMSCs组与BMSCs+Jurkat细胞+ PTL 16 μmol/L组BMSCs VCAM-1 mRNA表达水平比较,差异无统计学意义(P>0.05)。各加入PTL组BMSCs VCAM-1 mRNA表达水平与PTL浓度呈负相关(r=-0.994,P=0.001)。结论 PTL可以通过降低VCAM-1的表达抑制BMSCs对Jurkat细胞的黏附,减弱骨髓微环境对白血病细胞的保护作用。
Jurkat细胞;小白菊内酯;骨髓基质细胞;黏附;VCAM-1;前体细胞淋巴母细胞白血病淋巴瘤
何玉婵,周思瑶,唐荣芳,等.小白菊内酯干预骨髓基质细胞对Jurkat细胞黏附作用的影响及其机制研究[J].中国全科医学,2015,18(5):535-539.[www.chinagp.net]
He YC,Zhou SY,Tang RF,et al.Parthenolide intervenes the adhesion of BMSCs to Jurkat cells and its possible mechanism[J].Chinese General Practice,2015,18(5):535-539.
骨髓基质细胞(BMSCs)是造血微环境中的主要成分,主要包括成纤维细胞、内皮细胞、脂肪细胞 、巨噬细胞等,其分泌的细胞因子、黏附分子、细胞外基质等形成复杂的网络系统,在细胞间信号传递过程中发挥重要作用。有研究表明,急性淋巴细胞白血病(ALL)患者骨髓微环境中存在细胞因子、黏附分子的异常表达,影响骨髓基质对白血病细胞的黏附和迁移,从而对白血病细胞产生保护作用[1]。鉴于此,对骨髓微环境与白血病细胞的相互作用施加干预可能是治疗ALL的新策略。野生菊的有效活性成分小白菊内酯(PTL)已被证实在体外具有抗肿瘤作用,本研究的前期实验亦证实PTL能抑制Jurkat细胞增殖,诱导其凋亡,且可加强其他化疗药物的作用[2]。PTL是否能影响ALL患者BMSCs对Jurkat细胞的黏附作用,国内外相关报道较少。本研究通过建立ALL患者BMSCs与Jurkat细胞共培养模型,探讨PTL干预后ALL患者BMSCs对Jurkat细胞黏附效果的改变及其可能的机制,为PTL的临床应用提供依据。
1 材料与方法
1.1 细胞 人ALL系Jurkat细胞购自天津血液学研究所。采集2013年10月—2014年3月于桂林医学院附属医院经FAB分型及MICM分型确诊为ALL并经治疗后缓解的6例患者髂后上棘骨髓液5 ml,肝素抗凝,提取BMSCs。患者男4例,女2例;年龄8~58岁,中位年龄28岁。本研究经患者及其家属同意并签署知情同意书。
1.2 试剂及仪器 RPMI 1640培养基购自美国Gibco公司;MTT、二甲基亚砜(DMSO)购自美国Amresco公司;DMEM/F12培养基购自美国Hyclone公司;PTL购自成都普瑞法科技开发有限公司;胎牛血清(FBS)购自杭州四季青生物工程材料有限公司;胰酶、双抗购自北京索莱宝科技有限公司;ELISA试剂盒购自欣博盛生物科技有限公司;总RNA提取试剂盒购自天根生化科技有限公司;反转录试剂盒及PCR试剂盒购自日本TaKaRa公司;引物设计和合成均由大连宝生物工程有限公司完成。实时荧光定量PCR仪购自美国ABI公司;酶标仪购自瑞士TECAN公司;微量台式高速冷冻离心机购自美国Thermo公司。
1.3 实验分组 本研究设置Jurkat细胞组、BMSCs组、BMSCs+Jurkat细胞组、BMSCs+Jurkat细胞+PTL 4 μmol/L组、BMSCs+Jurkat细胞+PTL 8 μmol/L组、BMSCs+Jurkat细胞+PTL 12 μmol/L组、BMSCs+Jurkat细胞+PTL 16 μmol/L组。
1.4 实验方法
1.4.1 BMSCs分离培养 在参考文献[3]基础上进行改进。取5 ml骨髓液至肝素抗凝的无菌管中,用吸管轻轻将骨髓液吹打混匀后吸取0.5 ml至25 cm2的塑料培养瓶中,加入含20%FBS、100 U/ml 青霉素、100 μg/ml链霉素的DMEM/F12培养基中,并轻轻吹打成单细胞悬液,置于37 ℃、饱和湿度、5%CO2的培养箱中培养。3 d后全量换液,弃去旧培养基,用磷酸盐缓冲液(PBS)轻轻洗涤2次,将未贴壁的细胞尽量洗去,再加入新的完全培养基。此后视细胞情况3~5 d换液。待细胞生长融合至80%~90%时用0.25%胰酶消化后进行传代,后改为含15%FBS的完全培养基培养。取第2~3代生长状态良好的细胞冻存保种,取第2~4代生长状态良好的细胞采用60Co 20 Gy照射后用于实验[4]。整个实验过程均为无菌操作。
1.4.2 Jurkat细胞培养 细胞复苏后用含10%FBS、100 U/ml青霉素、100 μg/ml 链霉素的 RPMI 1640培养基培养。视细胞情况2~3 d换液并传代一次。取生长状态良好的细胞用于实验。
1.4.3 BMSCs对Jurkat细胞的黏附率 方法参考文献[5]。调整BMSCs浓度为5×104/ml,接种于96孔板,每孔100 μl,置于37 ℃、饱和湿度、5%CO2培养箱培养过夜。取对数生长的Jurkat细胞,61×g离心6 min。调整细胞浓度为2×105/ml,加入96孔板中,每孔100 μl。BMSCs组加入100 μl培养基代替Jurkat细胞;加入PTL组PTL浓度分别为4、8、12、16 μmol/L,每组设6个复孔。置于37 ℃、饱和湿度、5%CO2的培养箱继续培养24、48 h。弃去旧培养基,PBS冲洗两遍,去除未贴壁的细胞,加入5 g/L MTT,每孔20 μl,置于37 ℃、饱和湿度、5%CO2的培养箱孵育4 h,弃上清液,每孔加入150 μl DMSO振荡10 min。Jurkat细胞组同条件悬浮培养,加入MTT培养4 h后,97×g离心10 min,去上清液,再加入150 μl DMSO。各组分别于培养24、48 h后采用酶标仪测490 nm处吸光度(OD)值。实验重复3次,取平均值。黏附率=〔(所测得OD值-BMSCs组OD值)/Jurkat细胞组OD值〕×100%。
1.4.4 可溶性血管细胞黏附分子-1(sVCAM-1)的表达 选用生长良好的BMSCs,0.25%胰酶消化,加入完全培养基重悬调整细胞数为1×105/ml,接种于6孔板,共2 ml,置于培养箱孵育过夜。弃去旧培养基,PBS冲洗2次。取对数生长的Jurkat细胞,61×g离心6 min,去上清夜,用无血清的RPMI 1640培养基重悬调整细胞数为1×106/ml,每孔加入1 ml,待细胞沉淀后药物组加入1 ml各浓度PTL的无血清培养基,置于培养箱继续培养24 h。轻轻吸取上清液至2 ml环氧树脂管中,607×g离心10 min,收集上清液至新的环氧树脂管中采用ELISA检测sVCAM-1表达。实验重复3次,取平均值。ELISA步骤严格按照试剂盒说明书操作。
1.4.5 VCAM-1 mRNA的表达 以BMSCs+Jurkat细胞+PTL 16 μmol/L组为基准组,采用相对定量法测定VCAM-1 mRNA的相对表达量,计算公式为:相对表达量=2-ΔΔCT,其中ΔΔCT=〔(待测组目的基因CT值-待测组内参基因CT值)-(基准组目的基因CT值-基准组内参基因CT值)〕,CT值为每个反应管内的荧光信号达到所设定阈值时的反应循环数。收集各组BMSCs,按试剂盒说明书提取总RNA,反转录为cDNA,以β-actin为内参基因,实时荧光定量PCR仪检测各组VCAM-1 mRNA的表达。VCAM-1上游5′-GCGGAGACAGGAGACACAGTACTAA-3′,下游 5′-GAGCACGAGAAGCTCAGGAGAA-3′;β-actin 上游 5′-TGGCACCCAGCACAATGAA-3′,下游 5′-CTAAGTCATAGTCCGCCTAGAAGCA-3′。两步法PCR扩增反应:第1步预变性 95 ℃ 30 s,第2步PCR反应 95 ℃ 5 s→60 ℃ 34 s,共40个循环。
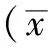
2 结果
2.1BMSCs的分离培养 原代BMSCs第8天融合度为90%,镜下观察细胞呈长梭形、旋涡状生长(见图1)。此后10~14d传代1次,传代后的细胞形态与原代细胞相似。细胞形态多样,以长梭形为主,偶见三角形、多角形等(见图2)。
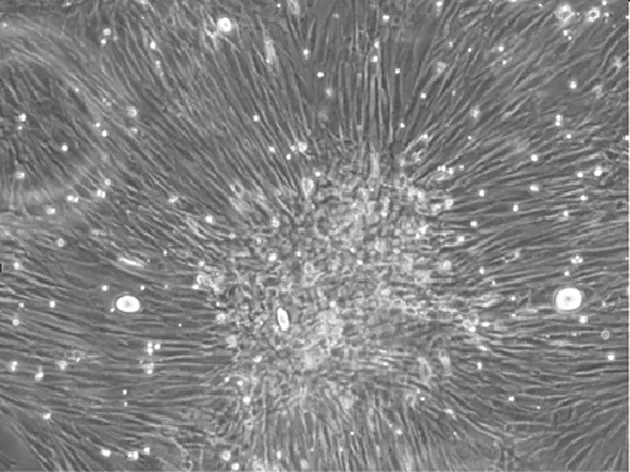
图1 体外培养第8天原代BMSCs生长情况(×100)

图2 体外培养第1代BMSCs第3天生长情况(×100)
2.2 各组黏附率比较 各组培养24h后,黏附率与PTL浓度呈负相关(r=-0.95,P<0.05,见表1)。各组培养48h后,各组黏附率与PTL浓度负相关(r=-0.91,P<0.05,见表2)。
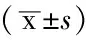
表1 各组培养24 h后黏附率
注:BMSCs=骨髓基质细胞,PTL=小白菊内酯,OD=吸光度
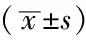
表2 各组培养48 h后黏附率
2.3 各组sVCAM-1表达水平比较 各组sVCAM-1表达水平比较,差异有统计学意义(P<0.05),BMSCs+Jurkat细胞组、BMSCs+Jurkat细胞+PTL 4 μmol/L组、BMSCs+Jurkat细胞+PTL 8 μmol/L组和BMSCs+Jurkat细胞+PTL 12 μmol/L组sVCAM-1表达水平高于BMSCs组(P<0.05),各加入PTL组sVCAM-1表达水平低于BMSCs+Jurkat组(P<0.05),BMSCs组与Jurkat细胞+BMSCs+PTL 16 μmol/L组sVCAM-1表达水平比较,差异无统计学意义(P>0.05)。各加入PTL组sVCAM-1表达水平与PTL浓度呈负相关(r=-0.994,P=0.001,见表3)。
Table3ComparisonoftheexpressionlevelofsVCAM-1amongdifferentgroups
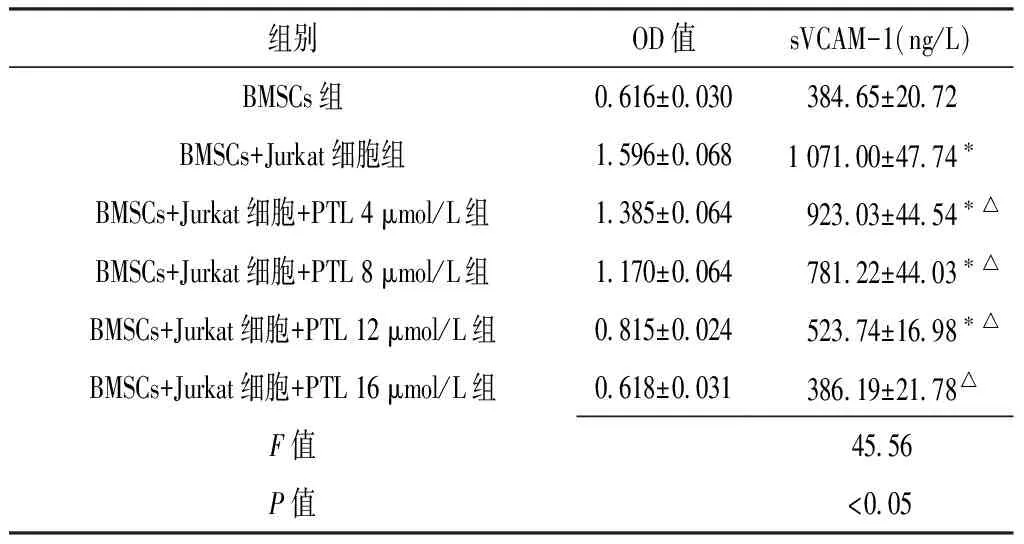
组别OD值sVCAM-1(ng/L)BMSCs组0616±003038465±2072BMSCs+Jurkat细胞组1596±0068107100±4774∗BMSCs+Jurkat细胞+PTL4μmol/L组1385±006492303±4454∗△BMSCs+Jurkat细胞+PTL8μmol/L组1170±006478122±4403∗△BMSCs+Jurkat细胞+PTL12μmol/L组0815±002452374±1698∗△BMSCs+Jurkat细胞+PTL16μmol/L组0618±003138619±2178△F值4556P值<005
注:与BMSCs组比较,*P<0.05;与BMSCs+Jurkat组比较,△P<0.05
2.4 各组BMSCs VCAM-1 mRNA表达比较 各组BMSCs VCAM-1 mRNA表达水平比较,差异有统计学意义(P<0.05),BMSCs组与BMSCs+Jurkat细胞+ PTL 16 μmol/L组BMSCs VCAM-1 mRNA表达水平比较,差异无统计学意义(P>0.05)。各加入PTL组BMSCs VCAM-1 mRNA表达水平与PTL浓度呈负相关(r=-0.994,P=0.001,见表4)。
3 讨论
骨髓微环境作为造血细胞的“土壤”,在白血病中的作用越来越受到重视。已有研究表明骨髓微环境对白血病细胞的保护作用是引起白血病化疗耐药及微小残留病灶的根本原因,最终导致白血病复发[6]。微环境中的BMSCs与白血病细胞直接接触,其分泌的各种物质介导BMSCs对白血病细胞的黏附,以增强白血病细胞的增殖、抗凋亡能力[7]。寻找和开发阻断骨髓微环境和白血病细胞相互作用、增强化疗疗效的药物成为近年的研究热点。PTL是倍半萜烯内酯的主要成分,从中药野生甘菊中提取获得[8]。PTL不仅对实体肿瘤如乳腺癌、肺癌等具有抗肿瘤效应,近年来研究还发现PTL对白血病干/祖细胞同样具有抗肿瘤作用,其抗白血病机制主要是抑制NF-κB信号通道、激活P53基因、增加活性氧等[9]。
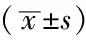
Table4ComparisonoftheexpressionlevelofBMSCsVCAM-1mRNAamongdifferentgroups

组别ΔΔCT值mRNA相对值BMSCs组0191±0047088±003BMSCs+Jurkat细胞组-4354±00222046±031BMSCs+Jurkat细胞+PTL4μmol/L组-3883±00171476±017BMSCs+Jurkat细胞+PTL8μmol/L组-3233±0013940±009BMSCs+Jurkat细胞+PTL12μmol/L组-1935±0089383±023BMSCs+Jurkat细胞+PTL16μmol/L组0100±001F值700615P值<005
本研究将Jurkat细胞与ALL患者BMSCs共同培养,结果显示Jurkat细胞可黏附到BMSCs。经PTL作用后,细胞黏附率下降,呈浓度依赖性。为探讨PTL抑制Jurkat细胞黏附到BMSCs的机制,通过ELISA检测BMSCs与Jurkat细胞共培养后上清液sVCAM-1水平。结果表明单独培养的BMSCs分泌的sVCAM-1量较少,而BMSCs和Jurkat细胞共培养后上清液中sVCAM-1的浓度显著升高,这表明两者间的直接接触是Jurkat细胞从BMSCs获得幸存信号的基础。PTL作用后可以抑制sVCAM-1的表达,随着浓度增加,抑制作用增强,BMSCs+Jurkat细胞+PTL 16 μmol/L组sVCAM-1的分泌量降至单独培养的BMSCs组水平。PCR检测BMSCs VCAM-1 mRNA表达结果与上清液中sVCAM-1的表达水平一致。这表明Jurkat细胞与BMSCs的相互作用是促进VCAM-1表达的关键,阻断此信号通路有望改变骨髓微环境对白血病细胞的保护作用。本研究前期实验证实PTL可以通过抑制NF-κB信号通道来抑制Jurkat细胞增殖,促进凋亡[2]。Jacamo等[10]研究表明白血病细胞表面的人极迟抗原4(VLA4)与BMSCs表面的VCAM-1结合后激活NF-κB信号通道,随后IKK激活,使IκB磷酸化,导致IκB泛素化并脱离NF-κB/IκB复合体,IκB的降解促使NF-κB向细胞核转移,并选择性的结合到相应的DNA序列,启动下游基因如白介素8(IL-8)、白介素6(IL-6)、CCL2和VCAM-1等表达。Wan等[11]和Liang等[12]研究证实抑制NF-κB信号通道可以下调VCAM-1的表达。以上研究表明PTL抑制Jurkat细胞黏附到BMSCs可能与其降低NF-κB活性、下调NF-κB下游靶基因VCAM-1的表达有关。VCAM-1属于免疫球蛋白超家族成员,已有研究表明ALL患者高表达VCAM-1,通过介导白血病细胞与BMSCs黏附,提高白血病细胞增殖和抗凋亡能力,此外还能增强白血病细胞与血管内皮细胞的结合能力导致白血病发生髓外转移[13]。
综上所述,PTL可以通过降低VCAM-1的表达抑制BMSCs对Jurkat细胞的黏附,减弱骨髓微环境对白血病细胞的保护作用,使其对化疗更敏感。这为研发靶向干预骨髓微环境与白血病细胞相互作用的药物带来希望。鉴于体外建立的ALL骨髓微环境模型与体内的差异,在本研究的基础上建立白血病小鼠模型,进一步探讨PTL体内抗ALL效应,为PTL的临床应用提供更可靠的理论依据。
[1]de Vasconcellos JF,Laranjeira AB,Zanchin NI,et al.Increased CCL2 and IL-8 in the bone marrow microenvironment in acute lymphoblastic leukemia[J].Pediatr Blood Cancer,2011,56(4):568-577.
[2]王晓桃,刘玲,刘健,等.小白菊内酯增强阿霉素和地塞米松对Jurkat白血病细胞增殖抑制及凋亡的研究[J].时珍国医国药,2014,25(6):1347-1350.
[3]Hu Y,Cheng P,Xue YX,et al.Molecular mechanism of the tropism of bone marrow-derived mesenchymal stem cells toward glioma[J].Journal of China Medical University,2013,42(11):965-969.(in Chinese) 胡宜,程鹏,薛一雪,等.骨髓间充质干细胞向人胶质瘤迁移的分子机制初探[J].中国医科大学学报,2013,42(11):965-969.
[4]Chen XH,Zhang C,Zhang X,et al.Construction of cell adhesion mediated drug resistance model of human lymphocytic leukemia[J].Journal of Third Military Medical University,2006,28(23):2336-2339.(in Chinese) 陈幸华,张诚,张曦,等.人淋巴细胞白血病细胞黏附介导耐药模型构建初探[J].第三军医大学学报,2006,28(23):2336-2339.
[5]Dong-Feng Z,Ting L,Cheng C,et al.Silencing HIF-1α reduces the adhesion and secretion functions of acute leukemia hBMSCs[J].Braz J Med Biol Res,2012,45(10):906-912.
[6]Konopleva MY,Jordan CT.Leukemia stem cells and microenvironment:biology and therapeutic targeting[J].J Clin Oncol,2011,29(5):591-599.
[7]Hall BM,Fortney JE,Taylor L,et al.Stromal cells expressing elevated VCAM-1 enhance survival of B lineage tumor cells[J].Cancer Lett,2004,207(2):229-239.
[8]Li CJ,Guo SF,Shi TM.Culture supernantants of breast cancer cell line MDA-MB-231 treated with parthenolide inhibit the proliferation,migration,and lumen formation capacity of human umbilical vein endothelial cells[J].Chin Med J(Engl),2012,125(12):2195-2199.
[9]Guzman ML,Rossi RM,Karnischky L,et al.The sesquiterpene lactone parthenolide induces apoptosis of human acute myelogenous leukemia stem and progenitor cells[J].Blood,2005,105(11):4163-4169.
[10]Jacamo R,Chen Y,Wang Z,et al.Reciprocal leukemia-stroma VCAM-1/VLA-4-dependent activation of NF-κB mediates chemoresistance[J].Blood,2014,123(17):2691-2702.
[11]Wan M,Liu J,Ouyang X.Nucleotide-binding oligomerization domain 1 regulates porphyromonas gingivalis-induced vascular cell adhesion molecule 1 and intercellular adhesion molecule 1 expression in endothelial cells through NF-κB pathway[J].J Periodontal Res,2014.doi:10.1111/jre.12192.
[12]Liang CJ,Lee CW,Sung HC,et al.Magnolol reduced TNF-α-induced vascular cell adhesion molecule-1 expression in endothelial cells via JNK/p38 and NF-κB signaling pathways[J].Am J Chin Med,2014,42(3):619-637.
[13]王永韧,刘澎,陆化.恶性血液病中细胞间黏附分子和血管间黏附分子作用研究进展[J].国际输血及血液学杂志,2006,29(3):216-219.
(本文编辑:吴立波)
Parthenolide Intervenes the Adhesion of BMSCs to Jurkat Cells and Its Possible Mechanism
HEYu-chan,ZHOUSi-yao,TANGRong-fang,etal.
DepartmentofHematology,AffiliatedHospitalofGuilinMedicalCollege,Guilin541001,China
Objective To investigate the adhesion of bone marrow stromal cells(BMSCs) to Jurkat cells and the intervention of parthenolide(PTL) on it in patients with acute lymphoblastic leukemia(ALL).Methods From October 2013 to March 2014,in the Affiliated Hospital of Guilin Medical College,a co-culture model of BMSCs and Jurkat cells were builted from the posterior superior iliac spine marrow fluid of 6 ALL patients.Jurkat cells group,BMSCs group,BMSCs+Jurkat cells group,BMSCs+Jurkat cells+PTL 4 μmol/L group,BMSCs+Jurkat cells+PTL 8 μmol/L group,BMSCs+Jurkat cells+PTL 12 μmol/L group,BMSCs+Jurkat cells+PTL 16 μmol/L group were setted.Adhesion rates were detected by adhesion test at hours 24,48 after the cultures,the expression of soluble vascular cell adhesion molecule-1(sVACM-1) by ELISA,relative expression of BMSCs VCAM-1 mRNA by RT-PCR in all groups.Results At hours 24,48 after the cultures, adhesion rate was negatively correlated with PTL concentration in all groups(r=-0.95, -0.91,P<0.05).There was difference in sVCAM-1 expression in all groups(P<0.05),higher in groups BMSCs+Jurkat cells, BMSCs+Jurkat cells+PTL 4 μmol/L, BMSCs+Jurkat cells+PTL 8 μmol/L, BMSCs+Jurkat cells+PTL 12 μmol/L than in BMSCs group(P<0.05), lower in PTL groups than in BMSCs+Jurkat cells group(P<0.05).Expression level of sVCAM-1 was negatively correlated with PTL concentration in PTL groups(r=-0.944,P=0.001).There was difference in BMSCs VCAM-1 mRNA expression in each group(P<0.05),no difference between BMSCs group and BMSCs+Jurkat cells+PTL 16 μmol/L group.Expression level of BMSCs VCAM-1 mRNA was negatively correlated with PTL concentration in PTL groups(r=-0.944,P=0.001).Conclusion PTL inhibits the adhesion of BMSCs to Jurkat cells by decreasing VCAM-1 expression.Weakened bone marrow microenvironment is of protective effect on leukemic cells.
Jurkat cells;Parthenolide;BMSCs;Adhesion;VCAM-1;Precursor cell lymphoblastic leukemia-lymphoma
广西自然科学基金资助项目(2012GXNSFAA053112,2014GXNSFAA118170)
541001广西桂林市,桂林医学院附属医院血液内科
王晓桃,541001广西桂林市,桂林医学院附属医院血液内科;E-mail:wxttjl@126.com
R 733.711
A
10.3969/j.issn.1007-9572.2015.05.012
2014-09-24;
2014-12-22)

