广西肝癌高发区乙型肝炎病毒基本核心启动子区A1762T/G1764A双突变对肝癌家族聚集的影响
石仁芳,吴继周,万裴琦,吴健林,宁秋悦,庞 裕
·论著·
广西肝癌高发区乙型肝炎病毒基本核心启动子区A1762T/G1764A双突变对肝癌家族聚集的影响
石仁芳,吴继周,万裴琦,吴健林,宁秋悦,庞 裕
目的 探讨广西肝癌高发区乙型肝炎病毒(HBV)基因组基本核心启动子(BCP)区A1762T/G1764A双突变对肝癌家族聚集的影响。方法 收集2007年7月—2012年7月广西肝癌高发区39个肝癌高发家族中103例成员作为试验组,在相同地区59个无癌家族中选择与试验组年龄、性别、生活环境匹配的103例成员作为对照组,将试验组按家族患肝癌例数分为2~3例亚组(45例)和≥4例亚组(58例);按亲属分级分为一级亲属组(48例),二级亲属组(32例),三级及以上亲属组(23例)。提取所有研究对象HBV DNA,PCR扩增并测序检测BCP区A1762T/G1764A双突变情况。结果 试验组A1762T/G1764A双突变率高于对照组 〔χ2=12.518,P<0.001;OR=2.788,95%CI(1.569,4.955)〕。试验组男性A1762T/G1764A双突变率高于对照组 〔χ2=11.377,P=0.001;OR=3.450,95%CI(1.659,7.176)〕;两组女性A1762T/G1764A双突变率比较,差异无统计学意义〔χ2=1.983,P=0.159;OR=1.950,95%CI(0.766,4.965)〕。试验组≥30岁年龄段A1762T/G1764A双突变率高于对照组 〔χ2=10.743,P=0.001;OR=3.444,95%CI(1.622,7.314)〕;两组<30岁年龄段A1762T/G1764A双突变率比较,差异无统计学意义〔χ2=2.489,P=0.115;OR=2.053,95%CI(0.836,5.041)〕。试验组患肝癌2~3例亚组与≥4例亚组A1762T/G1764A双突变率比较,差异有统计学意义〔(χ2=6.639,P=0.01;OR=3.122,95%CI(1.290,7.555)〕。3组A1762T/G1764A双突变率比较,差异有统计学意义(P<0.05)。一级亲属亚组双突变率高于二级亲属亚组(P<0.05)。试验组HBeAg阴性者突变率高于HBeAg阳性者(χ2=6.361,P=0.012)。试验组A1762T/G1764A双突变者HBV DNA水平低于无双突变者(Z=-3.957,P<0.01)。结论 广西肝癌高发区HBV BCP区A1762T/G1764A双突变与肝癌家族聚集密切相关,A1762T/G1764A双突变可能对肝癌的发生具有重要的预测价值。
突变,基本核心启动子;肝肿瘤;乙型肝炎病毒;家族聚集
石仁芳,吴继周,万裴琦,等.广西肝癌高发区乙型肝炎病毒基本核心启动子区A1762T/G1764A双突变对肝癌家族聚集的影响[J].中国全科医学,2015,18(5):530-534.[www.chinagp.net]
Shi RF,Wu JZ,Wan PQ,et al.Effect of double mutation of basal core promoter A1762T/G1764A of hepatitis B virus on familial aggregation of primary liver cancer in area of Guangxi with high primary liver cancer incidence[J].Chinese General Practice,2015,18(5):530-534.
原发性肝癌(primary liver cancer,PLC)是最常见的恶性肿瘤之一,在我国,其病死率在恶性肿瘤中居第2位,术后5 年复发率高达54.1%~61.5%[1]。而广西是全国肝癌高发区,发生2例肝癌的家庭由33.9%增加至63.6%,乙型肝炎病毒(hepatitis B virus,HBV)感染是肝癌发生的主要因素[2]。人体受HBV感染后临床结局各异,是否发展为肝癌受病毒载量、宿主免疫及基因变异等因素影响。分子流行病学表明,HBV基因突变与肝癌的发生密切相关[3]。而基本核心启动子(basal core promoter,BCP)区中的A1762T/G1764A 双突变是基因突变中最重要的热点研究位点,其与家族性肝癌聚集的相关研究国内外鲜见报道。为此,本研究通过聚合酶链反应(PCR)技术及直接测序法重点对HBV BCP区A1762T/G1764A双突变进行检测,探讨该突变对广西肝癌聚集发病的影响。
1 资料与方法
1.1 一般资料 收集2007年7月—2012年7月广西肝癌高发区39个肝癌高发家族中103例成员作为试验组,其中男65例,女38例;平均年龄(32.7±12.1)岁;在相同地区59个无癌家族中选择与试验组年龄、性别、生活环境匹配的103例成员作为对照组,其中男65例,女38例;平均年龄(32.8±12.7)岁。研究对象均为乙肝表面抗原(HBsAg)阳性并排除甲、丙、戊肝抗体阳性。家族中曾发生过≥2例肝癌患者的视为肝癌高发家族,最早确诊为肝癌者为先证者,诊断标准为《原发性肝癌临床诊断与分期标准》[4];家族中未曾发生恶性肿瘤的视为无癌对照家族。在高发家族中,个体成员与先证者遗传物质间经历一次减数分裂定义为一级亲属(如父母、同胞、子女),个体与先证者遗传物质间经历二次减数分裂定义为二级亲属(如舅、姨、伯、叔等);依次类推定义为三级及以上亲属[5]。将试验组按家族患肝癌例数分为2~3例亚组(45例)和≥4例亚组(58例);按亲属分级分为一级亲属亚组(48例),二级亲属亚组(32例),三级及以上亲属亚组(23例)。所有研究对象签署知情同意书。
1.2 仪器与试剂 Thermo MDF-V4086S 超低温冰箱;Thermo多用台式离心机;HH-42数显恒温搅拌循环水箱及IW-A微量振荡器;ABI Veriti TM 多重控温PCR仪;PJ23L-SC1微波炉及JA1003电子天平;DYY-6C电泳仪及DYCP-31DN电泳槽;血清病毒QIAamp MinElute Virus Spin DNA提取试剂盒(德国QIAGEN公司);PCR Premix Taq缓冲液、1 000 bp DNA Marker(对照)、RNase-Free水;琼脂糖。
1.3 方法
1.3.1 标本的采集、保存与处理 采集研究对象空腹静脉血10 ml,静置2 h后,以4 500 r/min离心10 min,离心半径为6 cm,其中2 ml分离血清分装保存于-80 ℃冰箱备用,其余血清送广西医科大学第一附属医院检验中心检测甲、丙、戊肝抗体及乙肝两对半[HBsAg、乙肝表面抗体(HBsAb)、乙肝e抗原(HBeAg)、乙肝e抗体(HBeAb)、乙肝核心抗体(HBcAb)]和HBV DNA(检测下限为500 copies/ml)、肝功能(胆红素、血清蛋白、丙氨酸氨基转移酶、天冬氨酸氨基转移酶)等。
1.3.2 DNA的提取 DNA的提取采用血清病毒QIAamp MinElute Virus Spin DNA提取试剂盒,按说明书严格操作,具体步骤如下:(1)吸取25 μl QIAGEN Protease至1.5 ml离心管中,加入200 μl血清样品。(2)加入200 μl Buffer AL,震荡15 s混匀,使样品充分裂解。(3)56 ℃孵育15 min。(4)加入250 μl 96%乙醇,震荡15 s混匀,室温静置5 min。(5)将裂解液转移至2 ml收集管的柱膜上,8 000 r/min离心1 min,离心半径为6 cm,弃滤液。(6)依次加入500 μl Buffer AW1、500 μl Buffer AW2、500 μl 96%乙醇,每次加入后均以8 000 r/min离心1 min,离心半径为6 cm,弃滤液。(7)14 000 r/min离心3 min,离心半径为6 cm,将滤膜风干。(8)将柱子移至一新的1.5 ml离心管中,小心开盖,加20~50 μl RNase-Free 水至滤膜中心。盖上盖室温静置5 min,14 000 r/min离心1 min,离心半径为6 cm,所得洗脱液即为提取的HBV DNA,立即采用Nanodrop2000检测DNA的纯度。将提取的DNA置于-20 ℃冰箱保存待用。
1.3.3 引物的制备 下载NCBI基因组数据库中HBV各基因型标准株序列,据BCP两端保守区采用Primer 5.0 软件设计引物:上游引物 5′-GACCTTGAGGCATACTTC- 3′,下游引物 5′-CAGAGCAGAGGCGGTGT- 3′,目的片段长度为320 bp,由上海生工生物有限公司合成。
1.3.4 PCR反应体系及条件 PCR反应总体系为50 μl,包括:Premix Taq 25 μl、DN模板A 2 μl、上、下游引物各1 μl、RNase-Free水21 μl。反应条件为:94 ℃预变性5 min;94 ℃反应35 s、55 ℃反应45 s、72 ℃反应60 s,共35个循环;72 ℃反应7 min。PCR产物经2%琼脂糖凝胶电泳,纯化、测序(上海立菲生物技术有限公司)。
1.3.5 HBV DNA BCP区A1762T/G1764A 双突变测定 从NCBI GenBank数据库中下载25条基因型全序列(KC836881、JF436921、JF899335、KF495606、HQ638218、JQ040175、JQ732168、JN792903、HQ833471、FN594756、KF767452、KF356417、KF917517、JN406371、JX978431、JQ040126、JX560519、JF436923、JF899336、JN418567、KC875342、JX982167、HM214751、JX274019、JF290200)并参照广西14条HBV标准株(KF373033~ KF373041、KF425553~KF425557)作为参考序列,采用DNAStar 、SeqMan及Chromas软件与所测序列进行比对。
1.4 统计学方法 应用SPSS 16.0统计学软件进行数据分析,非正态分布的计量资料以中位数(四分位数间距)〔M(QR)〕表示,采用非参数检验;计数资料比较采用χ2检验;关联强度分析采用OR值及95%CI表示。以P<0.05为差异有统计学意义。
2 结果
2.1 PCR电泳及测序结果 研究对象均成功扩增HBV BCP区基因,M泳道为Marker,1、2、3、4、5泳道为试验组PCR阳性结果,6泳道为对照组PCR结果(见图1),A1762T/G1764A双突变测序结果见图2。

图1 试验组与对照组PCR产物电泳图

注:从左到右箭头所示为nt1762 A→T和nt1764 G→A
图2 A1762T/G1764A双突变测序结果
Figure 2 Sequencing result of A1762T/G1764A double mutations
2.2 不同性别及年龄试验组与对照组中HBV BCP区A1762T/G1764A双突变的比较 试验组A1762T/G1764A双突变率高于对照组 〔70.9%(73/103)与46.6%(48/103)〕,差异有统计学意义〔χ2=12.518,P<0.001;OR=2.788,95%CI(1.569,4.955)〕。试验组男性A1762T/G1764A双突变率高于对照组〔72.3%(47/65)与43.1%(28/65)〕,差异有统计学意义〔χ2=11.377,P=0.001;OR=3.450,95%CI(1.659,7.176)〕;两组女性A1762T/G1764A双突变率比较〔68.4%(26/38)与52.6%(20/38)〕,差异无统计学意义〔χ2=1.983,P=0.159;OR=1.950,95%CI(0.766,4.965)〕。试验组≥30岁年龄段A1762T/G1764A双突变率高于对照组〔(74.6%,47/63)与(46.0%,29/63)〕,差异有统计学意义〔χ2=10.743,P=0.001;OR=3.444,95%CI(1.622,7.314)〕;两组<30岁年龄段A1762T/G1764A双突变率比较〔65.0%(26/40)与47.5%(19/40)〕,差异无统计学意义〔χ2=2.489,P=0.115;OR=2.053,95%CI(0.836,5.041)〕。
2.3 试验组患肝癌不同例数亚组A1762T/G1764A双突变率的比较 试验组家族患肝癌2~3例亚组与≥4例亚组A1762T/G1764A双突变率比较〔57.8%(26/45)与81.0%(47/58)〕,差异有统计学意义〔χ2=6.639,P=0.01;OR=3.122,95%CI(1.290,7.555)〕。
2.4 试验组各级亲属间A1762T/G1764A双突变率比较 3组A1762T/G1764A双突变率比较,差异有统计学意义(χ2=7.090,P<0.05)。一级亲属亚组双突变率高于二级亲属亚组,差异有统计学意义(P<0.05,见表1)。
表1 试验组各级亲属间A1762T/G1764A双突变率比较〔n(%)〕
Table 1 Comparison of incidence rate of A1762T/G1764A double mutations among all level relatives in the experimental group
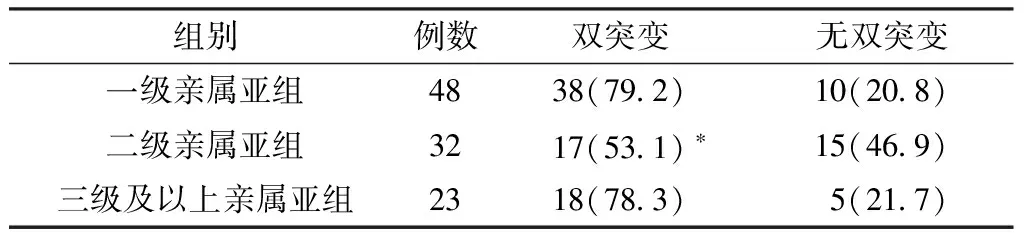
组别例数双突变无双突变一级亲属亚组4838(792)10(208)二级亲属亚组3217(531)∗15(469)三级及以上亲属亚组2318(783)5(217)
注:与一级亲属亚组比较,*P<0.05
2.5 试验组A1762T/G1764A双突变率与HBeAg状态及HBV DNA 水平的关系 试验组HBeAg阴性者突变率(79.7%,51/64)高于HBeAg阳性者(56.4%,22/39),差异有统计学意义(χ2=6.361,P=0.012)。试验组A1762T/G1764A双突变者HBV DNA水平为3.301(2.231),低于无双突变者6.011(3.577),差异有统计学意义(Z=-3.957,P<0.01)。
3 讨论
HBV属嗜肝DNA病毒科,其基因组共有4个开放读码框(open reading frame,ORF),分别为S、C、P和X区。其复制是以RNA为中间体进行反转录的独特过程,DNA聚合酶缺乏校正功能是其变异的分子基础,HBV基因组每天约有107碱基对发生错配[6]。
HBV BCP区位于nt1742-1849,部分与X基因3′末端及前C区基因5′起始端重叠。BCP区上存在大量转录因子结合位点,其对于前核心/核心mRNA(preC/C mRNA)和前基因组RNA(pgRNA)的转录发挥重要作用。BCP区有多位点、多形式的变异,其中nt1762 A→T和nt1764 G→A最为常见,称为A1762T/G1764A双突变。A1762T/G1764A双突变与肝癌的相关确切机制不明,推测可能与下列因素相关:(1)双突变影响HBeAg的表达、病毒复制、抗原表位改变及免疫逃逸等;(2)双突变使X基因编码的第130位氨基酸由亮氨酸变为蛋氨酸,第131位氨基酸由缬氨酸变为亮氨酸,这种密码子的改变可增强病毒DNA与肝细胞DNA的整合,激活原癌基因(c-myc和N-ras),抑制抑癌基因(P16)发生克隆性增殖而癌变[7]。Qu等[8]通过募集2 387例男性HBV携带者进行长达10年的随访研究,针对其中22例患者由携带者演变为肝癌的纵向研究发现,持续A1762T/G1764A双突变是肝癌发生的独立危险因素。Qin等[9]也发现,A1762T/G1764A有双突变的肝癌患者死亡年龄较无突变者早。本研究显示,A1762T/G1764A双突变在肝癌高发家族组的发生率高于对照家族,其发生肝癌的风险是无癌家族成员的2.788倍;进一步显示,肝癌高发家族中随患肝癌例数的增加突变率也相应地增加,≥4例亚组A1762T/G1764A双突变率高于2~3例亚组,提示A1762T/G1764A双突变与广西肝癌家族聚集密切相关,检测A1762T/G1764A双突变有可能作为早期诊断及判断预后的指标。本研究还发现,肝癌高发家族中男性及30岁以上者A1762T/G1764A双突变率也高于相应的无癌家族成员,其OR值分别为3.450和3.444,表明A1762T/G1764A双突变与性别及年龄分层有关,提示广西肝癌高发区的肝癌家族聚集的高危人群主要集中在男性及30岁以上人群。肝癌好发于中年男性在流行病学上已得到公认[10]。Park等[11]报道A1762T/G1764A双突变主要集中在>40岁的人群。而钟大妮等[12]通过对原籍为广西地区人口的研究发现,HBV为C基因型的相关性肝病主要集中在25岁以后,而C基因型与肝癌的进展密切相关。本研究结果显示双突变集中在30岁以上考虑可能与地域及本研究对象的HBV基因型以C基因型为主有关,有待进一步扩大样本及明确其基因型进行验证。
本研究还发现,试验组中一级亲属A1762T/G1764A双突变率高于二级亲属,提示血缘关系越近突变率越高,推测双突变与肝癌高发的相关性可能与遗传因素有关,其机制不明,目前国内外尚未见类似报道,而二、三级亲属突变例数较少,有待更大样本证实。本研究结果显示,试验组中HBeAg阴性者A1762T/G1764A双突变率高于HBeAg阳性者,表明A1762T/G1764A双突变与HBeAg的减少和消失有关。其机制可能为双突变使BCP区上的结合位点发生改变,产生新的转录因子结合位点,即肝细胞核因子1(HNF-1),HNF-1可选择性抑制preC/C mRNA的转录,下调HBeAg水平,使血清HBeAg减少或消失[13]。而双突变影响HBeAg表达后是否继而影响病毒复制水平,不同学者观点不一。Ochwoto等[14]认为突变可增加HBV的转录和包装,提高HBV DNA水平。另有观点认为,HBV复制时HBeAg为非必需结构蛋白,突变不影响HBV DNA水平[15]。而本研究结果显示,试验组中A1762T/G1764A双突变者的HBV DNA水平低于无双突变者,提示广西肝癌高发区A1762T/G1764A双突变可能不是通过影响HBV DNA复制水平升高的机制而导致肝癌家族聚集。在慢性HBV感染发展为肝癌的过程中,肝细胞基因和病毒基因整合导致病毒复制水平下降,使外周血HBV DNA水平降低[16]。
总之,检测HBV BCP区A1762T/G1764A双突变对广西肝癌家族聚集的预测有重要临床价值,但其具体的作用机制尚不清楚,且本研究为回顾性研究,样本量较少,有一定的局限性,因此其作用机制及与宿主的动态相互作用还需扩大样本进行前瞻性研究。
[1]Meng FJ,Cao B,Feng ZL,et al.Inhibition of H-rasVal12 expression by vector-based RNA interference in hepatocellular carcinoma cells[J].Chinese General Practice,2013,16(9):1000-1003.(in Chinese) 孟繁杰,曹斌,冯增利,等.应用载体介导的RNA干扰技术抑制肝癌细胞H-rasVal12的表达[J].中国全科医学,2013,16(9):1000-1003.
[2]Wu JZ,Li GJ,Chen WQ,et al.Primary epidemiology investigation in the area with high mortality of hepatocellular carcinoma discovered recently in Guangxi[J].Internal Medicine of China,2009,4(5):678-680.(in Chinese) 吴继周,李国坚,陈务卿,等.广西新发现肝癌高发点的初步流行病学研究 [J].内科,2009,4(5):678-680.
[3]Lu DD.Advances in molecular biology research of primary liver cancer[J].China Oncology,2000,10(2):182-183.(in Chinese) 陆东东.原发性肝癌分子生物学研究进展[J].中国癌症杂志,2000,10(2):182-183.
[4]Yang BH,Xia JL.The criteria of clinical diagnosis and staging of primary liver cancer and instructions[J].Tumor,2002,22(1):75.(in Chinese) 杨秉辉,夏景林.原发性肝癌的临床诊断与分期标准及说明[J].肿瘤,2002,22(1):75.
[5]Pang Y,Li GJ,Wu JZ,et al.Correlation between serum anti-P53 and familial clustering of hepatocellular carcinoma in Guangxi[J].Chinese Journal of Medical Genetics,2012,29(2):206-209.(in Chinese) 庞裕,李国坚,吴继周,等.P53抗体与广西肝癌家族聚集性的相关性研究[J].中华医学遗传学杂志,2012,29(2):206-209.
[6]Nowak MA,Bonhoeffer S,Hill AM,et al.Viral dynamics in hepatitis B virus infection[J].Proc Natl Acad Sci USA,1996,93(9):4398-4402.
[7]Hou QL,Tang H,Huang FJ.Hepatitis B virus X protein and hepatocellular carcinoma[J].World Chinese Journal of Digestology,2008,16(1):50-55.(in Chinese) 侯全玲,唐红,黄飞骏.乙型肝炎病毒X蛋白与原发性肝癌[J].世界华人消化杂志,2008,16(1):50-55.
[8]Qu LS,Zhu J,Liu TT,et al.Effect of combined mutations in the enhancer II and basal core promoter of hepatitis B virus on development of hepatocellular carcinoma in Qidong,China [J].Hepatol Res,2014,44(12):1186-1195.
[9]Qin Y,Tang X,Garcia T,et al.Hepatitis B virus genotype C isolates with wild-type core promoter sequence replicate less efficiently than genotype B isolates but possess higher virion secretion capacity[J].J Virol,2011,85(19):10167-10177.
[10]Bosetti C,Turati F,La Vecchia C.Hepatocellular carcinoma epidemiology[J].Best Pract Res Clin Gastroenterol,2014,28(5):753-770.
[11]Park YM,Jang JW,Yoo SH,et al.Combinations of eight key mutations in the X/preC region and genomic activity of hepatitis B virus are associated with hepatocellular carcinoma[J].J Viral Hepat,2014,21(3):171-177.
[12]Zhong DN,Li GJ,Wu JZ,et al.Association between the HBV genotypes and clinical manifestations of HBV relative liver diseases and Immune status[J].Medical Innovation of China,2013(2):1-3.(in Chinese) 钟大妮,李国坚,吴继周,等.广西地区乙肝病毒基因分型与临床表现及机体免疫功能关系的研究[J].中国医学创新,2013(2):1-3.
[13]Quarleri J.Core promoter:a critical region where the hepatitis B virus makes decisions[J].World J Gastroenterol,2014,20(2):425-435.
[14]Ochwoto M,Chauhan R,Gopalakrishnan D,et al.Genotyping and molecular characterization of hepatitis B virus in liver disease patients in Kenya[J].Infect Genet Evol,2013,20:103-110.
[15]Jammeh S,Tavner F,Watson R,et al.Effect of basal core promoter and precore mutations on hepatitis B virus replication[J].J Gen Virol,2008,89(Pt 4):901-909.
[16]Amaddeo G,Cao Q,Ladeiro Y,et al.Integration of tumour and viral genomic characterisations in HBV-related hepatocellular carcinomas[J].Gut,2014.pii:gutjnl—2013-306228.doi:10.1136/gutjnl—2013-306228.[Epub ahead of print]
(本文编辑:李婷婷)
Effect of Double Mutation of Basal Core Promoter A1762T/G1764A of Hepatitis B Virus on Familial Aggregation of Primary Liver Cancer in Area of Guangxi with High Primary Liver Cancer Incidence
SHIRen-fang,WUJi-zhou,WANPei-qi,etal.
DepartmentofInfectiousDiseases,theFirstAffiliatedHospitalofGuangxiMedicalUniversity,Nanning530021,China
Objective To investigate the effect of double mutation of basal core promoter(BCP) A1762T/G1764A of hepatitis B virus(HBV)genome on familial aggregation of primary liver cancer(PLC) in area of Guangxi with high PLC incidence.Methods 103 cases from 39 families with high PLC incidence in area of Guangxi with high PLC incidence were selected as experiment group from July 2007 to July 2012,and another 103 cases with matched age,sex and living environment from families without PLC history in the same area were selected as control group.Based on the number of PLC cases in the family,the experiment group was further divided into 2-3 cases subgroup(n=45) and ≥4 cases subgroup(n=58);based on the classification of relatives,the experiment group was divided into first-level relatives group(n=48),second-level relatives group(n=32) and third-level and ≥ relatives group(n=23).The HBV DNA of all the subjects was extracted,and polymerase chain reaction(PCR) was used to amplify and sequence as well as to detect the double mutation of BCP A1762T/G1764A.Results The experiment group had a significantly higher double mutation rate of A1762T/G1764A 〔χ2=12.518,P<0.001;OR=2.788,95%CI(1.569,4.955)〕.Compared with the males in the control group,the males in the experiment group had a significantly higher double mutation rate of A1762T/G1764A 〔χ2=11.377,P=0.001;OR=3.450,95%CI(1.659,7.176)〕,while the double mutation rate of females in the two groups showed no statistically significant differences 〔χ2=1.983,P=0.159;OR=1.950,95%CI(0.766,4.965)〕.Compared with the control group,the cases ≥30 years old had a significantly higher double mutation rate of A1762T/G1764A 〔χ2=10.743,P=0.001;OR=3.444,95%CI(1.622,7.314)〕,while the double mutation rate of the cases <30 years old in the two groups showed no statistically significant differences 〔χ2=2.489,P=0.115;OR=2.053,95%CI(0.836,5.041)〕.The 2-3 cases subgroup and ≥4 cases subgroup in the experiment group showed statistically significant differences in the double mutation rate of A1762T/G1764A 〔χ2=6.639,P=0.01;OR=3.122,95%CI(1.290,7.555)〕.The first-level relatives group,second-level relatives group and third-level and above relatives group also showed statistically significant differences in the double mutation rate of A1762T/G1764A(P<0.05),with the first-level relatives subgroup having significantly higher rate than the second-level relatives subgroup(P<0.05).The double mutation rate of the cases with negative HBeAg in the experiment group was significantly higher than that of the cases with positive HBeAg(χ2=6.361,P=0.012).The cases with double mutation of A1762T/G1764A had a significantly lower level of HBV DNA compared with the cases without double mutation(Z=-3.957,P<0.01).Conclusion The double mutation of BCP A1762T/G1764A of HBV in high PLC incidence area of Guangxi is significantly correlated with familial aggregation,and the double mutation of A1762T/G1764A may be of great significance for predicting the development of PLC.
Mutation,basal core promoter;Liver neoplasms;Hepatitis B virus;Familial aggregation
国家自然科学基金资助项目(30960170);广西教育厅重点课题基金(桂教201202ZD021)
530021 广西南宁市,广西医科大学第一附属医院感染性疾病科
吴继周,530021 广西南宁市,广西医科大学第一附属医院感染性疾病科;E-mail:wjz925@163.com
R 735.7
A
10.3969/j.issn.1007-9572.2015.05.011
2014-09-21;
2014-12-21)

