乳腺癌患者血清中IL-10含量和Ki-67表达相关分析及临床意义①
许 娜 ,刘 蕾,褚景芝
(1.佳木斯大学基础医学院,黑龙江 佳木斯 154007; 2.鸡西矿业集团总医院,黑龙江 鸡西158100)
乳腺癌患者血清中IL-10含量和Ki-67表达相关分析及临床意义①
许 娜1,2,刘 蕾1,褚景芝2
(1.佳木斯大学基础医学院,黑龙江 佳木斯 154007; 2.鸡西矿业集团总医院,黑龙江 鸡西158100)
目的:探讨浸润性乳腺癌患者血清中IL-10含量及Ki-67表达变化与与年龄、肿瘤大小、临床分期、淋巴结转移的关系以及它们相互之间的线性关系。方法: 采用酶联免疫法检测癌患者血清中IL-10含量,采用免疫组化SABC法检测标本中Ki-67表达,并与患者临床病例因素进行分析。结果: 患者血清中IL-10含量与患者年龄无关,但与肿瘤大小(P<0.05),TNM分期(P<0.01)以及有无淋巴结转移(P<0.05)有关;Ki-67表达与患者是否发生淋巴结转移有关(P<0.05);Ki-67高表达患者中IL-10含量较高(P<0.05)。结论:乳腺癌患者血清中IL-10含量与肿瘤恶性程度相关,其高表达提示患者预后较差。
乳腺癌;白介素10;核增殖抗原
乳腺癌(BreatCancer)是女性最常见的恶性肿瘤之一,其发病率和死亡率分别位于女性恶性肿瘤的第二位和第六位[1]。近年来,乳腺癌病率有明显年轻化趋势,是女性健康的最大威胁之一。白介素10 (interlukin10 ,IL-10)能够调节机体免疫的功能,通过抑制单核细胞MHCII类分子和共刺激分子的表达,从而抑制其抗原递呈作用,在肿瘤细胞逃避机体免疫的过程中起到重要作用。Ki-67是细胞增殖最可靠的标记物,在评估肿瘤增殖方面具有不可替代的重要作用。在乳腺癌分型中,Ki-67是其中重要的指标,其表达增高表明肿瘤增值活跃,患者预后差。我们希望能够通过检测患者血清中IL-10含量,分析其变化与患者临场病理特征以及Ki-67指数的关系,研究乳腺癌肿瘤免疫机制,以期为患者治疗方案的制定以及患者预后评估提供参考。
1 材料和方法
1.1 标本收集
选取鸡西矿业集团总医院普外科2012-01~2014-07行手术切除并经病理检查诊断的浸润性乳腺癌患者148例,均为女性,年龄29~66岁,中位年龄53.5岁,所有患者中髓样癌患者18例,浸润性导管癌患者105例,浸润性小叶癌患者20例,其他类型患者5例。其中78例患者查见淋巴结转移,70例未见淋巴结转移。TNM分期:I期32例,II期患者52例,III期48例,IV期16例。所有患者均经三位具有中级以上的病理医师分别阅片,并取得一致意见方可进入本实验。所有标本均经4%中性甲醛溶液固定12~18h,取材后脱水,石蜡包埋, 4μm厚连续切片,分别作HE染色和免疫组化检测。
1.2 主要试剂
KI-67单克隆抗体及SABC免疫组化相关试剂盒均购自中杉金桥生物技术有限公司。IL-10酶联免疫检测试剂盒购自UscnLifeScience,Inc公司。
1.3 检测方法
1.3.1 血液样本采集及IL-10测定:清晨空腹状态下采集患者手术前全血标本5mL, 装于枸橼酸钠抗凝采血管中,血液与抗凝剂充分混匀,1500转离心15min。使用移液管将上层血浆轻轻抽出,转移至血浆样品管中,置于-80℃冰箱中保存备用。IL-10含量测定严格依照试剂盒说明书进行。
1.3.2 免疫组化染色:组织经10%中性甲醛固定,常规石蜡包埋,4μm厚连续切片,脱蜡、水化,PBS冲洗3×5min;置入枸橼酸盐缓冲液中加热抗原修复;加3%过氧化氢溶液, 室温下孵育10min,以阻断内源性过氧化物酶;PBS冲洗3×5min;滴加10%山羊血清室温封闭20min;甩去直接鼠抗人RhoC及TERT单克隆抗体,4℃冰箱中过夜;复温后PBS冲洗3×5min;加二抗37℃恒温水浴箱下孵育20min;PBS冲洗3×5min;加酶标SABC,室温下孵育30min;PBS冲洗3×5min;加新配制的DAB显色液,显微镜下观察,阳性显色为棕黄色;自来水冲洗,苏木素复染,0.1%盐酸分化,自来水冲洗,PBS冲洗返蓝;梯度酒精脱水干燥,中性树脂封片,用PBS代替一抗作为阴性对照,已知阳性片作为阳性对照。Ki-67在细胞核中表达,显示为棕色颗粒,每张切片随机计数检测5个高倍视野,计算阳性细胞数占细胞总数的比例。
1.4 统计学方法
采用SPSS17.0软件进行统计分析,计量资料采用表示,两组样本均数比较采用独立样本t检验,计数资料采用χ2检验,显著性水准取0.05。
2 结果
2.1 乳腺癌患者血清IL-10含量与临床特征的关系
在年轻患者中IL-10含量较高,但经过统计学分析发现差异没有显著性(P>0.05);与肿块直径小于2cm的患者相比,肿瘤直径大于2cm的患者血清中IL-10含量较高(P<0.05);与TNM分期为I~II期患者相比,III~IV患者血清中IL-10含量较高(P<0.01),当患者存在淋巴结转移时,IL-10含量明显升高(P<0.05),见表1。
表1 乳腺癌患者血清IL-10含量与临床特征的关系
2.2 乳腺癌患者Ki-67表达与临床特征的关系
Ki-67的表达与患者年龄,肿瘤大小以及TNM分期无明显关系,但与患者有无淋巴结转移密切相关,有淋巴结转移的乳腺癌患者,Ki-67指数较高(P<0.05),见表2。
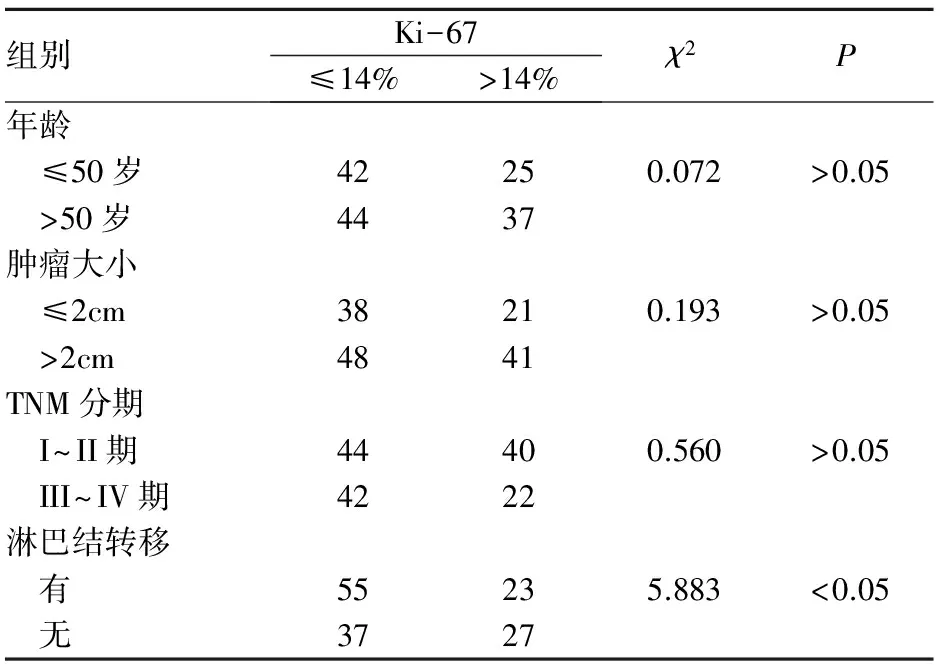
表2 乳腺癌患者Ki-67表达与临床特征的关系
2.3 乳腺癌患者血清IL-10含量与Ki-67表达的关系
在Ki-67高表达患者中IL-10含量为155.12pg/mL,明显高于Ki-67低表达患者血清IL-10含量(130.51pg/mL,P<0.05),见表3。

表3 乳腺癌患者血清IL-10含量与Ki-67表达的关系
3 讨论
乳腺癌是女性最常见的恶性肿瘤之一,全球每年约有130万被诊断出患有乳腺癌,46万女性死于本病,占所有女性恶性肿瘤死亡的13.7%,占所有女性死亡的1.7%[2],仅我国每年被诊断出的乳腺癌患者大约有18.9 万[3],并且其发病率一直呈上升趋势,在全球女性恶性肿瘤发病率中已上升至第二位[4]。因此研究乳腺癌发病机制,为临床治疗方案的制定和预后判断提供实验检查基础具有重要的意义。正常情况下,机体免疫系统能够识别、杀伤并及时清除体内突变细胞,防止肿瘤发生的功能,这种功能称为免疫监视功能,然而恶性肿瘤能够躲避宿主免疫系统监视在体内长期存在,增殖浸润。肿瘤逃避机体免疫监视的机制包括缺乏足够的免疫抗原性的抗原的表达,肿瘤表面主要组织相容性复合物下调抗原呈递不足;另外,肿瘤也可以通过分泌细胞因子,直接抑制炎性反应和特异性免疫细胞的功能。白介素(interlukin,IL)是一类具有免疫调节功能高活性蛋白质多肽分子,其中IL-10可以抑制T细胞活化,减少IL-2、IFN-γ等细胞因子的产生,从而抑制抗原呈递细胞(AntigenPresentingCell,APC)的活化[5],同时还能抑制APC表面MHCII类分子和共刺激分子的表达,影响其抗原递呈作用。某些肿瘤细胞也可以分泌IL-10,抑制机体对肿瘤的抗原呈递过程,同时,IL-10还能抑制CTL的增殖和细胞毒作用[6],降低自然杀伤细胞(NatureKillerCell)功能,这是肿瘤细胞逃避机体免疫反应的重要机制[7]。
Ki-67蛋白是反映细胞增殖活性的常用指标之一,在正常组织的静息细胞中几乎不表达,而在G1、S、G2、M期均有表达[8], 因此Ki-67被认为是有效评估肿瘤细胞增殖活性的标记物。Jalava等[9]认为Ki-67 ≤15%提示低度增殖活性,Ki-67表达的强度可以反映乳腺癌的增殖活性,从而指导肿瘤的治疗策略,这种观点被广泛接受,成为现在乳腺癌分型的依据[10]。我们研究结果显示,Ki-67表达水平与乳腺癌组织淋巴转移相关,具有淋巴结转移的患者Ki-67的阳性表达率明显高于淋巴结阴性患者(P=0.015),这与国内外一些文献报道结果是一致的[11]。Ki-67强表达的患者癌细胞的增殖程度高,具有更强的侵袭周围组织能力,因此更容易发生淋巴结转移。
在本研究中我们也发现TNM分期为III~IV期的患者和具有淋巴结转移的患者血清IL-10明显增高,同时在Ki-67高表达的患者中IL-10含量明显增高,这可能是IL-10抑制机体集体免疫功能的,减弱机体对肿瘤的杀伤作用,从而表现出更高的恶性行为。IL-10 通过对多种效应分子的抑制和对肿瘤细胞的作用来抑制机体的抗肿瘤免疫,在肿瘤发生发展过程中发挥重要作用。因此IL-10 在肿瘤的诊断治疗和判断预后方面均有广阔的应用前景。
[1]张敏璐, 黄哲宙, 郑莹. 中国2008年女性乳腺癌发病、死亡和患病情况的估计及预测[J]. 中华流行病学杂志,2012, 33(10): 1049-1051[2]FerlayJ,ShinHR,BrafF,etal.Globocan2008v1.2,CancerIncidenceandMortalityWorldwide:IARCCancerBaseNo. 10 [Internet].Lyon,France:InternationalAgencyforResearchonCancer; 2010[EB/OL].http://globocan.iarc.fr,accessedon10/05/2013.
[3]王璟, 芦文丽, 王媛,等.中国女性乳腺癌筛查现状分析及优化策略[J].中国妇幼保健,2013,28(18):2864-2867
[4]EarlyBreastCancerTrialists'CollaborativeGroup.Effectsofchemotherapyandhormonaltherapyforearlybreastcanceronrecurrenceand15-yearsurvival:anoverviewoftherandomizedtrials[J].Lancet,2005,365(9472):1687-1717
[5]SharmaS,StolinaM,LinY,etal.Tcell-derivedIL-10promoteslungcancergrowthbysuppressingbothTcellandAPCfunction[J].JImmunol,1999,163(9): 5020-5028
[6]MiuraY,ThoburnCJ,BrightEC,etal.Cytokineandchemokineprofilesinautologousgraft-versus-hostdisease(GVHD):interleukin10andinterferongammamaybecriticalmediatorsforthedevelopmentofautologousGVHD[J].Blood,2002,100(7): 2650-2658
[7]AramaC,GiustiP,BostromS,etal.Interethnicdifferencesinantigen-presentingcellactivationandTLRresponsesinMalianchildrenduringPlasmodiumfalciparummalaria[J].PLoSOne,2011,6(3):18319
[8]BertelliG,NelmesDJ,Al-AllakA.Biomarkersinthemanagementofbreastcancer:greatexpectations,hardtimes[J].ApplImmunohistochemMolMorphol,2013,21(6): 481-484
[9]JalavaP,KuopioT,Juntti-PatinenL,etal.Ki67immunohistochemistry:avaluablemarkerinprognosticationbutwithariskofmisclassification:proliferationsubgroupsformedbasedonKi67immunoreactivityandstandardizedmitoticindex[J].Histopatholog,2006,48(6):674-682
[10]CheangMC,ChiaSK,VoducD,etal.Ki67index,HER2status,andprognosisofpatientswithluminalBbreastcancer[J].JNatlCancerInst, 2009, 101(10): 736-750
[11]KontzoglouK,PallaV,KaraolanisG,etal.CorrelationbetweenKi67andbreastcancerprognosis[J].Oncology,2013,84(4): 219-225
许娜(1977~)女,黑龙江鸡西人,在读硕士研究生,副主任医师。
刘蕾(1973~)女,黑龙江佳木斯人,博士,副教授。E-mail:liuleitianxue@163.com。
R737.9
A
1008-0104(2015)04-0101-02
2015-03-03)

