赖氨酸磷酸盐水溶液提取紫薯色素的研究
刘 玮,王华平,李 霞,董新荣
(湖南农业大学理学院,湖南 长沙 410128)
赖氨酸磷酸盐水溶液提取紫薯色素的研究
刘玮,王华平,李霞,董新荣
(湖南农业大学理学院,湖南 长沙 410128)
摘要:制备了20种氨基酸离子液体,筛选出提取效果最好的赖氨酸磷酸盐型离子液体用于紫薯色素的提取,并考察了赖氨酸磷酸盐水溶液浓度、料液比、提取温度、提取时间对紫薯色素提取的影响,通过单因素实验和正交实验优化紫薯色素的提取工艺。结果表明,在赖氨酸磷酸盐水溶液浓度为2.0%、料液比为1∶10(g∶mL)、提取温度为40 ℃、提取时间为20 min时,紫薯色素的提取效果最好。
关键词:氨基酸离子液体;赖氨酸磷酸盐;紫薯色素;提取
紫薯(又名紫黑薯),因其良好的经济价值在我国被广泛种植。紫薯色素是从紫薯中提取的具有良好生物活性和水溶性的天然色素,主要存在于紫薯的块根、茎、叶以及薯片中,属于天然花青类色素,安全无毒。紫薯色素具有抗氧化[1]、抗肿瘤、抗突变、防辐射的作用[2],可缓解动物的肝功能障碍,是一类功能型食品添加剂和保健食品基料。目前,提取紫薯色素所用溶剂多为酸水[3]、乙醇[4]或酸性乙醇等,但这些溶剂存在腐蚀设备或易挥发等缺点。
离子液体是指在室温或者接近室温下呈液态的物质,由特定的阳离子和阴离子构成,几乎没有蒸汽压,性质稳定,不挥发,能够溶解多种有机、无机物质,应用广泛。用离子液体提取天然产物效果较好。李万华等[5]研究了溴化-1-乙基-3-甲基咪唑离子液体提取皂角刺白桦脂酸衍生物的方法,提取率为0.079%~0.107%,高于传统的乙醇回流提取法(0.050%)。郭燕燕等[6]以1-丁基-3-甲基咪唑四氟硼酸盐作为溶剂,从鹿藿根的70%乙醇粗提物中首次成功分离、纯化得到3种异黄酮类化合物。虽然离子液体不具有挥发性,不会蒸发进入外界环境,但其在水中的溶解性好,流入水体后会引起污染。含咪唑、吡啶等结构的离子液体的生物降解性较差[7]且具有一定毒性。
Fukumoto等[8]最先报道了以天然氨基酸为阴离子的离子液体;Tao等[9]最先合成了以氨基酸为阳离子的离子液体。与阴离子型氨基酸离子液体相比,阳离子型氨基酸离子液体基本无毒,具有更好的生物相容性和可降解性。这类离子液体自发现以来便引起人们的广泛关注,并在多个领域得到了研究和应用。梁升等[10]以甘氨酸、赖氨酸、脯氨酸作为阳离子合成了9种氨基酸离子液体(AAILs),并分别研究其水溶液对壳聚糖的溶解情况,发现甘氨酸盐酸盐离子液体水溶液对壳聚糖具有良好的溶解性。赵明泽等[11]以L-脯氨酸离子液体作为萃取剂和催化剂,对模拟油进行氧化-萃取脱硫,脱硫率达70%。然而,氨基酸离子液体在天然产物提取中的应用研究鲜有报道。
鉴于此,作者制备了20种氨基酸离子液体,筛选出提取效果最好的赖氨酸磷酸盐型离子液体用于紫薯色素的提取,并考察赖氨酸磷酸盐水溶液浓度、料液比、提取温度、提取时间对紫薯色素提取的影响,通过单因素实验和正交实验优化紫薯色素的提取工艺,以期为氨基酸离子液体在天然产物提取中的应用提供参考。
1实验
1.1 材料、试剂与仪器
紫薯,购于湖南农业大学东之源超市。
赖氨酸、组氨酸、丙氨酸、脯氨酸、谷氨酸均为生化试剂;其余试剂均为分析纯。
DF-101S型集热式恒温加热磁力搅拌器,巩义予华仪器有限责任公司;SB25-12DTN型超声波清洗机,宁波新芝生物科技股份有限公司;RE52AA型旋转蒸发器,上海亚荣生化仪器厂;SHB-Ⅲ型循环水式多用真空泵,郑州长城科工贸有限公司;UNICO-2000型可见分光光度计,尤尼柯上海有限公司;PHS-3B型pH计,上海精密科学仪器有限公司;AX-200型万分之一电子天平,日本Shimadzu Philippines公司。
1.2 方法
1.2.1pH=4.74的NaAc-HAc缓冲溶液的配制
称取3.00 g HAc,用适量蒸馏水溶解后定容于500 mL容量瓶中,得到0.1 mol·L-1的HAc溶液。再称取4.10 g NaAc,用适量蒸馏水溶解后定容于500 mL容量瓶中,得到0.1 mol·L-1的NaAc溶液。取等体积0.1 mol·L-1的HAc溶液和0.1 mol·L-1的NaAc溶液,混合均匀,即得到pH值为4.74的NaAc -HAc缓冲溶液。
1.2.2氨基酸离子液体的制备
分别以丙氨酸、脯氨酸、谷氨酸、赖氨酸、组氨酸与磷酸/盐酸反应制备得到20种以氨基酸为阳离子、磷酸/盐酸为阴离子的氨基酸离子液体。以赖氨酸磷酸盐离子液体的制备为例,具体制备方法如下:
(1)赖氨酸磷酸二氢盐的制备:称取1 g赖氨酸,加入适量蒸馏水溶解。按物质的量比1∶1加入7.9 mL 0.085 g·mL-1H3PO4充分反应,减压浓缩后得到黄色固体。再加入83.5 mL水使其溶解,得到浓度为2%的赖氨酸磷酸二氢盐(LysH2PO4)离子液体水溶液。
(2)赖氨酸磷酸一氢盐的制备:称取1 g赖氨酸,加入适量蒸馏水溶解。按物质的量比2∶1加入3.9 mL 0.085 g·mL-1H3PO4充分反应,减压浓缩后得到黄色固体。再加入66.5 mL水使其溶解,得到浓度为2%的赖氨酸磷酸一氢盐[(Lys)2HPO4]离子液体水溶液。
(3)赖氨酸磷酸盐的制备:称取1 g赖氨酸,加入适量蒸馏水溶解。按物质的量比3∶1加入2.6 mL 0.085 g·mL-1H3PO4充分反应,减压浓缩后得到黄色固体。再加入61 mL水使其溶解,得到浓度为2%的赖氨酸磷酸盐[(Lys)3PO4]离子液体水溶液。
同法制备其它氨基酸离子液体。
1.2.3氨基酸离子液体的筛选
紫薯洗净,切成2 mm左右的颗粒状,称取2 g紫薯颗粒放入锥形瓶中,按料液比1∶10(g∶mL,下同)加入浓度为2%的氨基酸离子液体水溶液,室温下超声提取30 min,滤纸过滤后收集滤液,用吸量管吸取3.00 mL滤液于10 mL容量瓶中,以pH=4.74的NaAc-HAc缓冲溶液定容,用可见分光光度计测定530 nm处吸光度。通过考察吸光度大小,筛选出提取效果最好的氨基酸离子液体。
1.2.4紫薯色素提取工艺的优化
1.2.4.1单因素实验
以赖氨酸磷酸盐水溶液为溶剂,在超声条件下,分别调节赖氨酸磷酸盐水溶液浓度、料液比、提取温度、提取时间来提取紫薯色素,提取液用滤纸过滤后置于25 mL容量瓶中,用蒸馏水定容。再取定容后的溶液3 mL,用NaAc-HAc缓冲溶液定容于10 mL容量瓶中,测定530 nm处吸光度。
1.2.4.2正交实验
以赖氨酸磷酸盐水溶液浓度、料液比、提取温度、提取时间为考察因素,以提取液吸光度(A)为考核指标,进行4因素3水平L9(34)正交实验,进一步优化提取条件。
2结果与讨论
2.1 氨基酸离子液体的筛选
将制备得到的氨基酸离子液体配制成浓度为2%的氨基酸磷酸/盐酸盐水溶液提取紫薯色素。由于氨基酸离子液体水溶液的pH值不同,因此,在测定提取液的吸光度之前,用吸量管移取提取液3 mL,以pH值为4.74的NaAc-HAc缓冲溶液定容至10 mL,用醋酸或碳酸氢钠调节pH值,再测定提取液在530 nm处的吸光度。通过吸光度的大小考察氨基酸离子液体水溶液提取紫薯色素的效果,即吸光度越大,紫薯色素的提取效果越好。结果见表1。
由表1可知:(1)中性氨基酸丙氨酸及脯氨酸与磷酸形成的盐的水溶液的pH值与阴离子的状态相关,2种氨基酸磷酸二氢盐的pH值在各自的系列中均最小,提取液的吸光度最大,即提取紫薯色素的效果最好。(2)酸性氨基酸谷氨酸的3种磷酸盐的pH值相差较小,提取液的吸光度也相差不大。(3)碱性氨基酸赖氨酸的磷酸二氢盐、磷酸一氢盐、磷酸盐水溶液的pH值逐渐增大,提取液的吸光度亦逐渐增大,其中,赖氨酸磷酸盐水溶液的吸光度最大,提取效果最好;碱性氨基酸组氨酸的磷酸一氢盐、磷酸盐的pH值接近中性,两者提取紫薯色素的效果接近,均比酸性的二氢盐的提取效果好,也比蒸馏水的提取效果好。(4)在盐酸型离子液体中,谷氨酸盐酸盐水溶液的pH值较低(1.40),提取液的吸光度最大,提取效果最好;赖氨酸盐酸盐水溶液呈中性,对紫薯色素的提取效果比蒸馏水要好。

表1 氨基酸离子液体水溶液提取紫薯色素结果Tab.1 Results of extraction of pigment from purplesweet potato by AAILs
注:pH值为2%水溶液的pH值。
综上可知,赖氨酸磷酸盐水溶液的pH值为8.92,呈弱碱性,提取液的吸光度最大,为0.449,提取效果最好。因此,选用赖氨酸磷酸盐水溶液作为紫薯色素的提取剂。
2.2 单因素实验结果
2.2.1赖氨酸磷酸盐水溶液浓度对紫薯色素提取的影响
在提取温度、提取时间、料液比一定的情况下,考察浓度分别为0.1%、0.5%、1.0%、1.5%、2.0%、2.5%的赖氨酸磷酸盐水溶液对紫薯色素提取的影响,结果见图1。
由图1可以看出,随着赖氨酸磷酸盐水溶液浓度的增大,吸光度逐渐增大;当浓度为2.5%时吸光度达到最大值;浓度为2.0%时的吸光度与浓度为2.5%时的吸光度相近。综合考虑经济、环保等因素,选择浓度为2.0%的赖氨酸磷酸盐水溶液为提取剂。
2.2.2料液比对紫薯色素提取的影响

图1 赖氨酸磷酸盐水溶液浓度对紫薯色素提取的影响Fig.1 Effect of concentration of L-lysine phosphateaqueous solution on extraction of pigment frompurple sweet potato
在赖氨酸磷酸盐水溶液浓度为2.0%、提取温度和提取时间一定的情况下,考察料液比(1∶4、1∶6、1∶8、1∶10、1∶12、1∶14,g∶mL,下同)对紫薯色素提取的影响,结果见图2。
由图2可以看出,随着赖氨酸磷酸盐水溶液用量的增加,提取液吸光度逐渐增大;当料液比达到1∶10时,吸光度达到最大值。因此,选择料液比为1∶10。
2.2.3提取温度对紫薯色素提取的影响
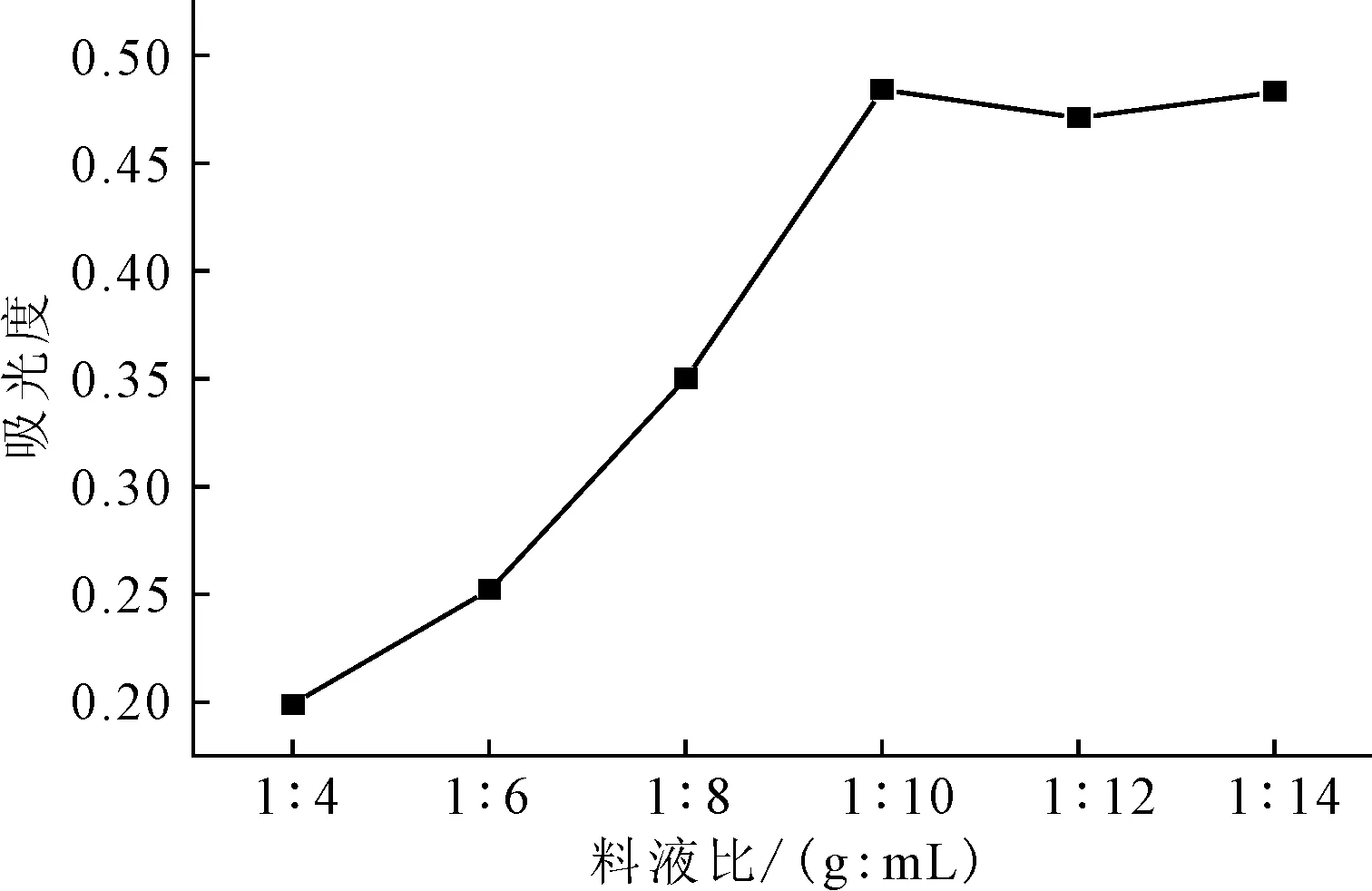
图2 料液比对紫薯色素提取的影响Fig.2 Effect of solid-liquid ratio on extraction ofpigment from purple sweet potato
用浓度为2.0%的赖氨酸磷酸盐水溶液作为提取剂,在料液比为1∶10、提取时间一定时,考察提取温度(20 ℃、30 ℃、40 ℃、50 ℃)对紫薯色素提取的影响,结果见图3。
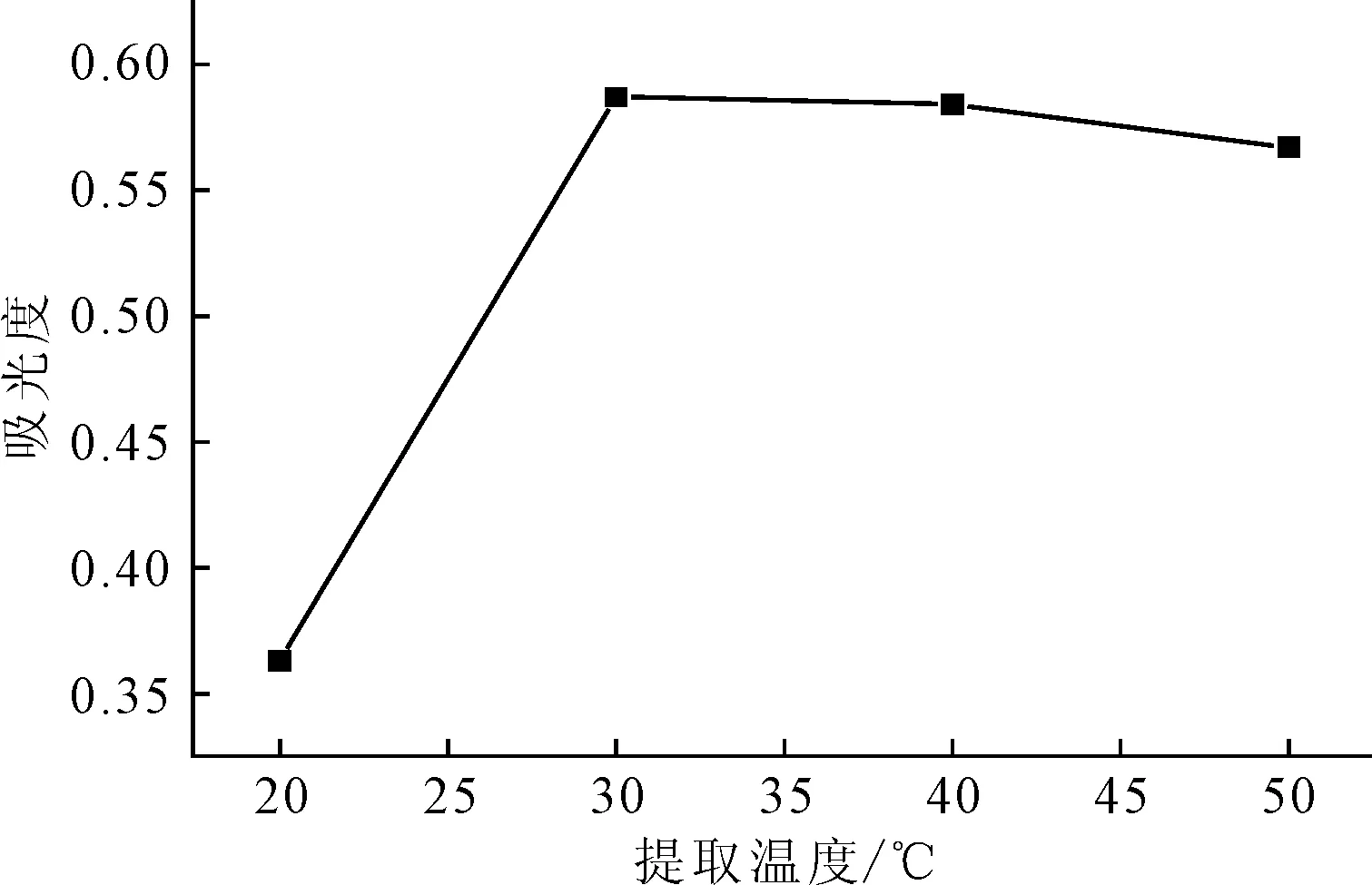
图3 提取温度对紫薯色素提取的影响Fig.3 Effect of extraction temperature on extraction ofpigment from purple sweet potato
由图3可以看出,提取温度由20 ℃升高到30 ℃时,提取液的吸光度快速增大;提取温度为30 ℃时,吸光度达到最大值;30~50 ℃时,吸光度变化不大。因此,选择提取温度为30 ℃。
2.2.4提取时间对紫薯色素提取的影响
在赖氨酸磷酸盐水溶液浓度为2.0%、料液比为1∶10、提取温度为30 ℃时,考察提取时间(10 min、15 min、20 min、25 min、30 min、35 min、40 min)对紫薯色素提取的影响,结果见图4。
由图4可以看出,在10~30 min内,随着提取时间的延长,吸光度不断增大;当提取时间达到30 min时,吸光度达到最大值;继续延长提取时间,提取液的吸光度变化不大。因此,选择提取时间为30 min。

图4 提取时间对紫薯色素提取的影响Fig.4 Effect of extraction time on extraction ofpigment from purple sweet potato
2.3 正交实验结果
根据单因素实验结果,以赖氨酸磷酸盐水溶液浓度、料液比、提取温度、提取时间为考察因素进行4因素3水平正交实验,结果与分析见表2。
由表2可以看出,以赖氨酸磷酸盐水溶液提取紫薯色素,各因素对提取效果的影响大小依次为:提取温度>料液比>赖氨酸磷酸盐水溶液浓度>提取时间。最佳提取条件为:赖氨酸磷酸盐水溶液浓度2.5%、料液比1∶10(g∶mL)、提取温度40 ℃、提取时间30 min。由于赖氨酸磷酸盐水溶液浓度及提取时间对紫薯色素提取效果的影响较小,综合考虑资源的合理利用以及节能环保,结合单因素实验结果,确定紫薯色素的最佳提取条件为:赖氨酸磷酸盐水溶液浓度2.0%、料液比1∶10(g∶mL)、提取温度40 ℃、提取时间20 min。

表2 正交实验结果与分析Tab.2 Results and analysis of orthogonal experiment
2.4 验证实验及对比实验
在最佳提取条件下进行紫薯色素提取的3平行验证实验,吸光度分别为0.466、0.443、0.457,平均值为0.455,RSD=2.55%(n=3)。表明,赖氨酸磷酸盐水溶液在上述条件下提取紫薯色素是可行的。
将赖氨酸磷酸盐水溶液与3%柠檬酸水溶液进行提取紫薯色素的对比实验(调节提取液pH值一致)。结果表明,赖氨酸磷酸盐水溶液比3%柠檬酸水溶液的提取效果更好(后者吸光度为0.423)。
3结论
制备了20种氨基酸离子液体,筛选出提取效果最好的赖氨酸磷酸盐型离子液体用于紫薯色素的提取,并考察了赖氨酸磷酸盐水溶液浓度、料液比、提取温度、提取时间对紫薯色素提取的影响,通过单因素实验和正交实验优化紫薯色素的提取工艺。结果表明,在赖氨酸磷酸盐水溶液浓度为2.0%、料液比为1∶10(g∶mL)、提取温度为40 ℃、提取时间为20 min时,紫薯色素的提取效果最好。在此最佳条件下的紫薯色素提取效果比3%柠檬酸水溶液的提取效果更好,可为氨基酸离子液体在天然产物提取中的应用提供参考。
参考文献:
[1]杜连启,李润丰,程浩,等.紫甘薯色素的提取工艺及其稳定性研究[J].中国调味品,2006,(6):46-50.
[2]赵宇瑛,张汉锋.花青素的研究现状及发展趋势[J].安徽农业科学,2005,33(5):904-905,907.
[3]梁华正,徐琼,廖夫生,等.番薯紫色素的提取、精制及稳定性的研究[J].广州食品工业科技,2004,20(3):32-34.
[4]刘学峰,石雷,郑文秀.紫番薯色素提取精制工艺的研究[J].中国食品添加剂,2009,(6):121-125.
[5]李万华,王小刚,范代娣.离子液体提取皂角刺白桦脂酸衍生物的研究[J].化学工程,2012,40(11):1-3.
[6]郭燕燕,尹卫平,刘普,等.离子液体提取分离鹿藿中异黄酮化合物[J].应用化学,2011,28(5):537-541.
[7]WELLS A S,COOMBE V T.On the freshwater ecotoxicity and biodegradation properties of some common inoic liquids[J].Organic Process Research & Development,2006,10(4):794-798.
[8]FUKUMOTO K,YOSHIZAWA M,OHNO H.Room temperature ionic liquids from 20 natural amino acids[J].Journal of the American Chemical Society,2005,127(8):2398-2399.
[9]TAO G H,HE L,SUN N,et al.New generation ionic liquids:Cations derived from amino acids[J].Chemical Communications(Cambridge,England),2005,36(50):3562-3564.
[10]梁升,纪欢欢,李露,等.氨基酸离子液体对壳聚糖溶解性能的影响[J].高分子材料科学与工程,2010,26(2):70-72.
[11]赵明泽,赵荣祥,李秀萍,等.氨基酸离子液体氧化-萃取脱硫工艺研究[J].石化技术与应用,2013,31(5):384-387.

10.3969/j.issn.1672-5425.2015.12.010
Research on Extraction of Pigment from Purple Sweet Potato by
L-Lysine Phosphate Aqueous Solution
LIU Wei,WANG Hua-ping,LI Xia,DONG Xin-rong
(College of Science,Hunan Agricultural University,Changsha 410128,China)
Abstract:Twenty kinds of amino acid ionic liquids were synthesized.And L-lysine phosphate ionic liquid was screened and used to extract pigment from purple sweet potato.The effect of concentration of L-lysine phosphate ionic liquid,solid-liquid ratio,extraction time and extraction temperature on extraction of pigment from purple sweet potato were investigated,respectively.The optimum conditions were obtained by single factor experiment and orthogonal experiment.Results indicated that,the extraction effect was the best when concentration of L-lysine phosphate ionic liquids was 2.0%,solid-liquid ratio was 1∶10(g∶mL),extraction temperature was 40 ℃ and extraction time was 20 min.
Keywords:amino acid ionic liquid;L-lysine phosphate;pigment from purple sweet potato;extraction
中图分类号:O 629.9TS 264.4
文献标识码:A
文章编号:1672-5425(2015)12-0042-05
doi:
作者简介:刘玮,女,湖北黄冈人,研究方向:天然产物,E-mail:271947552@qq.com;
通讯作者:董新荣,博士,教授,E-mail:xin rong108@126.com。
收稿日期:2015-08-14

