太平洋鳕仔鱼消化系统发育形态学和组织学观察
胡盼,宫雪,韩雨哲,姜志强,潘金露
(大连海洋大学农业部北方海水增养殖重点实验室,辽宁大连116023)
太平洋鳕Gadus macrocephalus又名大头鳕,隶属于鳕形目 Gadiformes、鳕科 Gadidae、鳕属 Gadus,系冷水性底层鱼类,主要分布于北太平洋以及中国的黄海和东海北部[1]。太平洋鳕是具有重要开发前景的优质鱼种,研究其仔鱼发育过程中消化系统结构和功能的变化,对于了解仔鱼期的营养水平和营养需求非常重要。目前,国内外已对金头鲷Sparus aurata、北美牙鲆Paralichthys californicus、细点牙鲷Dentex dentex、黄尾蛳Seriola lalandi、波纹短须石首鱼Umbrina cirrasa、盘丽鱼Symphysodon discus、星斑川鲽Platichthys stellatus、大菱鲆Scophthalmus maximus[2-9]等鱼类的仔鱼、稚鱼和幼鱼消化系统进行了研究,但关于太平洋鳕仔鱼消化系统组织学研究尚未见报道。本研究中,对太平洋鳕仔鱼消化系统的发育进行形态学和组织学研究,以期为太平洋鳕苗种的科学管理和营养饲料的合理选择提供理论依据。
1 材料与方法
1.1 材料
试验用太平洋鳕仔鱼取自大连海洋大学农业部北方海水增养殖重点实验室。
1.2 方法
1.2.1 样品的采集 成熟太平洋鳕亲鱼捕自大连市黑石礁海区,通过腹部挤压获得成熟卵和精子,干法人工授精获得受精卵,经人工孵化获得仔鱼。仔鱼培育期间,培育池水温为7.8~10.0℃,微充气,每日吸底换水一次,每次换水量为培育池容积的1/3。自6日龄开始投喂褶皱臂尾轮虫,密度为5~10 ind./mL;17日龄开始投喂卤虫,密度为0.5~2 ind./mL。褶皱臂尾轮虫、卤虫无节幼体投喂前均用加有强化剂AlgaMac-3080的小球藻液培养12 h,强化剂浓度为0.2 g/L。培育期间,每日投喂前取样,以减少食物对样本的影响。1~10日龄 (孵化当天为0日龄,第2天为1日龄,以此类推)每天连续取样,11~50日龄隔天取样。
1.2.2 样品的处理 样品用波恩氏 (Bouin)液固定24 h,用体积分数为70%的乙醇洗涤直到溶液不呈黄色为止,然后经琼脂包埋和常规石蜡包埋,再进行横向、纵向和水平的连续切片 (厚度为4~6 μm),H.E染色,用中性树胶封片,在 Nikon Eslipse 50i显微镜下观察,并用Nikon Coolpix 5400数码相机照相。
2 结果与分析
2.1 太平洋鳕仔鱼消化系统发育形态学观察
1日龄仔鱼,鱼体前部靠近腹部有一椭球形卵黄囊,在卵黄囊斜上方可见一圆团状肝脏原基。鱼体体表覆有少量点状色素。脊索位于鱼体中央,粗且直,肌节呈“V”型。鳍膜覆盖于鱼体背部、腹部和尾部,并出现胸鳍原基。消化道为一未分化的直形盲管,紧贴于脊索的下方和卵黄囊的背面,仅见后端膨大,口腔未开启。消化道末端可见一椭圆形膀胱 (图1-A)。
2日龄仔鱼,卵黄囊逐渐缩小,鱼体体表色素变深,斑状面积变大。消化道整体略变粗,其后部与腹壁相交处有大量黑色素沉淀,且后端缢缩,将消化道分为两段,前段为长条形,后段为椭球形。口和肛门未见分化 (图1-B)。
3日龄仔鱼,头骨有所分化,呈隆起状。口裂形成,下颌能够缓慢活动,但不能摄食。消化道整体变粗,内壁增厚,但肛门仍未通。肝脏体积变大,进一步分叶,结构复杂化。消化道前部1/4处出现缢缩,末端翘起与鱼体约呈45°角 (图1-C)。
6日龄仔鱼,卵黄囊显著缩小,口裂继续增大,下颌骨长度长于上颌骨,可张合。消化道内壁继续增厚,褶皱增多,前肠部分明显膨大,肛门开口于体外,消化道中后部出现少量橘红色内含物,推测仔鱼开始摄食外源性食物 (图1-D)。
12日龄仔鱼,卵黄囊几近消失,营外源性营养,主动摄食能力增强。仔鱼鳔圆球状,但未充气。消化道黑色素加深,面积增大,肠后部出现一个弯折,消化器官分化明显,大量摄食(图1-E)。
16日龄仔鱼,身体各组织器官迅速发育,肠前部出现第二个弯折,胃肠蠕动能力增强,个别个体开始摄食卤虫无节幼体。消化道上方和头部上方覆盖有较深的色素细胞群,身体开始聚集黄色色素,尤以头部黄色色素聚集较多,鱼体开始变得不透明。背、腹鳍膜逐渐变窄,胸鳍明显分化,呈扇形。鳔内开始充气,体积逐渐增大。可见鳃耙,但无鳃丝 (图1-F)。
30日龄仔鱼,肝脏体积增加,消化道明显可见弯折,且消化道几乎不透明,被食物填充。鳔被拉长,体积继续增大。鳃耙和鳃盖骨明显和鱼体分开,鳃丝粗且明显 (图1-G)。
47日龄仔鱼,肠道呈螺旋状,内脏器官基本发育完全,与成鱼近似 (图1-H)。
2.2 太平洋鳕仔鱼消化系统组织学观察
2日龄仔鱼,消化器官处于尚未分化的状态。食道细短,与其他部分分界不明显。肠道位于鱼体腹部卵黄囊上方,为一简单的直形盲管,细胞为单层柱状细胞,排列紧密,管腔狭窄。胃未分化,与肠和食道没有明显的分界。口咽腔尚未打开,肛门尚未与外界相通。肝脏和胰脏位于卵黄囊与消化道之间,为分化不明显的致密细胞团 (图2-A)。
4日龄仔鱼,卵黄囊逐渐消耗变小,口裂增大,口咽腔与外界相通,但不具备摄食功能。食管腔已经扩大,管壁增厚,表面较光滑,肠壁黏膜上皮细胞为紧密排列的单层矮柱状细胞,黏膜层较发达,后端与胃的分界明显。肠道分为前后两段,前段为长条形,后段为球形,但肛门仍未通。肝脏和胰脏分化明显,肝细胞为多边形或圆形,细胞质均匀,核大而居中,核仁清晰。胰细胞团染色较深(图2-B~D)。
9日龄仔鱼,食道管壁黏膜上皮由复层扁平细胞构成,肌肉层较薄。肠道缺乏固有膜和黏膜下层,黏膜层中可见少量黏液细胞间插其中。肝细胞索出现,界限分明,单层肝细胞索相互连接成网状。胰腺已多处分布,开口于前肠 (图2-E~H)。
16日龄仔鱼,食道出现明显褶皱,食道前部杯状细胞增多。肠道褶皱明显,肠壁肠绒毛增多,黏膜上皮中的杯状细胞也增多。肝细胞为均匀的胞质,因储存营养物质的增加,肝细胞出现明显的空泡,将肝细胞的细胞质和细胞核挤到了细胞的周围,靠近细胞壁。胰腺体积更大,结构更加完善(图2-I~L)。
23~30日龄仔鱼,食道上皮褶皱及杯状细胞进一步增加,并散布于食道前中部。中肠及后肠部分黏膜褶皱数量明显增加,肠黏膜上皮中杯状细胞也明显增多,黏膜下层的结缔组织进一步发育。肝脏体积进一步增大,窦状隙逐渐增多,空泡化程度加深,肝脏结构基本与成鱼相似 (图2-M~T)。
3 讨论
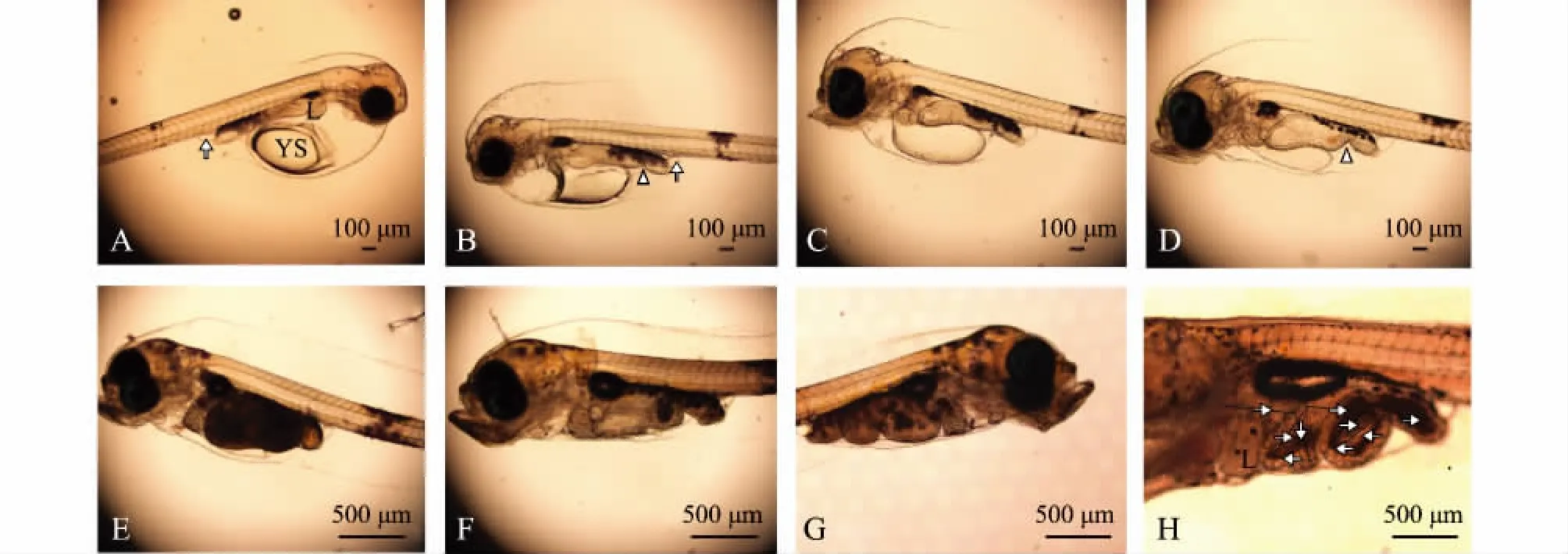
图1 太平洋鳕仔鱼消化系统发育形态学Fig.1 Morphological development of digestive system in larvae of Pacific cod Gadus macrocephalus
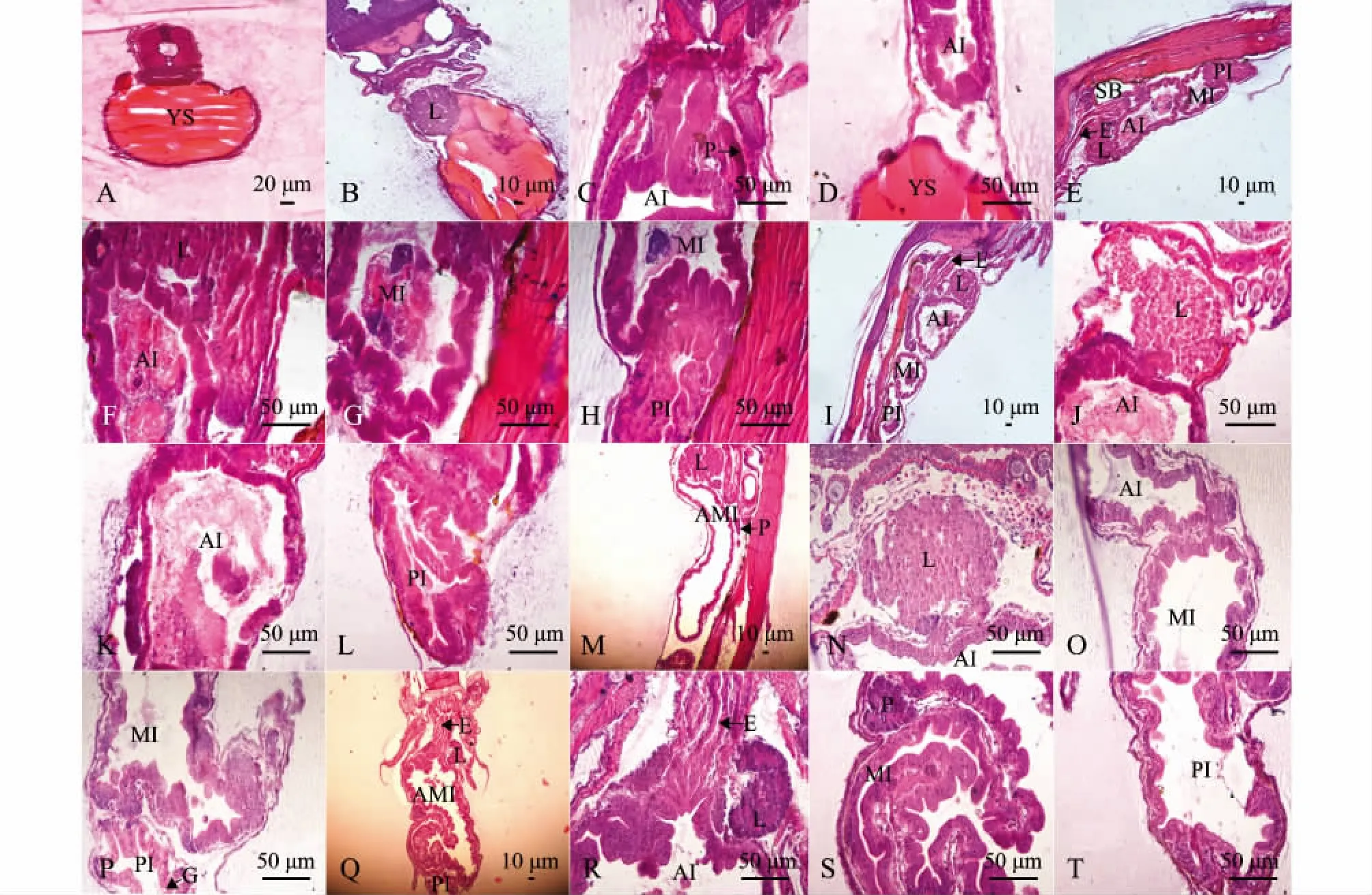
图2 太平洋鳕仔鱼消化系统组织学Fig.2 Histological development of digestive system in larvae of Pacific cod Gadus macrocephalus
太平洋鳕消化系统的发育与北美牙鲆[3]、半滑舌 鳎 Cynoglossus semilaevis Gunther[10]、星 斑 川鲽[8]等鱼类消化系统的发育相似,主要分为3个时期:卵黄期、混合营养期和外源性营养期。关于鱼类消化系统发育与卵黄吸收的关系研究报道较少。关海红等[11]认为,哲罗鱼Hucho taimen与大麻哈鱼Oncorhynchus keta都是通过血液循环及早期消化管进行吸收,怀头鲶Silurus soldatoui、鲶S.asotus是通过血液循环进行吸收,只是位置上稍有不同。陈细香[12]对大鳍鳠 Mystus macropterus Bleeker肝脏、胰脏胚后发育的组织学进行了研究,根据大鳍鳠肝脏发育的形态结构、肝脏与卵黄囊的位置关系和血管联系等特征,得出肝脏参与卵黄物质吸收与转运的结论。本研究中发现,太平洋鳕仔鱼的肝脏附着于卵黄囊上,推测太平洋鳕仔鱼卵黄的吸收和转运与肝脏有关。对太平洋鳕仔鱼的形态学和组织学观察发现,太平洋鳕在6日龄时,上下颌可张合,肠道内出现内含物。随着日龄的增加,卵黄囊被逐渐吸收,日渐萎缩,到12日龄时卵黄囊全部消失。李艳秋等[13]对太平洋鳕仔鱼卵黄囊体积进行测定,所得结果与本研究结果类似。因此,卵黄期是从初孵到5日龄,该阶段主要靠卵黄囊提供营养,消化系统虽能较快分化,但不能开口摄食。混合营养期为6~11日龄,是仔鱼由内源性营养向外源性营养的过渡期。该期消化系统的结构已基本发育完全,包括口咽腔、食道、胃、肠道 (前中肠和后肠)和肛门,消化腺分化明显。仔鱼在混合营养期由于食性转变,对养殖环境要求非常苛刻,选择适口的饵料是提高其成活率的重要措施。12日龄后,仔鱼完全进入外源性营养期。该过程与大西洋鳕Gadus morhua早期消化系统的发育过程[14]极为相似。
鱼类早期发育过程中,口与肛门的形成及其与外界环境相通是仔鱼即将开口摄食的重要标志。在不同鱼类中,这一过程出现的时间与顺序也不一致。仔鱼开口时间与鱼类的遗传特性和水温之间存在密切的关系。大西洋鳕在7℃培育水温下,5日龄仔鱼即开口摄食[15],略早于太平洋鳕。太平洋鳕口咽腔和食道都是接收和输送食物的腔隙管道,其上皮的结构和功能相似,均是复层扁平上皮,耐摩擦阻异物。加之上皮有较多褶皱和杯状细胞(黏液细胞),可起到缓冲作用并分泌黏液润滑食物,Murray等[16]还推测杯状细胞可能有胃前消化功能。
根据Govoni等[17]对几种硬骨鱼类脂类吸收观察和食性转换的分析,大多数海水硬骨鱼类在仔鱼阶段并不存在真正意义上胃的结构。太平洋鳕也是如此,尽管在消化道分化之后,形成了两段的结构,但是前段 (前肠和中肠)膨大的长条形管腔主要用来容纳和初步消化食物,没有观察到类似于胃腺或杯状细胞样的结构。从消化道壁的组织结构来看,也不具备完整的胃结构,但肠道前段收缩和蠕动能力比后段 (后肠)球形部分要强很多。太平洋鳕早期仔鱼 (9日龄)肠道由单层柱状上皮细胞组成,缺乏固有膜和黏膜下层,肌层也仅在食道附近可以观察到,只是完成了消化系统的基本构造,消化器官并未发育完全。12日龄后,肠壁黏膜层加厚,绒毛、褶皱和杯状细胞增多,这些都具有辅助运输、消化和吸收功能。
外分泌腺肝脏和胰腺在太平洋鳕仔鱼摄食外源性食物之前就已经形成,在消化系统中扮演着重要角色。肝脏分泌胆汁,在胆囊浓缩后通过胆管进入前肠,将脂肪乳化为食糜颗粒。胰腺中合成未激活的酶原颗粒,可经胰管分泌进入前肠起作用。肝细胞中细胞质较均一,随着仔鱼的生长及食物的摄入,肝细胞逐渐空泡化,这是肝细胞中储存了大量肝糖原的缘故[9,18],并且从11日龄到25日龄,肝脏体积增大了4倍。太平洋鳕在1日龄时,在中肠前部即可观察到胰腺,并且沿着中肠两侧向后延伸,随着肠道旋转,胰腺被拉长;25日龄时胰脏体积是11日龄的4倍;53日龄时胰脏体积是39日龄的6倍。1~39日龄时,胰腺为一个整体,53日龄时,胰脏呈弥散状分布,共分8部分。随着外分泌腺的快速发育,太平洋鳕的消化系统趋于完善,增强了对食物的消化和吸收,提高了太平洋鳕仔鱼的适应能力。真骨鱼类的肝脏一般发育较早,在太平洋鳕的初孵仔鱼中就能观察到。鱼类胰腺的分布较复杂,尾崎久雄[19]将硬骨鱼类胰腺分为三种类型,即紧凑型、弥散型和散布型。太平洋鳕的胰腺为紧凑型,与其凶猛的肉食性摄食习性相符。
太平洋鳕从开口到仔鱼进行食性转换,不仅消化系统结构发生了改变,还伴随着相应的细胞结构、激素水平和消化酶的变化,甚至分泌消化酶所需要的细胞内生化反应也发生了一系列变化[20-21]。随着科技的进步,对鱼类消化道组织结构的研究,已从形态学解剖向显微结构、亚显微结构深入,从描述性研究向数量化发展。目前,可以通过RTPCR技术在大西洋鳕和黑线鳕Melanogrammus aeglefinus食性转化时,及时检测出细胞内相应的RNA的变化[22],可进一步判断仔鱼消化系统的发育水平,从而更准确地判断仔鱼食性转换的时机。
根据太平洋鳕仔鱼消化系统的发育特征,在人工育苗过程中,可根据不同发育阶段选择适口饵料,把握好投喂时机,确保仔鱼有足够的营养。这样既可以提高仔鱼成活率,又可以节约育苗成本。本研究中,从形态学和组织学角度对太平洋鳕仔鱼消化系统进行了研究,其结果对太平洋鳕的苗种培育和其营养饲料的选择,都具有重要的指导意义。
[1]苏锦祥.鱼类学与海水鱼类养殖[M].北京:中国农业出版社,1993:194-195.
[2]Elbal M T,Garci'a Herna'ndez M P,Lozano M T,et al.Develop-ment of the digestive tract of gilthead seabream(Sparus aurata L.):light and electron microscopic studies[J].Aquaculture,2004,234(1):215-238.
[3]Gisbert E,Piedrahita R H.Ontogenetic development of the digestive system in California halibut(Paralichthys californicus)with notes on feeding practices[J].Aquaculture,2004,232(1/4):455-470.
[4]Santamaria C A,Marin de Mateo M,Traveset R,et al.Larval organogenesis in common dentex Dentex dentex L.(Sparidae):histological and histochemical aspects[J].Aquaculture,2004,237(1/4):207-228.
[5]Chen B N,Qin J G,Kumar M S,et al.Ontogenetic development of the digestive system in yellowtail kingfish Seriola lalandi larvae[J].Aquaculture,2006,256(1):489-501.
[6]Zaiss M M,Papadakis I E,Maingot E,et al.Ontogeny of the digestive tract in shi drum(Umbrina cirrosa L.)reared using the mesocosm larval rearing system[J].Aquaculture,2006,260(1):357-368.
[7]童永.盘丽鱼胚胎发育、仔鱼消化道组织学及消化酶活性的研究[D].武汉:华中农业大学,2007:1-7.
[8]方华华,王波.星斑川鲽仔稚鱼消化系统发育的组织学研究[J].中国农学通报,2011,27(14):50-54.
[9]陈慕雁,张秀梅.大菱鲆仔稚幼鱼消化系统发育的组织学研究[J].水生生物学报,2006,30(2):236-240.
[10]常青,陈四清,张秀梅,等.半滑舌鳎消化系统器官发生的组织学[J].水产学报,2005,29(4):447-452.
[11]关海红,尹家胜.鱼类卵黄吸收方式及器官形成的比较[J].华中农业大学学报,2012,31(5):641-644.
[12]陈细香.大鳍鳠肝脏、胰脏胚后发育的组织学研究[J].泉州师范学院学报,2002,20(2):84-94.
[13]李艳秋,姜志强,孙阳,等.太平洋鳕仔鱼饥饿实验及不可逆生长点的确定[J].生态学报,2014,34(14):3873-3878.
[14]Meeren T.Algae as first food for cod larvae,Gadus morhua L.:filter feeding or ingestion by accident[J].Journal of Fish Biology,1991,39(2):225-237.
[15]Kjørsvik E,Meeren T V D,Kryvi H,et al.Early development of the digestive tract of cod larvae,Gadus morhua L.,during startfeeding and starvation[J].Journal of Fish Biology,1991,38(1):1-15.
[16]Murray H M,Wright G M,Goff G P.A study of the posterior esophagus in the winter flounder,Pleuronects americanus,and the yellowtail flounder,Pleuronects ferruginea:morphological evidence for pregastric digestion[J].Canadian Journal of Zoology,1994,72(7):1191-1198.
[17]Govoni J J,Boehlert G W,Watanabe Y.The physiology of digestion in fish larvae[J].Environmental Biology of Fishes,1986,16(1/3):59-77.
[18]Bisbal G A,Bengtson D A.Development of the digestive tract in larval summer flounder[J].Journal of Fish Biology,1995,47(2):277-291.
[19]尾琦久雄.鱼类消化生理:上册[M].上海:上海科学技术出版社,1983:304-306.
[20]Iwai T.The comparative study of the digestive tract of teleost larvae:I.fine structure of the gut epithelium in larvae of ayu[J].Bulletin of the Japanese Society of Scientific Fisheries,1967,33(6):489-496.
[21]Iwai T,Tanaka M.The comparative study of the digestive tract of teleost larvae:IV.absorption of fat by the gut of halfbeak larvae[J].Bulletin of the Japanese Society of Scientific Fisheries,1968,34:871-875.
[22]Perez-Casanova J C,Murray H M,Gallant J W,et al.Development of the digestive capacity in larvae of haddock(Melanogrammus aeglefinus)and Atlantic cod(Gadus morhua)[J].Aquaculture,2006,251(2):377-401.

