温度诱导及药物处理对吉富罗非鱼雄性率及生长发育的影响
谭芸,朱佳杰,周宇,刘溪,沈夏霜,罗永巨,甘西
(广西壮族自治区水产科学研究院广西水产遗传育种与健康养殖重点实验室,广西南宁530021)
吉富罗非鱼GIFT Oreochromis niloticus具有生长快、规格齐、体形好、出肉率高、适应性强等优点,是中国目前罗非鱼养殖的主导品种[1]。罗非鱼雄鱼的生长速度比雌鱼快40%~50%,在适宜的水温下,雌性罗非鱼每隔12~15 d可繁殖一次,很容易造成池塘养殖密度过大,影响成鱼的规格和养殖效益[2]。因此,开展罗非鱼性别控制研究,实现罗非鱼苗种单性养殖具有重要的意义。
目前,罗非鱼苗种性别人工调控的方法主要有种间杂交法[3]、激素投喂法[4]和超雄鱼三系配套法[5]。种间杂交法主要是采用奥利亚罗非鱼Oreochromis aureus作父本与尼罗罗非鱼 Oreochromis niloticus作母本进行杂交,后代理论上均是雄鱼,但受亲本纯度和环境因素的影响,杂交后代的雄性率常在70%~95%,且其受精率、孵化率和杂交后代的均匀度均比自交苗低。激素投喂法是在罗非鱼鱼苗发育早期在饵料中添加一定剂量的雄性激素,使雌性鱼苗发生性逆转为雄鱼的方法,因涉及到药物残留及食品质量安全问题,越来越被引起关注。超雄鱼三系配套法因受限于YY超雄鱼的制种及分子鉴别技术,从而影响了其推广[6]。通过改变孵化环境温度来控制动物的性别在研究爬行动物方面已得到广泛应用,在水产动物中对银汉鱼和牙鲆的研究也有相关报道[7-8]。因此,如果能通过改变孵化环境的温度,提高罗非鱼仔鱼的雄性率将有望解决上述难题。本研究中,在前期开展温度诱导吉富罗非鱼性别比率研究的基础上,对比了36℃水温诱导与甲基睾酮激素投喂对吉富罗非鱼鱼苗雄性率和生长发育的影响,旨在为吉富罗非鱼苗种生产提供技术指导。
1 材料与方法
1.1 材料
试验于2012年5—10月在广西水产科学研究院国家级广西南宁罗非鱼良种场进行。试验用亲鱼由国家级广西南宁罗非鱼良种场提供,在网箱中雌雄按1∶1配对,定期检查雌鱼口,如含受精卵时取出移至孵化箱进行人工孵化,受精卵孵化至卵黄苗阶段时运回水族控温实验室开展相关试验。
甲基睾酮药物购自天津力生制药股份有限公司,用酒精充分溶解后拌入饵料中投喂。
1.2 方法
1.2.1 试验设计 将同一家系的受精卵随机分成5组,分别记为 A、B、C、D、E(对照),每组100粒,每组设3个平行。其中,A组为36℃高温持续诱导10 d;B组为30℃下投喂甲基睾酮10 d;C组为30℃下投喂甲基睾酮20 d;D组为36℃温度诱导+甲基睾酮投喂10 d,E组 (对照)为30℃正常组。比较不同处理方式对仔鱼雄性率的影响。
1.2.2 水温调控 试验用控温系统为室内循环流水式系统,能准确控制温度 (误差为±0.1℃)。具体升温过程及温度诱导期间的日常投喂管理详见朱佳杰等[9]的方法。
1.2.3 药物投喂 将甲基睾酮 (MT)由颗粒状先碾磨成粉状,用体积分数为98%的酒精充分溶解,再用纯净水稀释掺入饵料 (50%鳗料+50%罗非鱼粉料)中,将饵料中甲基睾酮的浓度调整到0.6 μg/g(饵料),反复搓合饵料,使药物均匀拌合在饵料中,室内晾干后即可投喂。每天定时投喂4次(8:00、12:00、16:00、22:00),投喂量以吃饱不剩为佳,投饵后半小时将剩余饵料吸出。
1.2.4 鱼苗培育 试验结束后,将鱼苗转移至国家级广西南宁罗非鱼良种场的池塘中培育。鱼苗均在同一个池塘不同编号的网箱中继续培育120 d,网箱 (2.0 m×2.0 m×1.5 m)规格为9目,养殖至规格为50~60 g时,可通过体表生殖孔数量鉴定其性别。
1.2.5 性别比率检测
(1)体表生殖孔观察法。吉富罗非鱼雌雄分辨主要通过观察鱼腹部的生殖孔数量,具体详见李莉萍等[10]的方法。
(2)性腺组织切片检测。在罗非鱼规格较小时,通过生殖孔观测其性别的准确率较低,而取其性腺采用组织压片法能准确判断它的性别,组织切片制作方法详见陈兴汉[11]的方法。
1.2.6 生长速度测定 将诱导结束后每组鱼苗的体质量以及鱼苗培养120 d后的体质量进行测定,计算出每组鱼的生长速度。
1.3 数据处理
用Excel软件统计各组的平均雄性率、平均存活率及其标准差,试验数据均以平均值±标准差(mean±S.D.)表示。用SPSS 17.0软件进行单因素方差分析 (ANOVA),用Duncan多重比较法检验各组间幼鱼存活率和雄性率的差异性,显著性水平设为 0.05。
2 结果与分析
2.1 不同处理方式对吉富罗非鱼雄性率的影响
将试验组及对照组鱼经不同方式处理后的鱼苗培育至60 g左右时,进行雌雄性别鉴定。从表1可见,经过36℃温度诱导和在饵料中添加甲基睾酮均能显著提高鱼苗的雄性率。各组的雄性率大小依次为C组>D组>A组>B组>E组 (对照),其中A、C、D组之间无显著性差异 (P>0.05),但3个组均与B组和对照组有显著性差异 (P<0.05)。各组间的平均存活率无显著性差异 (P>0.05)。以上结果说明,36℃温度诱导10 d的雄性率已接近投喂含甲基睾酮饵料20 d的效果。

表1 不同处理方式对吉富罗非鱼鱼苗雄性率及存活率的影响Tab.1 Effects of different treatments on survival and male rate of larval GIFT tilapia
2.2 不同处理方式对吉富罗非鱼生长速度的影响
将温度诱导及投喂甲基睾酮试验结束后的鱼苗放在同一个池塘的不同网箱中养殖,每个组分别放在同一个网箱内。经过120 d的养殖,各组的试验终末体质量及日均增重见表2。从表2可以看出,各组的平均日增重大小依次为C组>D组>A组>B组>E(对照),其中C组的生长速度最快,平均日增重达到了5.42 g/d,对照组的生长速度最慢,平均日增重为4.69 g/d,除B组外,其他试验组平均日增重与对照组有显著性差异 (P<0.05)。
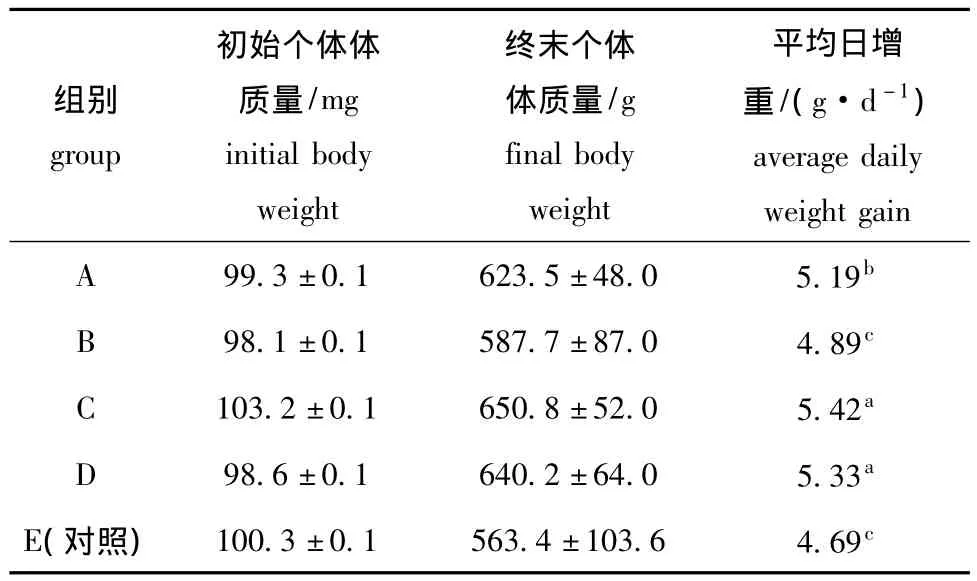
表2 不同处理方式对吉富罗非鱼鱼苗生长的影响Tab.2 Effects of different treatments on growth of the GIFT tilapia
2.3 温度对吉富罗非鱼性腺发育的影响
将不同方式处理后的鱼苗转到水温为27~32℃的池塘网箱中养殖至性成熟,分别取雌雄鱼的性腺组织做切片,观察性腺的发育情况 (图1)。结果显示:温度处理组 (36℃组和36℃+甲基睾酮组)的鱼都得到了偏向于雄性的比率,精巢组织包含有较多精子 (图1-B),而对照组 (30℃)精巢还是精原细胞 (图1-A);对温度处理组的雌鱼生殖孔检查发现,大部分雌鱼具有两性特征,生殖孔闭合非常紧,无法正常排卵,解剖后发现,性腺组织中的卵母细胞数量较对照组少 (图1-C、D)。初步推断,可能是在性腺分化时期持续的高温诱导破坏了垂体性腺轴的激素分泌,并抑制了生殖细胞的发育所致。
3 讨论
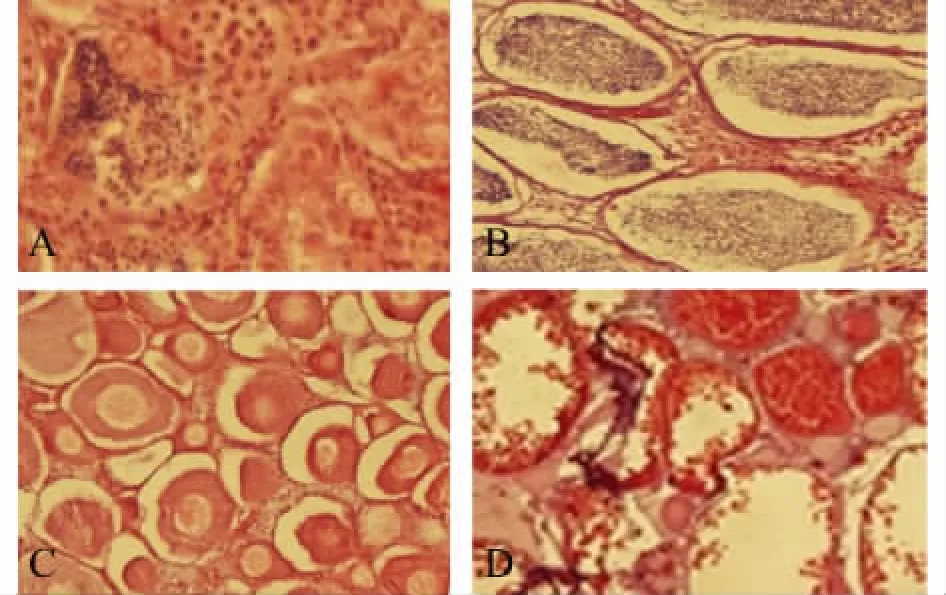
图1 吉富罗非鱼发育成熟后性腺组织学横切切片(100×)Fig.1 Transverse section of gonads in mature GIFT tilapia(100×)
罗非鱼的性别决定机制很复杂,受到遗传和环境因素的共同调控。已有研究表明,罗非鱼的性别分化存在一个临界敏感期,在性别分化开始之前或分化期给予一定的环境压力刺激,则可以改变其群体的性别比率[12-13]。在饵料中添加雄性激素是已往提高罗非鱼雄性率的常用方法,而通过改变孵化水温来提高鱼苗雄性率的方法,因其安全有效,已被大多数研究者所青睐。Baroiller等[14]、Desprez等[15]先后在对尼罗罗非鱼、奥利亚罗非鱼的研究中发现,通过提高孵化水温能显著提高群体的雄性比率,但不同品种罗非鱼的临界温度是不一样的。朱佳杰等[16]研究发现,吉富罗非鱼的性腺分化属于温度依赖性决定类型,在胚胎发育早期,孵化水温对其性别分化存在着很大的影响,在36℃水温中连续诱导10 d能显著提高鱼苗的雄性率。本研究中,在前期研究不同温度诱导吉富罗非鱼雄性率的基础上,比较了36℃水温诱导和用甲基睾酮投喂不同时间时的雄性率效果。结果表明,36℃连续诱导10 d的雄性率与用甲基睾酮投喂20 d的效果相近,36℃水温诱导并同时饲喂相同剂量的甲基睾酮得到的雄性率与36℃诱导的效果无显著性差异。说明控制好诱导的水温及处理时间确实能够有效提高鱼苗的雄性率,这与Baroiller等[14]研究温度诱导尼罗罗非鱼鱼苗的雄性率结果相似。温度诱导提高雄性率的主要机理是高温诱导破坏了罗非鱼性别分化的正常发育过程,通过提高环境温度促使吉富罗非鱼芳香化酶mRNA表达量降低,导致雌二醇分泌减少,从而导致性腺向雄性转化[17]。
吉富罗非鱼的生长与雄性率存在紧密的关系。本研究中,对温度诱导及用甲基睾酮处理后的鱼苗生长跟踪发现,36℃处理10 d组的生长速度要显著优于药物处理组,且雌雄个体间的规格相对较均匀,这主要是高雄性率所致。对各组鱼的性腺组织切片观察发现,经过36℃温度诱导后,雌鱼的性腺发育不完全,生殖孔紧闭不能够排卵,属于不育鱼。这主要是在性腺分化关键时期持续高温诱导后使性腺轴激素分泌失调,造成生殖细胞发育不完全所致。本研究中对比了温度诱导及药物处理对吉富罗非鱼雄性率的影响,研究结果可为今后利用地源热泵技术及太阳能技术调控孵化水温,大规模生产高雄性率罗非鱼商品苗种提供了技术支撑。但罗非鱼有多个品种,不同品种间的性逆转最佳敏感期及敏感温度还有待进一步研究。
[1]朱佳杰,李莉萍,唐瞻杨,等.吉富罗非鱼家系构建及抗病力检测[J].南方水产科学,2012,8(6):22-27.
[2]朱佳杰,林勇,李莉萍,等.吉富罗非鱼雌雄群体遗传差异的SSR 分析[J].基因组学与应用生物学,2010,29(1):57-62.
[3]杨景峰,曹颖霞.罗非鱼的性别控制技术及发展趋势[J].水产养殖,2003(6):26-28.
[4]李家乐,李思发,韩风进,等.甲基睾丸酮诱导吉富品系尼罗罗非鱼雄性化的研究[J].水产学报,1997,21(12):107-110.
[5]杨永铨,张中英,林克宏,等.应用三系配套途径产生遗传上全雄莫桑比克罗非鱼[J].遗传学报,1980(3):43-48.
[6]陈松林.鱼类性别控制与细胞工程育种[M].北京:科学出版社,2013:401-409.
[7]Conover D O,Kynard B E.Environmental sex determination:interaction of temperature and genotype in a fish[J].Science,1982,213:577-579.
[8]邓思平,陈松林,田永胜,等.半滑舌鳎的性腺分化和温度对性别决定的影响[J].中国水产科学,2007,14(5):714-719.
[9]朱佳杰,林勇,陈忠,等.不同温度诱导对吉富罗非鱼仔鱼生长与发育的影响[J].华北农学报,2010,25(S1):170-173.
[10]李莉萍,林勇,朱佳杰,等.不同浓度药物与不同天数鱼苗对吉富罗非鱼雌性诱导效果的影响[J].安徽农业科学,2011,39(6):3627-3629.
[11]陈兴汉.尼罗罗非鱼仔鱼生长发育和温度调控与雄激素诱导雄性化的研究[D].广州:中山大学,2005:23-26.
[12]Avtalion R R,Hammerman I H.Sex determination in Sarotherodon(tilapia):I.introduction to a theory of autosomal influence[J].Bamidgeh,1978,30:110-115.
[13]Abucay J S,Mair G C,Skibinski D O,et al.Environmental sex determination:the effect of temperature and salinity on sex ratio in Oreochromis niloticus L.[J].Aquaculture,1999,173(1/4):219-234.
[14]Baroiller J F,Chourrout D,Fostier A,et al.Temperature and sex chromosomes govern sex ratios of the mouthbrooding cichlid fish Oreochromis niloticus[J].J Exp Zool,1995,273:216-223.
[15]Desprez D,Melard C.Effect of ambient water temperature on sex determinism in the blue tilapia,Oreochromis aureus[J].Aquaculture,1998,162(1/2):79-84.
[16]朱佳杰,李莉萍,甘西,等.温度诱导对吉富罗非鱼雄性率的影响[J].安徽农业科学,2012,40(2):830-831.
[17]岳敏娟,尤永隆,林丹军.温度对鲫鱼性腺分化的影响[J].动物学杂志,2009,44(1):9-16.

