某院447种药品标签及说明书的调查分析
余虹
(重庆医药高等专科学校药学院,重庆 401331)
某院447种药品标签及说明书的调查分析
余虹
(重庆医药高等专科学校药学院,重庆 401331)
目的:规范管理药品标签与说明书,确保患者用药的安全合理。方法:按照《药品说明书和标签管理规定》及其配套文件逐项调查某医院 447种常用药品标签和说明书。结果:药品标签和说明书存在缺项,项目内容未按规定标示,字体不规范、印字脱落,未按规定要求排版,标签内容与说明书不一致等5类主要问题。结论:药品标签和说明书相关法规文件的执行有待加强,药品生产企业需进一步严格规范药品标签和说明书的撰写并不断完善,药监部门要将其作为药品法制管理的重要内容加以规范,医疗机构、经营企业发现问题要加强与药监部门及生产企业的沟通。
标签;说明书;规范
药品标签和说明书作为药品信息的重要来源,是用于指导临床正确使用药品的技术性资料,是医师开具处方、药师调配、护理人员给药、患者服药的重要依据,具有技术和法律层面的意义[1]。2006年起,国家食品药品监督管理总局先后颁布了一系列相关法规,以进一步加强和规范药品包装标签和说明书管理。然而,这些法规是否得到有效的实施?企业是否按照规定进行药品标签和说明书的书写?本研究调查分析了某医院常用的药品标签及说明书的内容,旨在为规范我国药品标签和说明书管理提供参考。
1 资料及方法
收集某医院常用药品的最小销售包装标签及说明书。入选条件:同一企业生产的同一品种只入选 1次;同一企业生产的不同品种各自入选;相同名称的不同剂型各自入选。符合入选条件的药品标签和说明书共 447份,其中化学处方药 93份、中成药处方药 77份、化学非处方药(OTC)117份、中药 OTC 160份。将收集的药品标签、说明书与国家食品药品监督管理总局 2006年 3月15日颁布的《药品说明书和标签管理规定》及随后颁布的配套文件《关于印发非处方药说明书规范细则的通知》、《关于印发化学药品和生物制品说明书规范细则的通知》及《关于印发中药、天然药物处方药说明书格式内容书写要求及撰写指导原则的通知》进行比较,统计最小销售包装标签和说明书的合格情况[2-5]。
2 结果
2.1 药品标签的统计结果
将447份药品标签按相关法规逐项统计,结果见表1。所调查的药品标签主要存在以下5方面的问题。
2.1.1 项目缺失缺失最多的项目是“规格”(13份,占缺项包装份数的 56.5%)、其次为“不良反应”、“禁忌”和“功能主治”。缺失“不良反应”和“禁忌”的包装,也未按要求标明“详见说明书”的字样。
2.1.2 字体不规范、印字脱落包括注册商标、通用名、商品名的字体大小不符合规定;使用繁体字及印字模糊等情况。
2.1.3 项目内容未按规定标示体现在:有效期计算和书写格式的错误;“用法用量”表述含糊等。
2.1.4 未按规定要求排版如OTC标识、“注册商标”以及“通用名称”没有印在规定的位置。
2.1.5 标签内容与说明书不一致例如标签上所示的规格为“15%·10 g”,而说明书标示为“15%· 5 g”。
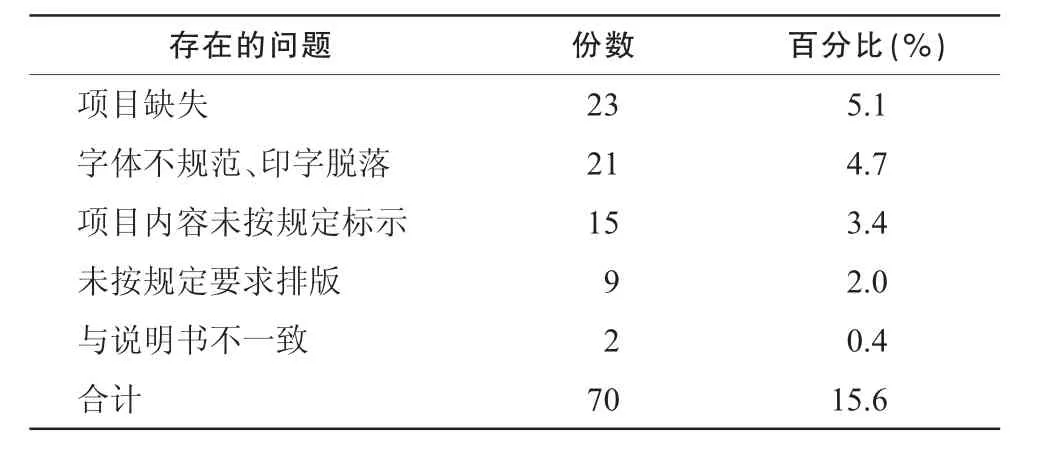
表1 药品标签的统计结果
2.2 药品说明书的统计结果
2.2.1 4类药品(化学处方药、中成药处方药、化学OTC、中成药OTC)说明书存在的共性问题如表2所示,4类药品说明书存在的共性问题有:规格表述含糊,如“复方”、“0.05%”;“用法用量”项下出现如“小儿酌减 ”等不科学的描述;有效期的标示错误,如“4年”;核准/修改(订)日期格式错误等。
2.2.2 处方药说明书存在的问题与化学处方药相比,中成药处方药说明书的问题较少。化学处方药说明书不符合规定的情形有:孕妇及哺乳期妇女用药、儿童用药、老年用药、药物过量、药物相互作用等项目出现“尚不明确”的表述;药理、毒理项下只有药理作用,而无毒理作用的介绍。
2.2.3 OTC说明书存在的问题OTC说明书中存在的问题有:“规格”没有使用中文汉字单位,如“10 mg”;“禁忌”和“不良反应”没有详尽表述;中成药的性状描述过于简单;排版和字体印刷有误:如“忠告语”、“外用标识”、“禁忌”及“如有问题可与生产企业联系”等排版的位置有误,并且字体没有加重印刷。
3 讨论
药品标签和说明书包含了药品的重要信息,错误的药品信息必将产生严重后果。药品的标签应当以说明书为依据。药品说明书的内容应当以国家食品药品监督管理总局核准或获准修改的为准,不得擅自增加或删改原批准的内容。通过此次调查,发现目前市场上药品标签和说明书仍然存在着不容忽视的问题。
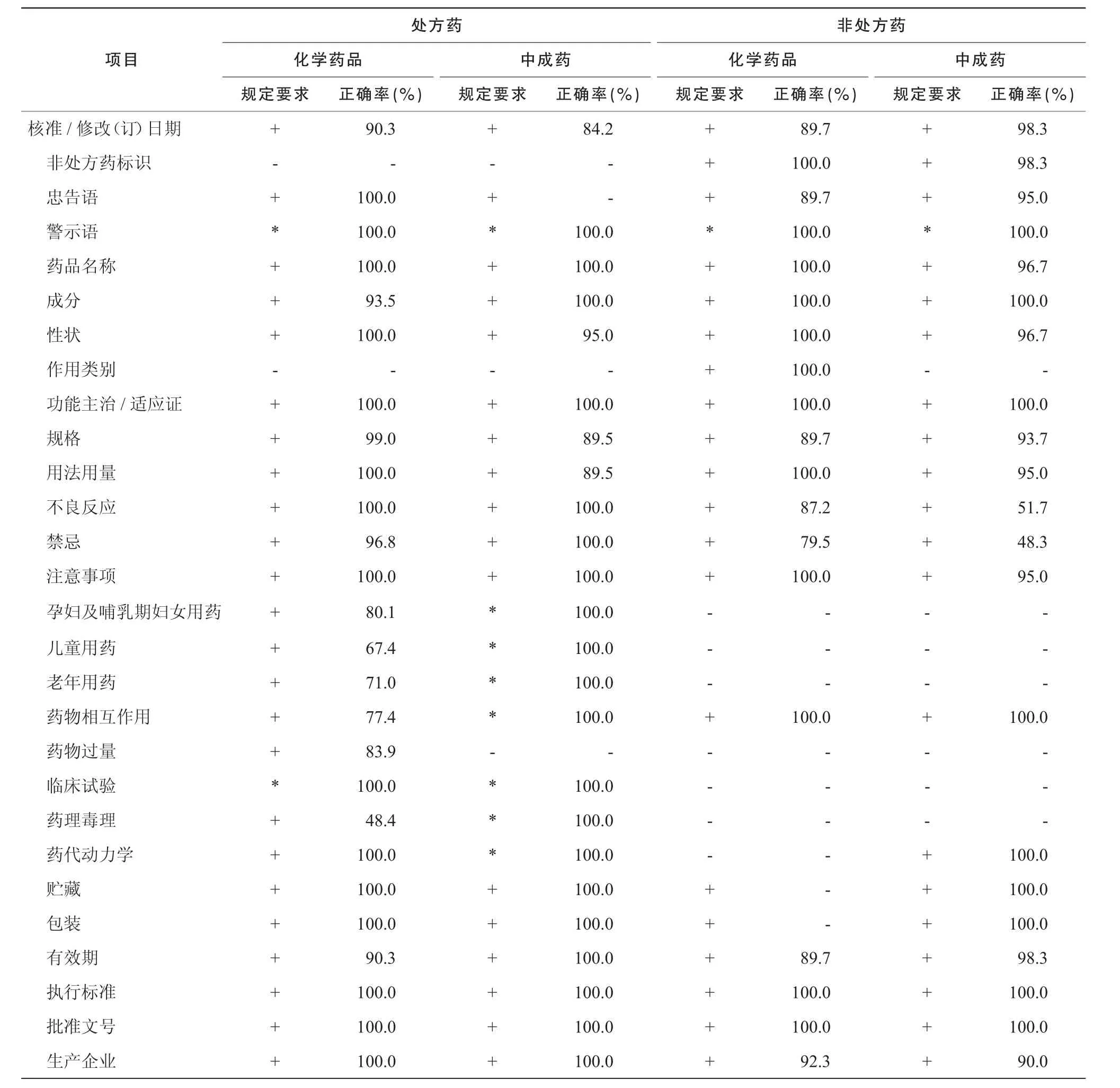
表2 药品说明书的统计结果
3.1 核准/修改(订)日期
这是说明书的必列项目,部分说明书缺失或书写不规范,如“2011年7月12日”,月份应该用两位数字表示。
3.2 忠告语
处方药的忠告语为:“请仔细阅读说明书并在医师指导下使用”;OTC为:“请仔细阅读说明书并按说明使用或在药师指导下购买和使用”。该内容必须标注,并印制在说明书标题下。对于OTC,还要求加重字体印刷。
3.3 药品名称
药品名称必须列出:通用名称和汉语拼音。调查发现,个别OTC说明书缺少汉语拼音;有将通用名称写成商品名的现象。
3.4 成分
药品说明书必须将主要活性成分名称列入此项。对于化学复方制剂,还要求成分按一个制剂单位分别列出其含量。所调查的说明书基本上都能按要求将主要成分和辅料的名称列入此项,但6.5%的化学复方制剂缺少含量的描述。如表 2所示,此次调查的中成药复方制剂较规范,都能按照相关规定进行表述。
3.5 性状
所调查的说明书中,中成药说明书的性状描述过于简单,应按颜色、外形、气、味依次规范描述。
3.6 规格
规格是药品最小单位中含有主药的质量、含量或装量。规格项目表述不规范是4类说明书普遍存在的问题,诸如“复方”或“0.05%”的含糊表述,有可能使消费者和医务工作者难以把握药物的用量。对于OTC,计量单位必须以中文汉字表示,如“10毫克”,而非“10 mg”。
3.7 用法用量
调查发现,10.5%的中成药处方药和5.0%的中成药OTC说明书的用法用量都不符合规定。最突出的问题为出现诸如“小儿或老年人酌减”等不科学的描述,使消费者无法遵循。药物在用法用量上有特殊要求的,应当按实际情况详细说明。对于OTC,可在“注意事项”项目下注明“儿童用量(或老年人用量)应咨询医师或药师”的字样。
3.8 禁忌
在此项下应列出该药品不能应用的各种情况,如禁止应用该药品的人群或疾病等情况。若为OTC,此项内容还必须采用加重字体印刷,以引起使用者的注意。调查发现,相对于化学药,中成药说明书不符合相关规定的情况更多,主要问题在于没用加重字体印刷。而某些加重字体印刷的说明书,此项内容也未见比其他内容更明显,没有很好地起到警示作用。建议药品生产企业在撰写说明书时,可以适当加大字体以示区别。
3.9 孕妇及哺乳期妇女用药、儿童用药、老年用药、药物过量
这4项是化学处方药必须要标注的。但结果显示,这4项存在的问题最多。如果企业确未进行该项实验且无可靠参考文献的,应当在该项下予以说明。不能不列出此项或表述为诸如“尚不明确”等语句。
3.10 药物相互作用
此项要说明与该药产生相互作用的药品或药品类别,并说明相互作用的结果及合并用药的注意事项。调查结果显示,有近23%的说明书没有列出此项。若企业未进行该项实验且无可靠参考文献的,应当在该项下予以说明。若为中药注射剂,此项必须以“尚无本品与其他药物相互作用的信息”来表述。对于OTC,还必须注明“如与其他药物同时使用可能会发生药物相互作用,详情请咨询医师或药师”的字样。
3.11 药理、毒理
52%的化学药品说明书此项下都只列有药理作用,而无毒理作用的介绍。一份合格的说明书应同时包括药理作用和毒理研究两部分内容。毒理研究应涉及与临床应用相关,有助于判断药物临床安全性的非临床毒理研究结果。如果企业未进行该项实验且参考文献不可靠的,应当在该项下予以说明。
3.12 有效期
药品的有效期是指药品在规定的储存条件下,能够保持质量稳定的期限。相关法规对于有效期在说明书和标签中的标注格式要求不一样。药品标签中的有效期应当按照年、月、日的顺序标注,年份用4位数字表示,月、日用2位数字表示。说明书中有效期以月为单位表述。调查发现,部分企业没有按照正确的格式进行标注,甚至将二者混淆。
3.13 生产企业
在生产企业项下,要依次列出:企业名称、生产地址、邮政编码、电话号码、传真号码等。但对于OTC的说明书,还必须在此项后标注“如有问题可与生产企业联系”,并加重字体印刷。结果显示,近8%的化学药OTC和10%的中成药OTC缺少此项。
3.14 药品电子监管码
药品电子监管码是国家对药品实施电子监管,为每件最小销售包装单位药品赋予的电子标识标签。企业通过电子监管系统上传信息,使得赋码药品的流向能被实时监控。2015年底前,我国要实现药品全过程电子监管,保障药品在生产、流通、使用各环节的安全。调查结果显示,只有少数包装印有此标签。建议企业要逐渐完善药品包装的整改,药监部门有必要将其纳入相关法规中作为药品标签的必列项目。
3.15 其他
为保障人民用药安全有效、使用方便,我国实行处方药与OCT的分类管理。两类药品在其标签和说明书的格式与内容上是有明显区别的。但调查发现,有将二者混淆的现象。这将有可能造成药品在流通、使用和监管过程中的混乱。
4 建议
药品标签和说明书规范化的实现需要药学各部门的共同参与,尤其是药品生产企业和药品监督管理部门。药品生产企业要加强对药品标签和说明书重要性的认识。严格按照国家食品药品监督管理总局关于药品标签和说明书的相关规定进行设计和撰写,确保其格式规范,内容真实准确。同时,要主动跟踪上市品种的用药信息,需对说明书进行修订的,以补充申请的方式提交药监部门审批后执行。
药品监督管理部门要将药品包装标签、说明书作为药品法制管理的重要内容加以规范。一方面,严格审批制度,从源头上规范标签和说明书的书写。另一方面,实时跟踪上市后用药信息和研究成果,科学评估用药利益与风险关系,及时采取干预措施,对说明书数据进行修订和维护,保证说明书信息时效性、真实性和科学性。
此外,医疗机构的医务人员、社会药房的执业药师作为指导用药及提供使用药品信息的主要群体,一方面要加强药品标签和说明书相关法规的学习,另一方面在患者使用过程中发现问题应及时与药监部门、生产企业沟通,并对其合理化提出改进意见。只有药学各部门的共同参与,才能使药品标签和说明书不断完善、规范、科学化和合理化[6]。
[1] 张晓亮.中成药说明书现状调查[J].中国执业药师,2013,10(8):51-54.
[2] 国家食品药品监督管理局.药品说明书和标签管理规定[S].国家食品药品监督管理局令第24号.2006-03-15.
[3] 国家食品药品监督管理局.关于印发非处方药说明书规范细则的通知[S].国食药监注[2006]540号.2006-10-20.
[4] 国家食品药品监督管理局.关于印发化学药品和生物制品说明书规范细则的通知[S].国食药监注[2006]202号.2006-05-10.
[5] 国家食品药品监督管理局.关于印发中药、天然药物处方药说明书格式内容书写要求及撰写指导原则的通知[S].国食药监注[2006]283号.2006-06-22.
[6] 方顺干,沈浓儿,吴祖帅.336份药品说明书缺项统计分析[J].中国药房,2012,23(45):4315-4316.
Investigation and Analysis of Labels and Package Inserts of 447 Kinds of Drugs
Yu Hong(Pharmacy Department of Chongqing Medical and Pharmaceutical College,Chongqing 401331,China)
Objective:To standardize the adm inistration of labels and package inserts of drugs and make sure that patients use drug safely and reasonably.Methods:According to the Regulations for the Management of Labels and Package Inserts of Drugs and its supporting documents,447 kinds of commonly used drug labels and package inserts were investigated.Results:Problems were found in drug labels and package inserts such as missing items in both drug labels and package inserts,item contents not meeting w ith the requirements,nonstandard fonts,printing off,composing type not meeting w ith the requirements and the inconform ity of label contents to package inserts.Conclusion:The relevant regulations for drug labels and package inserts should be followed more strictly. Pharmaceutical enterprises should further standardize the compiling of drug labels and package inserts and make improvement.Drug administrative departments should attach the importance to the standardization of legal management of drugs.Medical institution and business enterprises should intensify communication w ith drug supervision departments and pharmaceutical producing enterprises if finding problems.
Label;Package Insert;Standardization
10.3969/j.issn.1672-5433.2015.03.004
2014-11-23)
余虹,女,硕士,讲师。研究方向:药事法规。E-mail:yuhong0773@163.com

