锂键简介及与氢键的比较
崔 敏,吕仁庆,刘春英,文 萍
(1. 中国石油大学(华东) 理学院, 山东 青岛 266580;2. 中国石油大学(华东)重质油国家重点实验室, 山东 青岛 266580)
锂键简介及与氢键的比较
崔 敏1,吕仁庆1,刘春英1,文 萍2
(1. 中国石油大学(华东) 理学院, 山东 青岛 266580;2. 中国石油大学(华东)重质油国家重点实验室, 山东 青岛 266580)
在氢键的基础上,介绍了锂键概念的提出以及发展状况。着重说明了三种类型的锂键,即LiY二聚体锂键、X··LiY型锂键(包括σ型和π型)以及LiY寡聚物锂键,并给出了它们的稳定结构。最后比较了锂键和氢键的异同性。
氢键;锂键;分子轨道理论
氢键概念由Huggins、Latimer和Rodebush首先提出[1],随后三位科学家和Pauling在1920-1936年完善了氢键理论[2,3],在后来的广泛深入研究中,氢键理论得到了充分的发展。现代氢键理论认为,与电负性大的原子或基团X(氟、氧、氮、氯、磷、硒、溴、碘、甚至与电子吸引取代基相连的碳等)共价结合的氢,与电负电性大、含有孤对电子或 π键或可极化的电子的原子或基团Y(Y可以与X相同,也可以不同)接近,在X与Y之间以氢为中介,生成X-H··Y键,这种相互作用称为氢键。尽管没有发生正常的(formal)质子转移,但X-H称为质子给予体(proton donors),而 Y称为质子接受体(proton acceptors)。极小的氢允许其同时和两个富电子原子或基团发生相互作用。氢键在化学、物理、生物学中扮演重要的角色。因为锂在周期表中和氢同属于 IA族元素,且它们的半径较小,都容易失去一个电子形成+1价离子,是最接近氢的类似物(congener),逻辑上说,锂可以取代形成氢键的氢形成相互作用[4]。
1 锂 键
1.1 锂键概念的提出
1959年,Shigorin首次提出锂键概念[5],他认为锂在某些化合物中有类似于氢键的锂键 X··LiY(X为H2O、NH3、(CH3)2O、(CH3)3N,Y为Cl、Br)存在,(LiY)2(Y为OH、F、NH2、NF2)中锂键键能大于100 kJ/mol。然而这种提法最初并没有被人们所接受,相反,West[6]和 Brown[7]强调了它们多中心缺电子键特性,就像Al2(CH3)6一样。他们认为没有理由认为烷基锂聚合物和缺电子键化合物有所不同。多配位锂原子形成簇化合物是锂化学的基本特性,而锂的二配位化合物并不常见。1970年,Kollman等[4]研究了与氢键相似的锂键,特别指出锂键是锂二配位形成的。作者采用HF方法计算并比较了H-F··LiF,HF··HF,Li-F··HF,LiF··Li-Li,Li-F··H-H,Li-F··LiF体系。计算表明,锂键的红移和强度增加与氢键相类似。锂键和氢键相比,键长增长,键的力常数减小,偶极矩增加,如表1所示。在形成二聚物Li-F··Li-Li和Li-F··H-H后存在着较大的能量差异和电荷的重新分布。正确预言了(LiF)2的环状结构,并且计算所得的该二聚物形成能与实验结果基本一致。同时讨论了表征供体-受体络合物(complex)形成的分子轨道能量的变化。

表1 部分化合物或二聚物的键长(Å)和偶极矩(D)比较Table 1 The comparison of bond lengths(Å) and dipole moment(D) of some compounds or dimers
锂是最小的单价金属。因为锂的电正性比氢的强,理论上说 Li-Y的离子性比 H-Y要强。结果X··LiY之间的相互作用力要比X··HF之间的相互作用力要大(X为富电子密度物种)。锂键的某些性质与氢键相似发生在X··LiY授体-受体络合物,而Y为卤素原子。Ault和Pimentel[8]首次采用红外光谱实验方式证明了在二聚物 X··LiY(X = NH3、Me3N、H2O、Me2O;Y = Cl、Br)中存在锂键。二聚物中 Li-Y的伸缩振动吸收频率分别为(CH3)3N·LiCl,632 cm-1;H3N·LiCl,538 cm-1; (CH3)2O·LiCl,524 cm-1;H2O·LiCl,553 cm-1;(CH3)3N·LiBr,554 cm-1;H3N·LiBr,584 cm-1;H2O·LiCl,460 cm-1。在这类二聚物物中Li-Y键伸缩振动频率的变化类似于氢键二聚物中 H-Y键的伸缩振动频率的变化规律。在气相碱金属卤化物中锂原子与其它原子相互作用形成二聚体,并且进一步得到核磁共振和质谱等实验手段的证实。这些实验结果表明,在锂的一些化合物中,确有类似于氢键相互作用的存在,合理地可称为“锂键”。但频率变化的程度要比相应的氢键小,并且没有象表征氢键形成的红外光谱强度的变化,如表2所示。
实验已经证明,锂化合物倾向于形成多聚物,但在气态碱金属卤化物中也存在一定浓度的二聚物,在这些二聚物中,锂和两个原子作用形成所谓的锂键[4]。尽管锂键是三中心作用,但至今极少有实验对它们研究,一个重要原因是锂的配位环境比较复杂,锂可以和底物、溶剂或配体相互作用形成多中心物种,所以至今对锂键的研究多在理论计算层面。

表2 LiX-碱络合物振动频率和频率移动Table 2 Vibrational frequencies and relative shifts for lithium halide-base complexes
1.2 锂键的分类
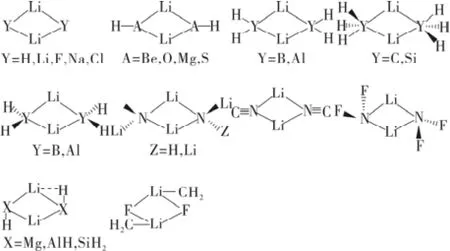
图1 可能的LiY二聚物的稳定结构Fig.1 The possible stable structures of LiY dimmers
按照锂的二配位络合物的结构特点,可以分为两类,分别为(Li-Y)2和X··Li-Y络合物。对于(Li-Y)2类,Y一般是指H、Li、BeH、BH2、CH3、CN、NH2、NF2、OH和F等原子或基团。一些相对稳定的LiY二聚物的结构如图1所示。对这些结构采用SCF和电子相关方法进行了理论研究,研究结果表明,对于形成能的计算,必须考虑模拟方法、基组、零点能校正、基组重叠误差(BSSE)等因素的影响。
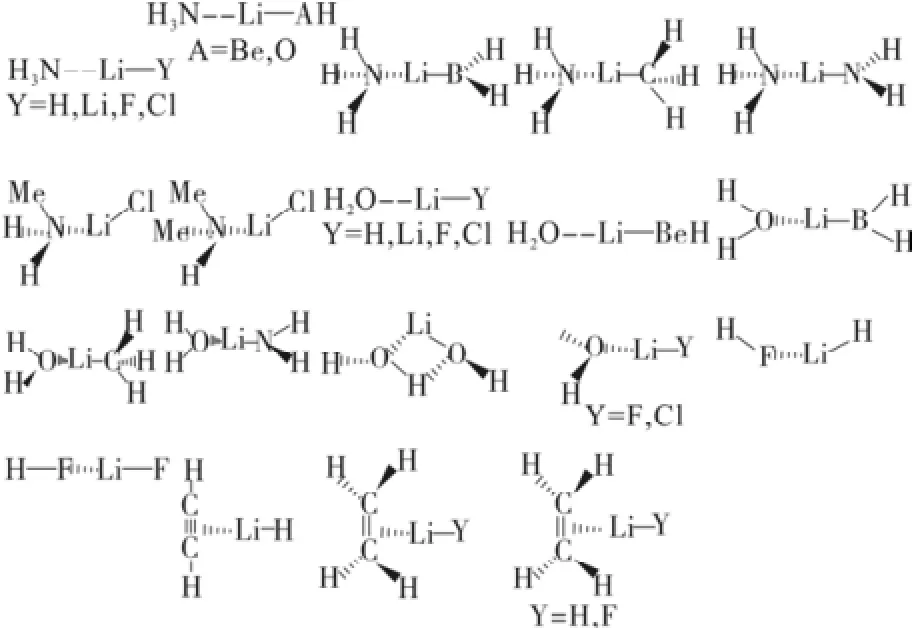
图2 X··Li-Y络合物的稳定结构Fig.2 The stable structures of X··Li-Y complexes
对于二元体系X··LiY,有σ型和π型之分。所谓σ型X··LiY,物种中X有孤对电子(X = NH3、H2O和Y = H、Li、BeH、BH2、CH3、NH2、OH、F、Cl;X = CH3OH和Y = F、Cl;X = MeNH2、Me2NH和Y = Cl;X = HF和Y = LiH、LiF)。所谓π型,X··LiY物种中,X为有π电子的C2H2、C2H4,而Y为H、F。多数锂键物种具有如图2所示的线形结构。由3-6个LiY单体相互作用形成的锂键,称为寡聚物(LiY)n(n = 3~6)锂键。其主要的构型如图3所示。寡聚物锂键(σ型)主要是静电作用。

图3 部分(LiY)n(n = 3~6) 寡聚物锂键结构示意图Fig.3 The scheme of lithium bond for some (LiY)n(n = 3~6) oligomer
2 锂键和氢键的比较
氢键和锂键都表现出某种程度上的电荷转移(charge transfer)。但它们的区别性是显而易见的[9,10]。其表现为:一是构型明显不同;二是锂键比氢键要强,锂键主要是静电作用,而氢键不仅有静电作用,还包含相当程度的电荷转移和电子相关作用;三是在形成X··Li-Y和X··H-Y二聚物中,Li-Y距离增长比H-Y增长大,并且H明显的靠近Y原子,而Li却往往居于X和Y的中心位置,如表3所示。

表3 X··Li-Y的优化结构的Li-Y的键长及其键长变化Table 3 The bond lengths (Å) and bond length change (Å) of X··Li-Y geometries
在X··H-Y中X与Y的距离比X与Y的范德华半径之和小,而在X··Li-Y中,X与Y间的距离大于X与Y的范德华半径之和;四是电子相关作用在锂键和氢键中所扮演的作用不同。电子相关作用对锂键稳定化能只有很小的作用,并且往往降低了络合能。相反,电子相关作用对氢键有很大的影响,能增加氢键的稳定化能高达10%~50%[11]。相关作用对构型影响不同,在形成氢键后,分子间距缩短,而在形成锂键后,分子间距往往略微增大[12];五是(LiY)2二聚物中锂键不同于其它类型的锂键,因为在这二聚物中,环状结构是较稳定的结构,这可看成四极离子聚集体(quadrupolarion aggregates);六是Li+比 H+大,它可以形成二配位以上的络合物,而H+不能形成二配位以上的络合物。
3 结 论
近年来,锂化学得到了迅猛的发展,关于锂形成的化合物的研究越来越多,一些研究采用“锂键”或“锂键络合物”等术语[13,14]。但更多的不提倡使用“锂键”或“锂键络合物”这个术语。锂键和氢键的相似性是由于它们都是+1价阳离子,半径都很小。而他们之间更多的表现为差异性,源于锂离子的电子构型为1s2,而氢离子是一个完全裸露的质子。
[1] Kasper C. The Ionic Nature of The Hydrogen Bond[J]. J. Am. Chem. Soc.,1931, 53(6): 2424-2425.
[2] Gilli G, Gilli P. The Nature of the Hydrogen bond[M]. Oxford Scholarship, 2009.
[3] Pauling L. The Nature of the Chemical bond: Application of results obtained from the quantum mechanics and from a theory of paramagnetic susceptibility to the structure of molecules[J]. J. Am. Chem. Soc., 1931, 53(4): 1367-1400.
[4] Kollman P A, Liebman J F, Allen L C. Lithium bond[J]. J. Am. Chem. Soc., 1970, 92(5): 1142-1150.
[5] Shigorin D N. Infra-red absorption spectra study of H-bonding and of metal-element bonding[J]. Spectrochim. Acta, 1959, 14: 198-212.
[6] West R, Glaze W. The Infrared Spectra of Alkyllithium Compounds[J]. J. Am. Chem. Soc., 1961, 83(17): 3580-3583.
[7] Brown T L, Dickerhoof D W, Bafus D A. The Infrared and Nuclear Magnetic Resonance Spectra of Ethyllithium[J]. J. Am. Chem. Soc., 1962, 84(8): 1371-1376.
[8]Ault B S, Pimentel G C. Matrix Isolation Infrared Studies of Lithium Bonding[J]. J. Phys. Chem., 1975, 79(6): 621-626.
[9] Sapse A M, Scheleyer P v R. Lithium chemistry: A theoretical and experimental overview[M]. John Wiley & Sons, Inc., 1995.
[10]Sannigrahi A B, Kar T, Niyogi B G, et al. The lithium bond reexamined[J]. Chem. Rev., 1990, 90(6): 1061-1076.
[11]Hobza R, Zahradnik R. Intermolecular interactions between medium-sized systems[J]. Chem. Rev., 1988, 88(6): 871-897.
[12]Latajka Z, Scheiner S. Abinitio comparison of H bonds and Li bonds. Complexes of LiF, LiCl, HF, and HCl with NH3[J]. J. Chem. Phys., 1984, 81: 4014-4017.
[13]Berski S, Latajka Z. Comparison of lithium and hydrogen bonds in (X•••Li•••X)- and (X•••H•••X)- (X=F, Cl and Br) complexes: Topological analysis of electron localization function[J]. Int. J. Quantum Chem., 2002, 90(3): 1108-1120.
[14]Veith M, Schutt O, Huch V. The First Crystal Structure of a Germanium(II) Amide with a Germanium-Lithium Bond and Its Behavior Towards Oxygen and Water. Angew[J]. Chem. Int. Ed., 2000, 39(3): 601-604.
Introduction of Lithium Bond and Comparison Between Lithium Bond and Hydrogen Bond
CUI Min1, LV Ren-qin1, LIU Chun-ying1,WEN Ping2
(1. College of Science, China University of Petroleum(East China), Shandong Qingdao 266580, China;2. State Key Laboratory of Heavy Oil, China University of Petroleum(East China), Shandong Qingdao 266580,China)
On the basis of the introduction of hydrogen bond, the suggestion of lithium bond and its progress were reviewed. Three types of lithium bonds, including LiY dimmers, X··LiY complexes (σ-lithium bonded complexes, π-lithium bonded complexes) and LiY oligomers, were highlighted. The most stable structures of three types of lithium bond were illustrated. The similarities and differences between lithium bond and hydrogen bond were also compared.
Lithium bond;Hydrogen bond;Molecular orbital theory
O 611.2
A
1671-0460(2015)08-1996-04
山东省高校教学改革项目:构建大学化学立体化教材体系,项目编号:2012149。
2015-02-02
崔敏(1979-),女,山东东营人,实验师,硕士,研究方向:主要从事无机及分析化学实验教学及油田化学方面的研究。E-mail:cuimin_upc@163.com。
吕仁庆(1969-),男,副教授,博士。E-mail:lvrq2000@163.com。

