G-ξ图的一种错误表示*
黑恩成 刘国杰
(华东理工大学化学系 上海200237)
在物理化学教材中,为了判别化学反应进行的方向与限度,需要引入摩尔反应Gibbs自由能的概念,并形象地用G-ξ图来示意。虽然在本杂志上已有学者[1]详细地讨论了这个图应该怎样画法,但此后出版的教材中,仍然可见错误的表示。这便引发我们写此短文,试图更进一步阐明出错的原因,供大家讨论。
1 摩尔反应Gibbs自由能
化学反应的方向与限度可由如下多相变组成系统的热力学基本方程[2]来描述:

这里的第2个等式是因为在系统达热平衡、力平衡和相平衡时,各相的温度、压力和化学势是相等的,此时有:

倘若系统中只发生一个化学反应,其反应计量方程为:

式中,B代表反应物或产物,νB是它们的反应计量数,产物取正值,反应物取负值。
定义反应进度:

用来表示反应进行的程度,式中nB0和nB分别为反应开始和任一时刻B物质的量。由此可得:

将式(6)代入式(1),得:

若反应是在恒温、恒压和不做非体积功的封闭系统中进行,则有:

式中(∂G/∂ξ)T,p即称摩尔反应Gibbs自由能,用ΔrGm表示;其负值亦称亲和势,以表示反应的亲和力。
不难看出,当反应正向进行时,反应进度的微变dξ>0,因此,(∂G/∂ξ)T,p的符号完全由dGT,p决定。于是,根据Gibbs自由能减少原理,化学反应的方向和限度可由下式判别:

式中不等号表示不可逆或反应的方向,等号表示可逆或反应的限度。所以,G-ξ曲线的斜率就成为反应方向与限度的判据。

2 一种值得商榷的G-ξ图
目前,在国内有些物理化学教材中,将G-ξ示意图中的曲线画成如图1的形式,这是值得商榷的。

图1 化学反应的G-ξ示意图
虽然图1中的C点(∂G/∂ξ)T,p=0,代表化学平衡,C点的左侧,曲线的斜率总小于0,表示反应正向进行,C点的右侧,曲线的斜率总大于0,表示反应逆向进行,似乎这一切都符合规律,但是,曲线中出现了两个拐点A和B,这就是问题所在。
拐点的数学特征是二阶导数等于0,即(∂2G/∂ξ2)T,p=0。即:
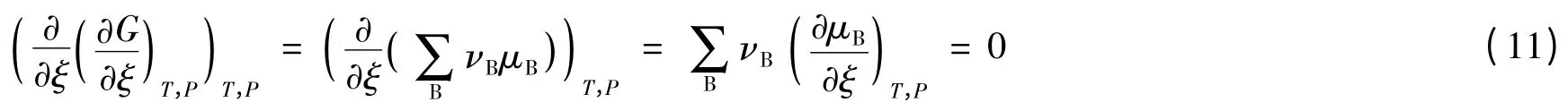
要满足式(11),可令:

也就是说,在拐点处反应物和产物的化学势都不再随反应进度而改变,反应因此而停顿。这现象似乎有些像达到化学平衡的状态,因为当反应物转变成产物时,反应物的化学势不断地减小,而产物的化学势不断地增大,直到时,反应便达化学平衡状态。此时,反应物和产物的化学势也都不再进一步改变。然而,不同的是,拐点的,即它并非处在热力学平衡状态,而是处在内部不平衡的状态,这种状态称为冻结态。
3 冻结态
下面以H2(g)在50~300K下转动对摩尔热容CV,m的贡献[4]为例来说明什么是冻结态。H2(g)是正氢(Ortho-H2)和仲氢(Para-H2)的混合物,两者的区别在于转动量子数J不同,正氢的J=1,3,5…,仲氢的J=0,2,4…。在较高温度时,H2(g)中正氢与仲氢的平衡组成为3:1,当温度趋近0K时,由于H2(g)的J变为0,它们的平衡组成变为0:1。两种氢气对转动摩尔热容CV,m的贡献是不同的。因此,在上述温度范围内,H2(g)的转动摩尔热容随温度的变化是复杂的。由图2可见,在低温时,用统计力学算得的理论值与实验值差别很大。

图2 氢气的转动摩尔热容与温度的关系
1927年,Dennison作了如下两点假设,竟意想不到地解决了上述问题,即:①假定氢气中正氢和仲氢的组成是不随温度而变的;②假定正氢与仲氢的组成始终被“冻结”在高温时的平衡组成(3:1)。于是,可得H2(g)的转动摩尔热容为:

由此算得的CV,m几乎与图2中的曲线1重合。可见,低温时的H2(g)是处在冻结态中,它的组成与高温时相同,正氢与仲氢的分子比为3:1,且保持不变。
冻结态是一种亚稳状态,它偏离热力学平衡状态主要是由于动力学的原因。由于正氢转变成仲氢需要活化能,故若在H2(g)中加入活性炭作为催化剂[5],这种冻结态就会因此而消失。
通常,系统只有在受到干预时,才会出现冻结态,诸如冷却至低温,加阻化剂或移去催化剂等。但是,对于本文研究的恒温、恒压、不做非体积功的封闭系统,这些干预都是不可能发生的。因此,G-ξ曲线中是不可能出现拐点的。也就是说,图1所示的G-ξ曲线是一种错误的表示。
[1]吕瑞东,高丕英.大学化学,2009,24(2):60
[2]胡英,吕瑞东,刘国杰,等.物理化学.第5版.北京:高等教育出版社,2007
[3]刘国杰,黑恩成.物理化学导读.北京:科学出版社,2008
[4]唐有祺.统计力学及其在物理化学中的应用.北京:科学出版社,1979
[5]McClelland B J.Statistical Thermodynamics.龚少明译.上海:上海科学技术出版社,1980

