基于碳、氮稳定同位素的厦门筼筜湖两种优势端足类食性分析
郑新庆, 王 倩, 黄凌风, 王建佳, 林荣澄, 黄丁勇, 孙晓红
1 国家海洋局第三海洋研究所, 厦门 361005 2 海洋出版社, 北京 100081 3 厦门大学环境与生态学院, 厦门 361005 4 山东大学(威海)海洋学院, 威海 264209
基于碳、氮稳定同位素的厦门筼筜湖两种优势端足类食性分析
郑新庆1,*, 王 倩2, 黄凌风3, 王建佳1, 林荣澄1, 黄丁勇1, 孙晓红4
1 国家海洋局第三海洋研究所, 厦门 361005 2 海洋出版社, 北京 100081 3 厦门大学环境与生态学院, 厦门 361005 4 山东大学(威海)海洋学院, 威海 264209
测定了厦门市筼筜湖(内、外湖)大型海藻群落两种优势端足类(强壮藻钩虾Ampitheoevalida和上野蜾蠃蜚Corophiumuenoi)及其潜在食源的碳、氮稳定同位素比值(δ13C和δ15N),分析研究了这两种端足类摄食习性的空间变动特征。研究发现,端足类的潜在食源包括悬浮颗粒有机物(Particulate organic matter:POM),沉积有机物(Sedimentary organic matter:SOM),石莼(Ulvalactuca:Ulva)及其表面的附生生物(Epiphytes:Epi),它们的δ13C和δ15N值分别介于-24.0‰(POM)—-11.8‰(Ulva)和-1.7‰(POM)—4.7‰(Ulva)之间。其中,Ulva和POM的δ13C值的内、外湖差异不显著;而外湖SOM和Epi的δ13C值则明显高于内湖。采样区SOM有机质来源的空间差异是其δ13C内、外湖差异的主要原因。除POM外,外湖有机碳源的δ15N明显高于内湖,这与它们利用氮源的δ15N的差异有关。潜在食源稳定同位素组成的空间差异,使得筼筜湖端足类的稳定同位素组成,尤其是δ15N值表现出显著的空间变动特征(强壮藻钩虾和上野蜾蠃蜚δ15N的内、外湖差异高达1.6‰和4.2‰,变幅约1个营养级),但2种端足类食性的空间差异却不尽相同:强壮藻钩虾的食性相对稳定,其δ13C值介于Ulva和Epi之间,表明它主要从Ulva及其表面的Epi获取碳源;而上野蜾蠃蜚的食性内、外湖差异较大:内湖从石莼表面的Epi获取碳源,约20%是来自POM的贡献,而外湖则主要以Ulva及其表面的Epi为食。分析显示,筼筜湖内、外湖端足类δ15N的空间差异并不是端足类的营养级发生了变化,而是由于端足类食源δ15N的空间差异引起的,而不同端足类食性的内、外湖差异则可能与环境中饵料的丰度和生物量密切相关。
稳定同位素; 强壮藻钩虾; 上野蜾蠃蜚; 端足类;食性;筼筜湖
随着水域富营养化的加剧,在全世界范围内沿岸水体、河口、咸水或半咸水泻湖的底栖群落中大型海藻形成密集的藻丛(Canopies)是一个越来越普遍的现象[1-4]。这些海藻大部分以绿藻为主,如石莼Ulva、浒苔Enteromorpha和刚毛藻Cladophora[1, 5-7],一般生活史短暂而且生长迅速,在和其它生产者竞争光和营养盐中占有优势[8],因此往往形成一个种类相对单一、生物量很高的大型海藻群落[1, 4]。
大型海藻的蓬状结构和藻体之间的纠结缠绕为生物提供了一个理想的栖息地和庇护所,支撑着密集和多样的动物群落。其中,个体小、生长迅速的端足类往往是最主要的初级消费者[2, 7, 9-11]。例如,Duffy报道,在美国北卡罗来纳州Radio Island Jetty,栖息在马尾藻Sargassumfilipendula上肉眼可见的动物中,97%是端足类,密度达130个/g鲜藻[2, 9]。Balducci等在威尼斯泻湖的调查中发现,在硬石莼Ulvarigida占优势的植物群落中,栖息在硬石莼上的动物 (<10mm)中,钩虾Gammarusaequicauda的丰度占总丰度的82.8%[2]。它们为鱼类和其它捕食者提供了丰富的食物来源[9, 12-13],在沿岸藻基的生态系统的能流过程中扮演着关键性的作用。
迄今为止,发现的端足类种类繁多,尤其是钩虾亚目,其数量约占端足类总数的80%,有6000余种,近1000属,大多是海水种。它们的生活习性多样,对食物的需求也不尽相同,摄食行为和食性在属、种间存在较大的差异。即使同一种类,其食性可能还受到栖息环境、食物丰歉等因子影响,而采取不同的摄食策略[14]。不同的端足类,由于食性的差异,在生态系统的中的地位不尽相同。例如Jassaslatteryi,利用口器附肢撕碎海草叶,减小碎屑颗粒,加速分解过程;同时,J.slatteryi又是海草附生植物的啃食者,降低附生植物对光照和营养盐的竞争,促进海草的生长,因此J.slatteryi在海草床碎屑和牧食食物链中都扮演重要的角色[15]。由此可见,了解藻栖端足类的摄食习性,有助于认识藻场生态系统中各初级生产者的能流走向和端足类在不同能流途径(碎屑食物链和牧食食物链)中的作用。
筼筜湖是厦门市一个水深较浅的富营养化半咸水澙湖。从2001年起,在温度较低的冬春两季,筼筜湖区出现以石莼和条浒苔占主导的大型海藻群落,端足类作为筼筜湖大型海藻群落藻栖动物的优势类群和啃食者,它们对筼筜湖大型海藻群落的摄食调控作用引起了关注。本研究选取了筼筜湖最优势的两种管栖性端足类(强壮藻钩虾Ampithoevalida和上野蜾蠃蜚Corophiumuenoi)为研究对象[16],通过测定筼筜湖内、外湖这两种端足类及其潜在食源的碳、氮稳定同位素(δ13C和δ15N),研究这两种端足类摄食习性的空间变化特征;同时,也比较了内、外湖海水培养的浮游植物δ13C和δ15N的差异,研究筼筜湖初级生产者利用氮源δ15N的空间差异;结合摄食习性的分析数据,初步分析引起端足类δ15N空间变动的主要原因。
1 材料与方法
1.1 研究点描述
筼筜湖位于厦门岛西部,面积约1.5km2,毗连西海域,是一个水深较浅(<5m)的半封闭咸水潟湖(图1)。水体运动的主要形式是由纳潮引发的水循环,从西海域引入的海水经引水渠、内湖和外湖,最后经过水闸排入厦门西海域,水停留时间约3d。此外,来自干渠上游的松柏湖水也会沿干渠进入内湖和外湖。由于大量陆源营养物的输入,湖区水体富营养化严重[17],冬春季(每年11月至翌年的5月)常爆发大型海藻(主要是石莼Ulvalactuca)的藻华(绿潮)[18]。
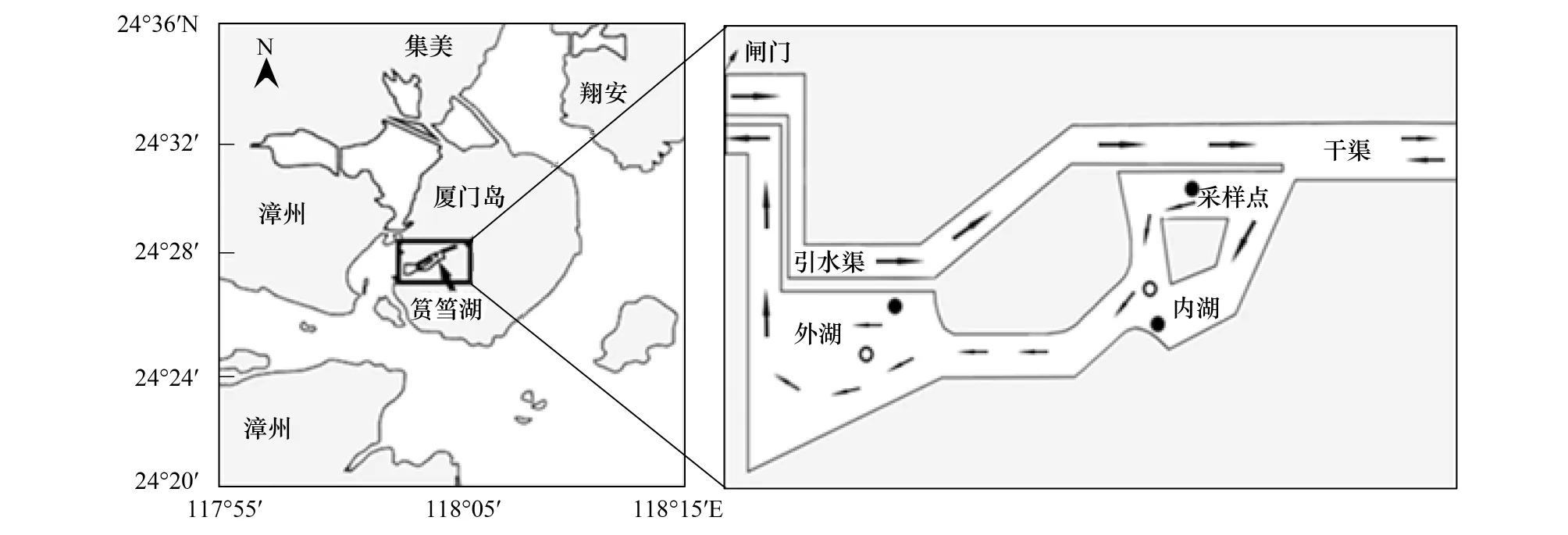
图1 采样站位图(左图引自参考文献[18])Fig.1 The location of Yundang Lagoon (cited from reference[18]) and the sampling sites箭头所示为水流方向
本研究于2013年3月在内、外湖采集强壮藻钩虾和上野蜾蠃蜚及其潜在食源,比较它们碳、氮稳定同位素比值及食性的空间差异。分别在内、外湖水深较深的区域(水深约4—5 m,见图1“○”所示位置)采集悬浮颗粒有机物(POM)避免沉积物再悬浮产生的干扰,在内、外湖的近岸浅水水域采集沉积有机物(SOM),石莼(Ulvalactuca:Ulva)和端足类(水深不到1 m,见图1“●”所示位置)。
1.2 样品的采集与前处理
1.2.1 潜在食源样品的采集及前处理
取1—2 L表层水,经170μm的筛滤过滤,所获取的滤液经预先在马弗炉550℃灼烧过的GF/F膜过滤,所得的样品即为POM。采集Ulva装在封口袋中。所获取的Ulva在0.22 μm的过滤海水中轻轻荡涤,去除表面附着的一些无机颗粒和一些松散附着的微型生物,然后用刷子轻刷Ulva表面,待Ulva表面洗净后,用MiliQ水冲洗Ulva藻表面3次,所得样品即为Ulva。将 “刷洗液”通过63 μm的筛绢过滤,静置3—5 min后,所得的上清液过滤到预先在马弗炉550℃灼烧过的GF/F膜上,所得膜样品即为Epi。采用柱状采样器采集SOM,每个站位取5—10个柱状样,取表层0.5 cm的沉积物混合于一个样品中。将采集的沉积物经63 μm筛绢分筛,所获得的颗粒物即为SOM。
1.2.2 端足类样品的采集及前处理
强壮藻钩虾和上野蜾蠃蜚是筼筜湖绿潮期间最优势的端足类,它的丰度受到大型海藻丰度的强烈影响,是典型的海藻伴生性端足类[16, 19]。本研究用箱式采样器(采样面积0.04 m2)采集强壮藻钩虾和上野蜾蠃蜚。采集的端足类用过滤海水(0.45 μm)暂养2—4 h,待排空胃含物后,收集于洗净的离心管。
将上述样品(包括膜样品、沉积物样品和端足类样品)置于烘箱60℃烘48 h至恒重。为了去除样品中的碳酸盐成分,膜样品和沉积物样品还必须经过酸化的步骤。膜样品采用酸熏的方法:在洗净的干燥器中用12 mol/L的HCl酸化48 h,然后迅速将膜样品放在烘箱中60℃烘48 h。用1 mol/L的HCl酸化SOM样品,每隔1 h搅拌摇匀1次,直至没有气泡产生,然后再用MiliQ水反复冲洗SOM样品5次,去除样品中残余的HCl,最后将酸化后的SOM样品置于烘箱中,60℃烘48 h至恒重。除膜样品外,其它的样品都研磨成粉,经100目的筛绢过筛后收集于样品瓶中,然后置于干燥器中保存以待分析。
1.3 室内培养浮游植物样品的采集及前处理
为了确定内、外湖初级生产者所利用碳、氮源稳定同位素组成的差异,于2013年3月用玻璃蓝盖瓶采集1L左右的筼筜湖内、外湖海水,带回实验室用0.22μm的滤膜过滤,获取过滤海水。将浓缩的筼筜湖浮游植物(以中肋骨条藻Skeletonnemacostatum为主)接种至过滤海水中,在光照培养箱15 ℃下(该温度为筼筜湖3月份的平均水温)培养,光暗周期设置为10h∶14 h,平行样n=3。每天早、晚摇匀1次,保证浮游植物悬浮。待培养藻液为深黄色时用移液枪取约100mL的上层藻液过滤至经预先在马弗炉550℃灼烧过的GF/F膜上,滤膜经上述酸化步骤后,烘干,保存以待分析。
1.4 样品的测定
样品的碳、氮稳定同位素比值(δ13C和δ15N)采用DELTA V Advantage 同位素比率质谱仪(Isotope Ratio Mass Spectrometer)测定。外部设备为Flash EA1112 HT 元素分析仪(Elemental Analyzer)。它的原理是利用样品在元素分析仪中高温燃烧后生成CO2和N2,质谱仪通过检测CO2的13C与12C比率和N2的15N与14N比率,并与国际标准物(Pee Dee Belnite和大气N2)比对后计算出样品的δ13C和δ15N比率值。其中,δ13C的测定精度为±0.1‰,δ15N的测定精度为±0.2‰。
计算公式如下:
δ13C或δ15N =(Rsample-Rstandard)/Rstandard×1000
式中,R指的是13C/12C或15N/14N。
1.5 数据处理与分析
采用SPSS 16.0分析所获得的数据。采用成组数据t检验比较内、外湖端足类及潜在食源的δ13C或δ15N的差异,比较取自内、外湖海水培养的浮游植物的δ13C或δ15N的差异,比较端足类各食源的C/N,显著性水平P<0.05。
采用IsoSource线性混合模型分析不同食源对消费者的食源贡献率。模型计算时,采用的Increment值和Tolerance值分别为1和0.1%。根据Vander Zanden和Rasmussen,假设相邻营养级δ13C的营养富集因子(TEF)是0.47‰。植食性消费者的δ15N的TEF是2.52‰[20]。
2 结果
2.1 潜在食源的δ13C和δ15N值及其C/N
端足类潜在食源包括POM,SOM,Ulva及其表面的Epi,其δ13C和δ15N值分别介于-24.0‰—-11.8‰和-1.7‰—4.7‰之间,Ulva最高,POM最低(图2)。成组数据t检验显示,内、外湖的Ulva和POM的δ13C值差异不显著(P>0.05),但Ulva表面的附生生物和SOM差异显著,其中内、外湖之间SOM的Δδ13C高达4.3‰;除POM外,外湖采集的SOM,Ulva及其表面Epi显著高于内湖,Δδ15N介于1.0‰—1.7‰不等。

图2 筼筜湖内、外湖的端足类潜在食源的δ13C和δ15NFig.2 δ13C and δ15N values of various food sources collected from inner and outer lagoonUlva:石莼Ulva lactuca;Epi:附生生物Epiphytes;SOM:沉积有机物sedimentary organic matter;POM:悬浮颗粒有机物particulate organic matter
表1 筼筜湖内、外湖海水培养的浮游植物的δ13C和δ15N
Table 1δ13C andδ15N of the phytoplankton cultivated in filtered seawaters collected from inner and outer lagoon

海水来源Sourceofseawaterδ13Cδ15N内湖Innerlagoon-18.05±0.46a2.40±0.40b外湖Outerlagoon-17.54±0.29a7.63±0.66b
纵列中的不同字母表示处理组之间差异显著(P<0.05)

图3 筼筜湖内、外湖端足类潜在食源的C/N值Fig.3 C/N values of various food sources in inner and outer lagoon
2.2 浮游植物的稳定同位素组成
本研究通过比较采自筼筜湖内、外湖海水培养的浮游植物的稳定同位素组成的差异,分析初级生产者所利用碳、氮源稳定同位素组成的差异,结果如表1所示。结果显示,内、外湖海水培养的浮游植物的δ13C相当,但外湖海水培养的浮游植物的δ15N远高于内湖海水。这个结果表明外湖初级生产者利用的氮源有着明显富集的δ15N(P<0.05)。
C/N可以作为有机物营养价值的重要指标,其值越低,表示有机物的氮含量越高,其相对营养价值越高。端足类几种潜在食源的C/N如图3所示,其中,Ulva和内湖SOM的C/N最高,POM和Epi相当。从平均值来看,外湖各食源的C/N比低于内湖,但内、外湖Ulva和POM的差异不显著(P>0.05),而外湖采样点的SOM约为内湖的2/3(P<0.05)。
2.3 强壮藻钩虾和上野蜾蠃蜚的稳定同位素组成
筼筜湖2种优势端足类的δ13C和δ15N如图4所示。内、外湖强壮藻钩虾的δ13C值相当(约为-14.8‰),但外湖上野蜾蠃蜚的δ13C值远高于内湖(P<0.05),Δδ13C达3.8‰。外湖强壮藻钩虾和上野蜾蠃蜚的δ15N皆高于内湖,其Δδ15N分别为1.6‰和4.2‰。

图4 筼筜湖内、外湖的强壮藻钩虾和上野蜾蠃蜚的δ13C和δ15NFig.4 δ13C and δ15N values of A. valida and C. uenoi collected from inner and outer lagoon
3 讨论
3.1 筼筜湖有机碳源的稳定同位素组成
筼筜湖内、外湖的Ulva的δ13C值约12‰,这个值与Lin等[21]在台湾七股潟湖,Page和Lastre[22]在西班牙Ria de Arosa河口及Martinetto等[23]在美国马萨诸塞州Sage Lot Pond潟湖的研究结果相近。镜检显示,Ulva表面的Epi主要以底栖微藻(BM)为主,其δ13C值介于-18‰—-16‰之间,均值17.6‰,这个值落在先前报道的BM的范围内(-19.8‰—-14.5‰)[24-26],也与Moncreiff和Sullivan[27]采自二药藻Halodulewrightii表面附生植物的δ13C值接近(均值17.5‰),但低于Jaschinski等报道的大叶藻Zosteramarina表面附生植物的δ13C值[28]。除BM以外,Epi还包括大量的细菌和有机碎屑等,因此内、外湖Ulva表面Epiδ13C的差异可能是内、外湖Epi的不同组分所占的比重不同引起的,内、外湖Epi碳氮比的差异也证实了这一点(图3)。
利用筼筜湖海水培养的浮游植物的δ13C值约-18‰,这个值与Middelburg和 Nieuwenhuize在比利时Schelde河口[29],Kanaya等在日本Gamo澙湖[26]以及Goering等在美国阿拉斯加州Auke湾[30]的调查结果接近,但比Shang等在长江河口崇明岛光滩[24],Moncreiff和Sullivan在墨西哥湾Horn岛海草床[27],Kang等在韩国Deukyang等3个海湾[31],van Dover在美国新泽西沿岸[32]的调查结果富集。本研究结果显示,筼筜湖POM的δ13C远比筼筜湖水培养的纯浮游植物的δ13C贫化(图2,表1),表明浮游植物并不是这时期筼筜湖POM的主要贡献者,它存在其它δ13C贫化的有机物源。郑新庆等[18]的研究结果表明,外源输入的有机碳,例如陆源有机碎屑和生活污水的输入时冬春季筼筜湖内湖POM的主要贡献者。
内、外湖SOM的δ13C存在显著的差异,这主要是由于采样区SOM的来源不同造成的。内湖采样区的石莼处于生长期,大型海藻形态完整,SOM的δ13C与POM接近,表明这时期SOM主要源自海藻爆发前POM的自然沉降;而外湖采样点的石莼正处于衰败期,石莼破碎化,形成大小10—15cm的海藻碎片,沉积物黑色,主要是石莼来源的有机碎屑。因此,外湖SOM中石莼来源的有机碎屑贡献的增加使其SOM的δ13C明显富集。
除POM外,外湖有机碳源的δ15N明显高于内湖(图2),这可能与外湖初级生产者利用的氮源具有相对富集的δ15N有关。室内培养浮游植物δ15N的内、外湖差异也证实了这一点。不过,到底何种原因引起内、外湖初级生产者利用氮源δ15N的差异还需要未来进一步深入研究。
3.2 强壮藻钩虾和上野蜾蠃的食性分析
强壮藻钩虾和上野蜾蠃蜚是筼筜湖绿潮期间最优势的端足类,它的丰度受到大型海藻丰度的强烈影响,是典型的海藻伴生性端足类[16,18-19]。本研究的结果显示,外湖采样区的强壮藻钩虾和上野蜾蠃蜚的δ13C介于Ulva及其表面的Epi之间(图5),表明外湖两种端足类主要从Ulva及其表面的Epi获取碳源。IsoSouce模型的输出结果显示,Ulva及其表面的Epi对强壮藻钩虾食源的贡献率分别为39.2%和40.4%,对上野蜾蠃蜚食源的贡献率分别为45.9%和28.3%(图6)。

图5 筼筜湖端足类及其潜在食源的δ13C-δ15N关系图 Fig.5 Plot of δ13C-δ15N relationship in amphipods and their potential food sources in the Yundang Lagoon
内湖采样区的强壮藻钩虾同样介于Ulva和Epi之间,表明内、外湖强壮藻钩虾食性接近,都以Ulva及其表面的Epi为食,但内湖Epi对强壮藻钩虾食源的贡献率更高(64.1%,图6)。上野蜾蠃蜚的δ13C与Epi相当(图5),表明内湖上野蜾蠃蜚主要从Ulva表面的Epi获取碳源(72.1%),另有部分(约20%)来自沉降的POM(图6)。
现场和实验室的观察和研究结果表明,强壮藻钩虾喜食大型海藻,高密度的强壮藻钩虾会引起大型海藻生物量的下降[2-3]。先前许多研究也显示,与强壮藻钩虾同属的Ampithoelongimana,A.marcuzzii,A.ramondi和A.lacertosa都以大型海藻为食[2-3, 14]。本研究的结果表明,除Ulva以外,强壮藻钩虾还摄入相当部分附着在Ulva表面的Epi,在内湖的采样区,Epi对它食源的贡献率甚至高于Ulva。猜测这可能是由于强壮在啃食石莼时,也同时摄入了附着在它表面的Epi。Epi有着比石莼更高的营养价值(图3),因此强壮藻钩虾可能对Epi有着更高的同化效率。这也解释了为什么被广泛接受以大型海藻为食的强壮藻钩虾的δ15N仅比Ulva略高。Jephson等发现,在瑞士沿岸的大叶藻群落,丝状海藻与端足类Gammaruslocusta和Microdeutopusgryllotalpa的δ13C相近,是端足类主要的食物来源[33],但与本研究的结果相似,端足类G.locusta和M.gryllotalpa和丝状海藻之间没有出现明显的富集现象,而且在平均值上还比丝状海藻的δ15N稍低。同样的结果也被Martinetto等发现[23]。结果表明,这可能归因于这些消费者摄入部分δ15N相对贫化的海藻表面附生生物[23],而在沿岸的大型海藻群落或大型海藻主导的生态系统中,海藻表面附生生物对消费者的营养重要性并没有受到重视。

图6 不同有机碳源对内、外湖的强壮藻钩虾和上野蜾蠃蜚食物组成的贡献率Fig.6 Contribution of carbon sources to the diet of A. valida and C. uenoi in inner and outer lagoon
本研究结果表明,Ulva表面的Epi是上野蜾蠃蜚重要的食物来源,这与Aikins和Kikuchi在日本仙台市Gamo澙湖的研究结果一致。Aikins和Kikuchi发现,上野蜾蠃蜚主要以江蓠Gracilariavermiculophylla表面的附生硅藻为食,它的丰度与江蓠表面附生硅藻的密度成明显的负相关关系,对附生硅藻有明显的摄食压力[34]。该结果也得到Kanaya等稳定同位素数据的支持[35]。不过,在筼筜湖,上野蜾蠃蜚的食性存在明显的空间差异,外湖采集的上野蜾蠃蜚似乎还摄入很大比例的石莼。这可能与内、外湖大型海藻所处的生长阶段不同有关:内湖石莼处于生长期,大型海藻形态完整;而外湖石莼正处于衰败期,石莼破碎化,形成大小10—15cm的海藻碎片,沉积物呈现黑色,主要是石莼来源的有机碎屑。上野蜾蠃蜚是典型的刮食性消费者,其附肢密布刚毛,它无法直接啃食大型海藻,而逐渐腐败并形成碎屑颗粒的碎屑间接为上野蜾蠃蜚提供丰富的碳源。
由上可见,内、外湖端足类稳定同位素组成,尤其是δ15N值的显著差异(图4),并不是端足类的营养级发生变化,而是与端足类食源δ15N的空间变化有关(图2, 图4),通过同位素在有机体内的分馏作用,这种差异性会表现在消费者身上。
4 小结
(1) 筼筜湖内、外湖Ulva和POM的δ13C差异不显著;外湖SOM和Epi则明显高于内湖。SOMδ13C的内、外湖差异主要是由于采样区SOM有机质来源的差异造成,而Epi的差异则可能是由于Epi中不同组分所占比重不同引起的。除POM外,外湖有机碳源的δ15N也明显高于内湖,这是内、外湖初级生产者所利用氮源的δ15N的差异引起的。
(2) 筼筜湖强壮藻钩虾的食性相对稳定,主要从Ulva及其表面的Epi获取碳源;而上野蜾蠃蜚的食性内、外湖差异较大:内湖从石莼表面的Epi获取碳源,约20%是来自POM的贡献,而外湖则主要以Ulva及其表面的Epi为食。
(3) 筼筜湖端足类的δ15N值存在明显的空间变动特征,这主要是其食源δ15N的空间差异引起的,通过同位素在有机体内的分馏作用,这种差异性会表现在消费者身上。
[1] Baeta A, Pinto R, Valiela I, Richard P, Niquil N, Marques J C.δ15N andδ13C in the Mondego estuary food web:Seasonal variation in producers and consumers. Marine Environmental Research, 2009, 67:109- 116.
[2] Balducci C, Sfriso A, Pavoni B. Macrofauna impact onUlvarigidaC. Ag. production and relationship with environmental variables in the lagoon of Venice. Marine Environmental Research, 2001, 52(1):27- 49.
[3] Cruz-Rivera E, Hay M E. The effects of diet mixing on consumer fitness:macroalgae, epiphytes, and animal matter as food for marine amphipods. Oecologia, 2000, 123(2):252- 264.
[4] Martins I, Maranhão P, Marques J C. Modelling the effects of salinity variation onEchinogammarusmarinusLeach (Amphipoda, Gammaridae) density and biomass in the Mondego Estuary (Western Portugal). Ecological Modelling, 2002, 152(2- 3):247- 260.
[5] Lapointe B E, O'Connell J. Nutrient-enhanced growth ofCladophoraproliferain Harrington Sound, Bermuda:eutrophication of a confined, phosphorus-limited marine ecosystem. Estuarine, Coastal and Shelf Science, 1989, 28(4):347- 360.
[6] Lavery P S, Lukatelich R J, McComb A J. Changes in the biomass and species composition of macroalgae in a eutrophic estuary. Estuarine, Coastal and Shelf Science, 1991, 33(1):1- 22.
[7] Cebrián J. Grazing on benthic primary producers // Nielsen S L, Banta G T, Pedersen M F, eds. Estuarine Nutrient Cycling:The Influence of Primary Producers. Netherlands:Springer, 2004:153- 185.
[8] Valentine J F, Duffy J E. The central role of grazing in seagrass ecology // Seagrasses:Biology, Ecology and Conservation. Netherlands:Springer, 2006:463- 501.
[9] Ceh J, Molis M, Dzeha T M, Wahl M. Induction and reduction of anti-herbivore defenses in brown and red macroalgae off the Kenyan coast. Journal of Phycology, 2005, 41(4):726- 731.
[10] Kraufvelin P, Salovius S, Christie H, Moy F E, Karez R, Pedersen M F. Eutrophication-induced changes in benthic algae affect the behaviour and fitness of the marine amphipodGammaruslocusta. Aquatic Botany, 2006, 84(3):199- 209.
[11] Kamermans P, Malta E-J, Verschuure J M, Schrijvers L, Lentz L F, Lien A T A. Effect of grazing by isopods and amphipods on growth ofUlvaspp. (Chlorophyta). Aquatic Ecology, 2002, 36(3):425- 433.
[12] Costa F O, Costa M H. Life history of the amphipodGammaruslocustain the Sado estuary (Portugal). Acta Oecologica, 1999, 20(4):305- 314.
[13] Christie H, Kraufvelin P. Mechanisms regulating amphipod population density within macroalgal communities with low predator impact. Scientia Marina, 2004, 68(S1):189- 198.
[14] Cruz-Rivera E, Hay M E. Macroalgal traits and the feeding and fitness of an herbivorous amphipod:the roles of selectivity, mixing, and compensation. Marine Ecology Progress Series, 2001, 218:249- 266.
[15] Howard R K. Impact of feeding activities of epibenthic amphipods on surface-fouling of eelgrass leaves. Aquatic Botany, 1982, 14:91- 97.
[16] 郑新庆, 黄凌风, 王蕾, 谢天宏, 洪清波, 黄邦钦. 筼筜湖大型海藻群落的几种藻栖端足类的种群动态研究. 厦门大学学报:自然科学版, 2011, 50(5):928- 933.
[17] 李娟, 黄凌风, 郭丰, 蔡阿员, 郑颖. 细基江蓠对氮、磷营养盐的吸收及其对赤潮发生的抑制作用. 厦门大学学报:自然科学版, 2007, 46(2):221- 225.
[18] Zheng X Q, Huang L F, Huang B Q, Lin Y Q. Factors regulating population dynamics of the amphipodAmpithoevalidain a eutrophic subtropical coastal lagoon. Acta Oceanologica Sinica, 2013, 32(6):56- 65.
[19] 郑新庆, 姚雪芬, 黄凌风, 郭丰, 林玉美, 徐向伟, 傅迅毅. 厦门筼筜湖龙须菜生长的主要影响因素. 海洋科学, 2008, 32(12):47- 51.
[20] Vander Zanden M J, Rasmussen J B. Variation inδ15N andδ13C trophic fractionation:implications for aquatic food web studies. Limnology and Oceanography, 2001, 46(8):2061- 2066.
[21] Lin H J, Kao W Y, Wang Y T. Analyses of stomach contents and stable isotopes reveal food sources of estuarine detritivorous fish in tropical/subtropical Taiwan. Estuarine, Coastal and Shelf Science, 2007, 73(3- 4):527- 537.
[22] Page H M, Lastra M. Diet of intertidal bivalves in the Ría de Arosa (NW Spain):evidence from stable C and N isotope analysis. Marine Biology, 2003, 143(3):519- 532.
[23] Martinetto P, Teichberg M, Valiela I. Coupling of estuarine benthic and pelagic food webs to land-derived nitrogen sources in Waquoit Bay, Massachusetts, USA. Marine Ecology Progress Series, 2006, 307:37- 48.
[24] Shang X, Zhang G S, Zhang J. Relative importance of vascular plants and algal production in the food web of aSpartina-invaded salt marsh in the Yangtze River estuary. Marine Ecology Progress Series, 2008, 367:93- 107.
[25] Choy E J, Richard P, Kim K-R, Kang C K. Quantifying the trophic base for benthic secondary production in the Nakdong River estuary of Korea using stable C and N isotopes. Journal of Experimental Marine Biology and Ecology, 2009, 382(1):18- 26.
[26] Kanaya G, Takagi S, Kikuchi E. Spatial dietary variations inLaternulamarilina(Bivalva) andHedistespp. (Polychaeta) along environmental gradients in two brackish lagoons. Marine Ecology Progress Series, 2008, 359:133- 144.
[27] Moncreiff C A, Sullivan M J. Trophic importance of epiphytic algae in subtropical seagrass beds:evidence from multiple stable isotope analyses. Marine Ecology Progress Series, 2001, 215:93- 106.
[28] Jaschinski S, Brepohl D C, Sommer U. Carbon sources and trophic structure in an eelgrassZosteramarinabed, based on stable isotope and fatty acid analyses. Marine Ecology Progress Series, 2008, 358:103- 114.
[29] Middelburg J J, Nieuwenhuize J. Carbon and nitrogen stable isotopes in suspended matter and sediments from the Schelde Estuary. Marine Chemistry, 1998, 60(3- 4):217- 225.
[30] Goering J, Alexander V, Haubenstock N. Seasonal variability of stable carbon and nitrogen isotope ratios of organisms in a North Pacific bay. Estuarine, Coastal and Shelf Science, 1990, 30(3):239- 260.
[31] Kang C K, Kim J B, Lee K S, Kim J B, Lee P Y, Hong J S. Trophic importance of benthic microalgae to macrozoobenthos in coastal bay systems in Korea:dual stable C and N isotope analyses. Marine Ecology Progress Series, 2003, 259:79- 92.
[32] van Dover C L, Grassle J F, Fry B, Garritt R H, Starczak V R. Stable isotope evidence for entry of sewage-derived organic material into a deep-sea food web. Nature, 1992, 360(6400):153- 156.
[33] Jephson T, Nyström P, Moksnes P O, Baden S P. Trophic interactions inZosteramarinabeds along the Swedish coast. Marine Ecology Progress Series, 2008, 369:63- 76.
[34] Aikins S, Kikuchi E. Grazing pressure by amphipods on microalgae in Gamo Lagoon, Japan. Marine Ecology Progress Series, 2002, 245:171- 179.
[35] Kanaya G, Takagi S, Nobata E, Kikuchi E. Spatial dietary shift of macrozoobenthos in a brackish lagoon revealed by carbon and nitrogen stable isotope ratios. Marine Ecology Progress Series, 2007, 345:117- 127.
Feeding habits for two dominant amphipod species in the Yundang Lagoon based on stable carbon and nitrogen isotope analysis
ZHENG Xinqing1,*, WANG Qian2, HUANG Lingfeng3, WANG Jianjia1, LIN Rongcheng1, HUANG Dingyong1, SUN Xiaohong4
1ThirdInstituteofOceanography,StateOceanicAdministration,Xiamen361005,China2ChinaOceanPress,Beijing100081,China3CollegeoftheEnvironmentandEcology,XiamenUniversity,Xiamen361005,China4MarineCollege,ShandongUniversity,Weihai264209,China
Amphipods are common, key grazers in coastal macroalgal communities. Understanding their feeding habits will help us predict the fate of primary producers in macroalgal-based ecosystems and the role of amphipods in the detritus and grazing food chains. The feeding habits of amphipods are frequently reported; however, these data are primarily obtained from laboratory experiments. Considering that amphipod feeding selectivity is influenced by various factors such as habitat, food availability, morphological traits, and nutritional value of food sources, differences between laboratory and field experiments are expected. This study measured stable carbon and nitrogen isotopes (δ13C andδ15N, respectively) of two dominant amphipod species,AmpithoevalidaandCorophiumuenoi, and their potential food sources in Yundang Lagoon, and analyzed spatial variation in their diet. Potential amphipod food sources contained particulate organic matter (POM), sedimentary organic matter (SOM), andUlvalactucaand its associated epiphytes. Theδ13C values ranged from -24.0‰ for POM to -11.8‰ forU.lactuca, and the correspondingδ15N values from -1.7‰ to 4.7‰. There were no significant differences between theδ13C values ofU.lactucaand POM; however, theδ13C values for sedimentary organic matter (SOM) andU.lactucaepiphytes were higher in the outer lagoon than the inner lagoon. The difference inδ13C for SOM between the inner and outer lagoon was mainly explained by spatial shifts in the sources of organic matter, such as POM sedimentation before macroalgal blooms in the inner lagoon and organic debris from decayingU.lactucain the outer lagoon. Epiphytes mainly contained benthic microalgae, bacteria, and organic debris, so variation inδ13C may be caused by spatial shifts in epiphyte composition. Other than POM, theδ15N values of the carbon sources were higher in the outer lagoon than in the inner lagoon, and this is largely attributed to differences in the nitrogen sources that are absorbed. This inference is also supported by the spatial variation inδ15N for phytoplankton cultivated in the laboratory using filtered seawater collected from the Yundang Lagoon. Spatial dietary variation was not obvious forA.valida, which mainly obtained carbon fromU.lactucaand associated epiphytes. However, significant spatial variation in diet was observed forC.uenoi, which mainly fed on epiphytes attached toU.lactucaand POM in the inner lagoon, butU.lactucaand associated epiphytes in the outer lagoon. Our results showed that theδ15N content in amphipods was much higher in the outer lagoon in than the inner lagoon, and this variation is largely caused by spatial variation in food sources.
stable isotope;Ampithoevalida;Corophiumuenoi; amphipod; feeding habits; Yundang Lagoon
福建省自然科学基金面上资助(2014J01127);国家自然科学基金面上资助(31272703)
2014- 04- 20; < class="emphasis_bold">网络出版日期:
日期:2015- 05- 18
10.5846/stxb201404200779
*通讯作者Corresponding author.E-mail:zhengxinqing@tio.org.cn
郑新庆, 王倩, 黄凌风, 王建佳, 林荣澄, 黄丁勇, 孙晓红.基于碳、氮稳定同位素的厦门筼筜湖两种优势端足类食性分析.生态学报,2015,35(23):7589- 7597.
Zheng X Q, Wang Q, Huang L F, Wang J J, Lin R C, Huang D Y, Sun X H.Feeding habits for two dominant amphipod species in the Yundang Lagoon based on stable carbon and nitrogen isotope analysis.Acta Ecologica Sinica,2015,35(23):7589- 7597.

