miR-155抑制HepG2.2.15细胞中乙型肝炎病毒复制与表达的研究
蔡启茵,任广立,张卫云,马恒灏
(1.广州军区广州总医院,广东 广州 510010;2.广州中医药大学,广东 广州 510405)
miR-155抑制HepG2.2.15细胞中乙型肝炎病毒复制与表达的研究
蔡启茵1,2,任广立1,张卫云1,马恒灏1
(1.广州军区广州总医院,广东 广州 510010;2.广州中医药大学,广东 广州 510405)

目的研究人miR-155对HepG2.2.15细胞中乙型肝炎病毒(HBV)的抑制作用,为miRNAs治疗乙型肝炎提供理论依据。方法以HepG2.2.15细胞基因组为模板,PCR扩增人miR-155前体序列,双酶切连接到pmR-mCherry质粒,构建pmiR-155真核过表达载体,并转染到HepG2.2.15细胞。设重组组(pmiR-155质粒)、空载组(pmR-mCherry质粒)、转染试剂组和空白组。转染后24h、48h、72h,应用实时荧光定量PCR法检测各组miR-155表达量和HBV DNA拷贝数,化学发光法定量检测HBsAg和HBeAg变化情况。结果实时荧光定量PCR结果显示,与空白组相比,重组组miR-155表达量明显提高。化学发光法结果示在转染后48h,过表达的miR-155对上清培养液所分泌HBsAg、HBeAg抑制作用明显,抑制率分别为(83.96±1.52)%和(79.60±8.71)%。定量PCR检测示过表达的miR-155对HBV DNA拷贝数的抑制率分别为(51.87±0.36) %、(43.67±1.51) %和(68.21±6.02)%。结论miR-155对HBV蛋白的抑制作用具特异性,呈负相关,在体外可抑制HepG2.2.15细胞中HBV的复制和表达。
乙型肝炎病毒;miR-155;HepG2.2.15细胞
乙型肝炎病毒(HBV)是引起病毒性肝炎的重要病原体之一。全球约4亿人感染慢性HBV,可继发为肝纤维化、肝硬化,甚至肝细胞癌,严重危及全球人类健康[1]。近年来药物治疗主要为干扰素和核苷类似物,在一定程度上可抑制病毒复制,减轻肝损伤程度,但无法彻底清除体内病毒[2]。microRNA-155(miR-155)是长度约为65bp的小分子RNA,表达于T细胞、B细胞、单核细胞及巨噬细胞等多种细胞,参与调控炎症、抗病毒感染、免疫系统发育和应答[3-5]。Su等[6]研究表明miR-155异位表达可促进JAK/STAT(Janus kinases-signal transducers and activators of transcription)信号通路,增强抗病毒感染能力,降低乙型肝炎病毒X蛋白(Hepatitis X protein, HBx)的表达,从而达到干扰HBV复制效果。本研究通过构建miR-155真核过表达载体,并在体外转染HepG2.2.15细胞,旨在从蛋白和基因水平评估miR-155对HBV的抑制效应。
1 实验资料
1.1主要试剂和仪器 Lipofectamine2000、TRIzol总RNA提取试剂盒(美国Invitrogen公司),去内毒素质粒提取试剂盒(美国Omega公司),乙型肝炎病毒表面抗原和e抗原定量测定试剂盒(美国Abott公司),HBV DNA定量检测试剂盒(上海科华生物工程股份有限公司)。荧光倒置显微镜(日本Olympus公司),实时定量PCR仪(美国QIAGEN公司),凝胶成像分析系统、高速低温离心机(美国BioRad公司),Architect i system(美国Abbott公司)。
1.2载体构建 根据miRBase及GenBank数据库查找到成熟miR-155序列、pre-miR-155序列及侧翼序列,设计pre-miR-155正向引物:5’-tcgaGAATTCAGGTGGCACAAAC CAGGAA-3’,反向引物:5’-tcgaGGATCCGTTGAACATC CCAGTGACCAG -3’。以HepG2.2.15细胞基因组为模板PCR扩增pre-miR-155序列,经 EcoRⅠ和BamHⅠ双酶切后,片段连入pmiR-mCherry载体EcoRⅠ和BamHⅠ位点间,构建pmiR-155。经克隆转化、摇菌、双酶切及测序鉴定后,去内毒素提取重组质粒用于转染实验[7]。
1.3转染HepG2.2.15细胞 HepG2.2.15细胞培养于含200mg/L的G418、100g/L FBS的高糖DMEM培养液中, 同时含有100000IU/L 青链霉素(转染时不加双抗)和10g/L的L-谷氨酰胺,在37℃,5% CO2培养箱中培养。 细胞传代培养3次后消化接种到6孔板内, 细胞密度为4.8×105/孔,培养24h后待细胞汇合度达底面积的80%左右准备转染。设重组组(pmiR-155质粒)、空载组(pmR-mCherry质粒)、转染试剂组、空白组,转染试剂Lipofectamine 2000( μL)与质粒( μg)的比例为3∶1。
1.4实时荧光定量PCR法检测各组miR-155表达 应用TRIzol法提取各组细胞中总RNA,经紫外分光计测定浓度及纯度后,采用茎环法[8]逆转录得到cDNA后进行实时荧光定量PCR反应。miR-155及U6引物均为广州锐博生物科技有限公司的特异性引物,反应程序为95℃变性10s, 60℃退火20s,70℃延伸10s,循环40次。所得数据采用2-△△Ct公示校正后用于评估样本间的差异。
1.5HBV的抑制效应
1.5.1化学发光法定量检测HBsAg和HBeAg变化 收集细胞转染后24h、48h和72h的培养上清液,严格按乙型肝炎病毒表面抗原和e抗原定量测定试剂盒说明操作,在Architect system上检测,结束后系统计算出HBsAg及HBeAg表达量。计算抗原抑制率。公式:抑制率(%)=(1-测试组抗原分泌量/空白组抗原分泌量)×100%。
1.5.2DNA检测 收集细胞转染后24h、48h和72h的培养上清液,应用Rotor-Gene Q进行实时荧光定量PCR检测,反应程序为94℃预变性2min,94℃变性10s,60℃退火30s,循环40次。反应结束后由RG6000软件分析计算出HBV DNA的拷贝数。
1.6统计学方法应用SPSS 17.0统计软件进行统计分析,所有数据以均数±标准差表示,组间均数比较采用One-Way ANOVA检测,2组间比较采用LSD检验,双变量采用Person相关性分析,P<0.05为差异有统计学意义。
2 结 果
2.1各组miR-155表达情况 以空白组细胞内表达的miR-155量为基准,重组组miR-155表达量(22.35±1.27)明显高于空载组(5.71±1.85)及转染组(5.35±0.79)(P均<0.05)。
2.2各组HBsAg和HBeAg变化情况 转染后重组组培养上清液的HBsAg、HBeAg表达水平明显受到抑制,其中转染后48h对HBsAg、HBeAg抑制最为明显,分别为(83.96±1.52)%和(79.60±8.71)%,而其他组培养上清液中所分泌的HBsAg、HBeAg均未见明显变化。见表1及表2。同时发现,miR-155对HBV蛋白的抑制作用具特异性,呈显著负相关(r<0)。见表3。

表1 各个时间段不同组细胞HBsAg分泌情况比较

表2 各个时间段不同组细胞HBeAg分泌情况比较

表3 miR-155与HBsAg、HBeAg的相关性
2.3各组HBV DNA变化情况 转染后24h、48h和72h,重组组上清液HBV DNA表达明显受到抑制,与空载组、转染试剂组及空白组比较差异均有统计学意义(P均<0.05)。3组HBV DNA表达情况见图1,HBV DNA抑制情况见图2。
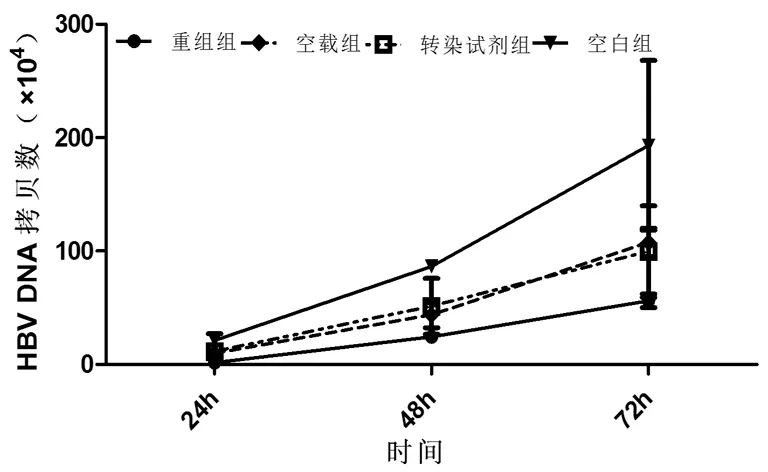
图1 各组转染后不同时间HBV DNA拷贝数比较
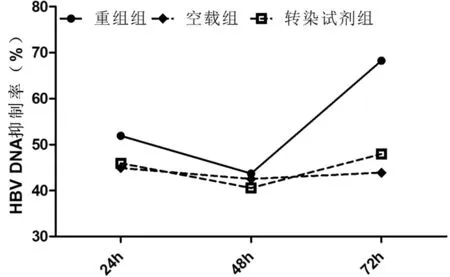
图2 各组转染后不同时间HBV DNA抑制情况比较
3 讨 论
HBV感染呈世界流行,全球有20亿人感染过HBV,其中每年约100万人死于HBV相关的肝衰竭或原发性肝癌,目前尚无特效药物清除体内的HBV复制。HBV感染者易出现免疫耐受状态,其机制可能为树突状细胞抗原提呈能力低下,T淋巴细胞免疫活化受限和肝靶细胞的应答能力下降等[9]。
miRNA通过降解靶细胞mRNAs或抑制蛋白翻译来调控转录后期的基因表达。miR-155被认为是新兴的炎症递质,具有抗感染、抗肿瘤和免疫调节等重要作用,在调节先天免疫和适应性免疫及维持系统稳定方面发挥着重要作用[10-11]。Rodriguez等[12]在敲除miR-155的转基因小鼠动物模型中证明了miR-155的缺失使DC的抗原提呈能力和共刺激能力下降, T细胞倾向分化成Th2细胞,且miR-155作用于白细胞介素-2(IL-2)信号途径抑制分子SOCS1的表达,从而调节T调节细胞的分化能力。IL-2、干扰素-γ(IFN-γ)是由Th1细胞分泌的细胞因子,可以加强细胞免疫反应,有利于清除病毒。由此可看出,miR-155参与T细胞分化及信号通路的改变,在抗病毒感染中扮演着重要角色。
本实验通过构建人miR-155真核过表达载体,并成功转染到HepG2.2.15细胞,经观察发现miR-155的表达量与细胞HBsAg、HBeAg的分泌水平呈负相关性,即当miR-155呈过表达状态时,HBsAg和HBeAg分泌量则相应下降,且HBV DNA的拷贝数明显受到抑制,这充分证明miR-155过表达状态下,可以显著抑制HBV蛋白和基因的表达水平,从而降低HBV的表达。而miR-155干扰HBV表达的作用机制,结合上述前人的研究成果,笔者推测极有可能与某些细胞因子信号通路有关,这将是本实验组下一步研究方向。
本次实验成功构建了人miR-155真核过表达载体并转染到HepG2.2.15细胞,为更好地在体外水平上进一步研究miR-155对HBV复制和免疫状态的影响提供了实验基础,为miRNAs治疗HBV感染提供了理论依据。今后将在此研究基础上,针对miR-155对HBV的复制表达抑制机制进行深入研究。
[1] Hadziyannis SJ,Vassilopoulos D,Hadziyannis E.The natural course of chronic hepatitis B virus infection and its management[J].Adv Pharmacol,2013,67:247-291
[2] Mastroianni CM,Lichtner M,Citton R,et al.Current trendsin management of hepatitis B virus reactivation in the biologic therapy era[J].World J Gastroenterol,2011,17(34):3881-3887
[3] Ruan K,Fang X,Ouyang G.MicroRNAs:novel regulators in the hallmarks of human cancer[J].Cancer Letters,2009,285:116-126
[4] Hu YL,Fong S,Largman C,et al.HOXA9regulates miR-155in hematopoietic cells[J].Nuc Aci Rese,2010,38:5472-5478
[5] Singh RP,Massachi I,Manickavel S,et al.The role of miRNA in inflammation and autoimmunity[J].Autoimmu Rev,2013,12:1160-1165
[6] Su C,Hou Z,Zhang C,et al.Ectopic expression of microRNA-155enhances innate antiviral immunity against HBV infection in human hepatoma cells[J].Virol J,2011,8:354
[7] 蔡启茵,任广立,张卫云,等.人miR-155真核过表达载体的构建及其对HepG2.2.15细胞中HBeA的抑制效应[J].世界华人消化杂志,2014,22(28):4217-4222
[8] Chen C,Ridon DA,Broomer AJ,et al.Real-time quantification of microRNAs by stem-loop RT-PCR[J].Nuc Ac Res,2005,33(20):e179
[9] Wu S,Kanda T,Imazeki F,et al.Hepatitis B virus e antigen downregulates cytokine production in human hepatoma cell lines[J].Viral Immunology,2010,23(5):467-476
[10] 张波,田野苹.microRNA-155的免疫调控作用[J].现代免疫学,2012,32(1):80-83
[11] Vigorito E,Kohlhaas S,Lu D.MiR-155: an ancient regulator of the immune system[J].Immunol Rev,2013,253:146-157
[12] Rodriguez A,Vigorito E,Clare S,et al.Requirement of bic/microRNA-155for normal immune function[J].Science,2007,316:608-611
Depressant effect of micro RNA-155on the expression and replication of Hepatitis B virus in HepG2.2.15cell
CAI Qiyin1,2, REN Guangli1, ZHANG Weiyun1, MA Henghao1
(1.General Hospital of Guangzhou Military Command, Guangzhou 510010, Guangdong, China; 2.Guangzhou University of Chinese Medicine, Guangzhou 510405, Guangdong, China)
Objective It is to investigate the depressant effect of microRNA-155(miR-155) on Hepatits B virus in HepG2.2.15cell, and provide a theoretical basis for the treatment of hepatitis B.Methods The pre-miR-155was amplified from total DNA of HepG2.2.14by PCR.The target gene fragment was digested and cloned into the pmR-mCherry plasmid.The pmiR-155was transfected into HepG2.2.15cells by liposome-mediated method.The empty plasmid, the reagent group and untreated cells were set as control.The expression of miR-155was detected by the real-time quantitive PCR.The expression of HBsAg and HBeAg were detected by chemiluminescent assay, and the changes of HBV DNA were investigated by real-time quantitive PCR.Results MiR-155level of HepG2.2.15cells which were transfected with the recombinant plasmid was obviously higher than controls.The chemiluminescent assay showed that over-expression of miR-155could inhibit the expression of HBsAg and HBeAg with (69.43±0.7) %, (45.89±0.74) % respectively on the 2nd day post-transfection.The HBV DNA was markedly suppressed with (51.87±3.74) %, (43.67±0.687) % and (68.21±0.47) % by real-time quantitive PCR.Conclusion The inhibition effect of HBV protein was specific and had a certain dependency on the expression of miR-155.MiR-155can suppress the replication and expression of HBV in vitro.
hepatitis B virus; microRNA-155; HepG2.2.15cell
蔡启茵,女,硕士研究生,研究方向为儿科病毒感染性疾病。
任广立,E-mail:guangliren@hotmail.com
广州市科技计划项目(2013J4100116)
10.3969/j.issn.1008-8849.2015.18.003
R-33
A
1008-8849(2015)18-1945-03
2015-02-12

