康莱特注射液联合化疗治疗老年晚期非小细胞肺癌疗效观察
邓新娜,赵淑芳,李 阳,吴海江,田溢卿,刘淑贞
(1.河北省人民医院,河北 石家庄 050061;2.河北医科大学,河北 石家庄 050017)
康莱特注射液联合化疗治疗老年晚期非小细胞肺癌疗效观察
邓新娜1,赵淑芳1,李 阳1,吴海江2,田溢卿1,刘淑贞1
(1.河北省人民医院,河北 石家庄 050061;2.河北医科大学,河北 石家庄 050017)

目的观察比较康莱特注射液联合培美曲塞化疗及单纯培美曲塞化疗治疗老年晚期非小细胞肺癌的近期疗效及不良反应。方法将72例既往治疗失败的Ⅲ~Ⅳ期老年非小细胞肺癌患者随机分为观察组和对照组各36例。观察组应用培美曲塞化疗同时加用康莱特注射液治疗,对照组单纯应用培美曲塞化疗,治疗2个周期后比较2组临床疗效及Karnofsky评分、体质量变化情况和不良反应发生情况。结果2组近期疗效比较差异均无统计学意义(P>0.05)。观察组的Karnofsky评分、体质量改善情况均优于对照组(P均<0.05),不良反应发生率低于对照组(P<0.05)。结论康莱特注射液联合培美曲塞治疗老年晚期非小细胞肺癌有增效减毒、改善患者生存质量及体质量的作用,值得临床应用。
康莱特;非小细胞肺癌;培美曲塞;化疗;生存质量
肺癌是常见的、全球病死率最高的恶性肿瘤[1]。由于我国人口老龄化的加剧,工业化、城市化进程的高速发展导致的环境恶化,吸烟率居高不下,肺癌的危害在我国也正逐渐显现。肺癌作为我国重要的恶性肿瘤之一,已经被卫计委列为今后癌症防治的重点。肺癌患者45岁以上占绝大多数,发病高峰年龄为70~74岁。新明确的肺癌中,非小细胞肺癌(non-small-cell lung cancer,NSCLC) 约占80%,由于起因隐匿、发展迅速,大部分患者在诊断时即为晚期[2],化疗是其主要的治疗手段。培美曲塞是新型的多靶点抗叶酸制剂,与铂类药物联合应用是一线治疗晚期非鳞型NSCLC的标准方案,此外培美曲塞单药亦是晚期NSCLC二线治疗推荐的方案。但老年患者免疫调节功能减弱,对各种抗肿瘤治疗耐受性差,放化疗过程中容易出现骨髓抑制、消化道反应等不良反应而影响患者治疗。随着老年肺癌患者的不断增多,发病率的逐年上升,化疗辅以中药增效减毒、提高生活质量在临床备受关注。康莱特注射液提炼于中药材薏苡仁,具有消癥散结、补中益气之功,在缓解癌痛、提高生活质量及免疫功能等方面具有较好疗效。本研究观察了康莱特注射液联合培美曲塞二线治疗复发及转移性晚期NSCLC的疗效,现将结果报道如下。
1 临床资料
1.1一般资料 选取2008年4月—2013年4月河北省人民医院收治的一线治疗失败的老年NSCLC患者72例,均经病理学或细胞学证实;至少有1个可测量病灶,肝、肾功能及血常规正常;仅1个姑息性化疗方案治疗失败后至少4周以上, 且该化疗方案不含培美曲塞;Karnofsky评分≥70分,预计生存期>3个月;目标病灶无放疗史。将入选患者随机分为2组:观察组36例,男28例,女8例;年龄70~79岁;腺癌32例,腺鳞癌3例,大细胞癌1例;TNM分期Ⅲ期16例,Ⅳ期20例;入组前接受手术8例,放疗9例,化疗36例;化疗1个周期2例,2个周期26例,3个周期5例,≥4个周期3例;使用化疗药物长春瑞滨8例,紫杉醇16例,多西他赛8例,吉西他滨4例,顺铂26例。对照组36例,男27例,女9例;年龄70~80岁;腺癌33例,腺鳞癌2例,大细胞癌1例;TNM分期Ⅲ期18例,Ⅳ期18例;入组前接受手术7例,放疗10例,化疗36例;化疗1个周期3例,2个周期28例,3个周期3例,≥4个周期2例;使用化疗药物长春瑞滨7例,紫杉醇18例,多西他赛9例,吉西他滨2例,顺铂28例。2组年龄、性别、治疗情况、病理类型、临床分期及Karnofsky评分等比较差异均无统计学意义(P均>0.05),具有可比性。
1.2治疗方法 对照组:培美曲塞500mg/m2第1天静脉滴注,每3周为1个周期,连用2个周期。用药前1周开始给予叶酸400μg/d口服,持续到治疗结束;用药前1周给予维生素B121000μg肌内注射;用药前1d、当天及第2天口服地塞米松8mg。观察组在对照组基础上于第1—21天加用康莱特注射液200mL/d静脉滴注。2组均在化疗期间予托烷司琼5mg静滴止吐治疗; 当外周血白细胞<3.0×109L-1时给予粒细胞集落刺激因子针(G-CSF)治疗。每21d为1个周期,化疗2个周期后评定疗效及不良反应发生情况。
1.3观察指标及评价标准
1.3.1肿瘤疗效评价 按照RECIST标准进行评价。①肿瘤病灶基线的评价:确立基线全部肿瘤负荷,可测量的目标病灶至少有1个。目标病灶分为可测量目标病灶和不可测量的非目标病灶。可测量的目标病灶:所有累及器官,单脏器最多5个病灶,全部病灶总数最多10个,需在基线时测量并记录。目标病灶根据病灶长径大小和可准确重复测量来选择。所有目标病灶的长度总和作为有效缓解记录的参考基线。非目标病灶:所有其他病灶作为非目标病灶,同样在基线上记录,不需测量的病灶在随诊期间要注意其存在或消失。②肿瘤近期疗效评定。a.目标病灶的评价。完全缓解(CR):所有目标病灶消失;部分缓解(PR):基线病灶长径总和缩小30%;稳定(SD):基线病灶长径总和有缩小但未达PR或有增加但未达疾病进展标准;疾病进展(PD):基线病灶长径总和增加20%或出现新病灶。b.非目标病灶的评价。CR:所有非目标病灶消失和肿瘤标志物水平正常;PD:出现1个或多个新病灶和/或存在非目标病灶进展;SD:1个或多个非目标病灶和/或肿瘤标志物高于正常持续存在。以CR+PR计算有效率(RR),以CR+PR+SD计算疾病控制率(DCR)。
1.3.2临床受益评价 按生存质量和体质量变化评价。生存质量评价标准以Karnofsky 评分为依据:治疗后评分增加≥10分为改善,下降≥10分为下降,变化在10分以内为稳定。体质量:治疗后体质量增加或减少1kg为增加或下降,≤1kg为稳定。
1.3.3药物不良反应评价 采用美国国立癌症研究所(NCI)制定的NCI-CTC3.0版毒性评价标准[3]。1级:较轻微的不良反应,一般无临床症状,不需要进行临床干预治疗,也不需要进行药物治疗。2级:中等程度的不良反应,一般有临床症状,且需要进行药物或其他方面的干预治疗,2级反应可能影响机体的功能,但不损害日常生活及活动。3级:较严重的不良反应,可能造成不可逆不良后果,通常症状较复杂,需进行外科手术或住院治疗等积极干预治疗。4级:对生命可能构成潜在威胁的不良反应,此类反应往往致残,甚至导致器官功能丧失。5级:死亡。
1.4统计学方法采用SPSS 13.0统计软件进行数据处理,计数资料以率(%)表示,组间比较采用2检验。P<0.05为差异有统计学意义。
2 结 果
2.1临床疗效 观察组近期有效率及疾病控制率有优于对照组的趋势,但2组比较差异无统计学意义(P均>0.05)。见表1。
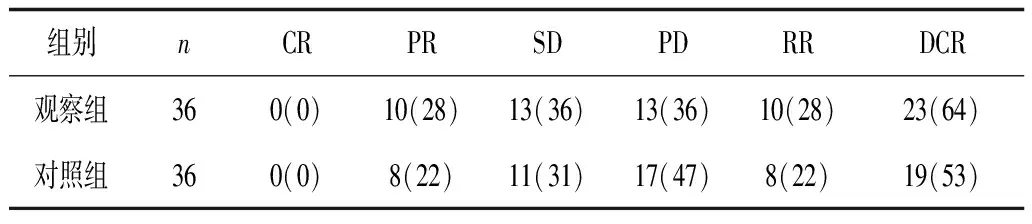
表1 2组疗效比较 例(%)
2.2临床受益情况 观察组生存质量、体质量改善情况均明显优于对照组(P均<0.05)。见表2。
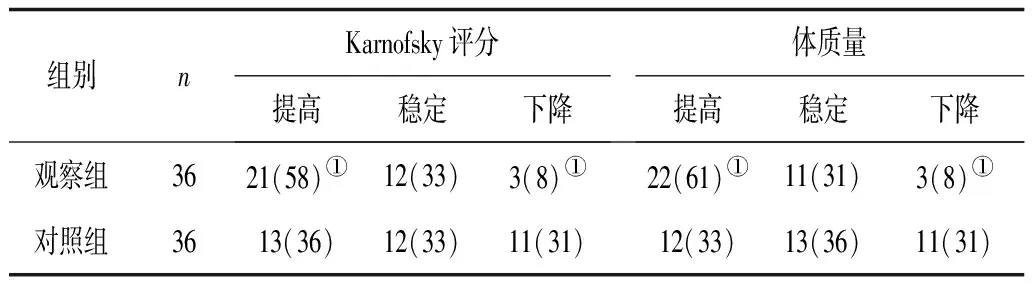
表2 2组治疗后Karnofsky评分及体质量变化 例(%)
注:①与对照组比较,P<0.05。
2.3不良反应发生情况 2组主要的不良反应是骨髓抑制、消化道反应、疲乏及肝肾功能异常,多为2~3级,4级不良反应少。观察组白细胞减少、贫血、恶心呕吐发生率均明显低于对照组(P均<0.05);血小板减少、皮疹、肝肾功能异常、疲乏发生率有低于对照组的趋势,但2组比较差异无统计学意义(P均>0.05)。见表3。
3 讨 论
2015年我国可能成为全球肺癌发病数最多的国家[4]。NSCLC是我国癌症相关死亡中最主要的疾病,其发病率和病死率逐年上升。由于老年肺癌缺乏特异性症状及体征,给肺癌的早期诊断带来困难,80%以上的老年患者就诊时已属Ⅲ~Ⅳ期。老年晚期NSCLC患者,由于免疫功能及骨髓造血功能低下、生理功能减退、多系统病共存,失去手术机会,临床多采用以单纯化疗为主的综合方法治疗[5],但化疗药物有许多的不良反应,如恶心、呕吐、腹泻、脱发、骨髓抑制等,联合药物化疗对年老体弱者可能因毒性反应影响而获得负性结果。对于老年患者可给予高效低毒的单药化疗延缓疾病进展,联合中药综合治疗对于提高疗效、改善患者生存质量、减轻化疗反应具有重要意义。
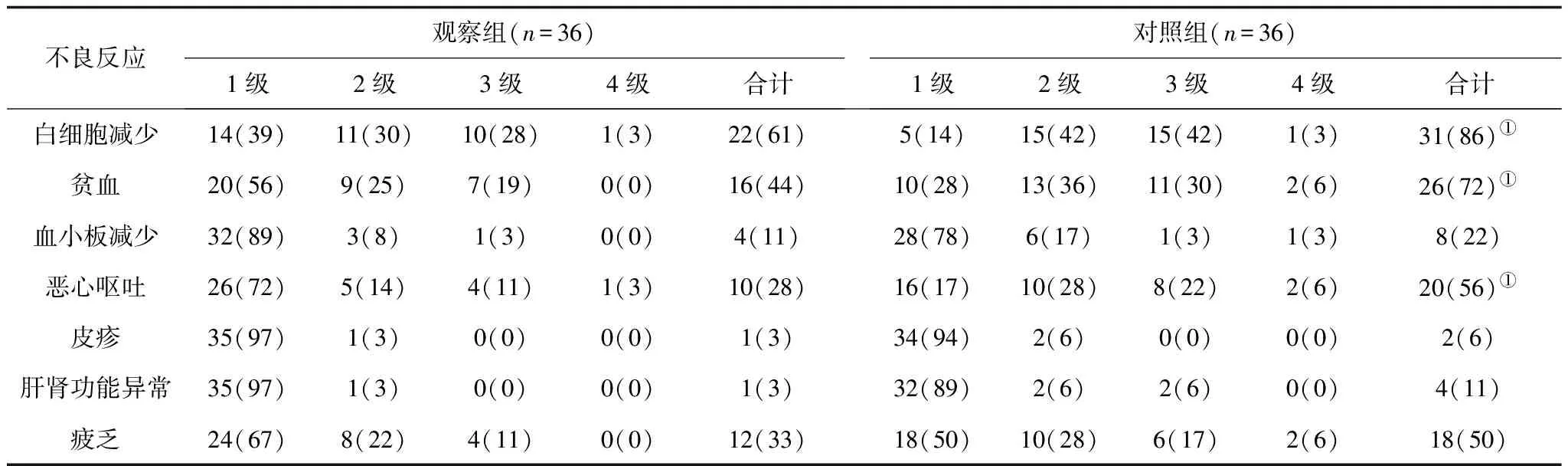
表3 2组不良反应发生情况比较 例(%)
注:①与观察组比较,P<0.05。
NSCLC标准的一线化疗方案是以铂类为基础的联合方案(长春瑞滨、吉西他滨、紫杉醇、多西他赛等),但由于其缓解率低及耐药的产生[6-7],大部分患者会在短时间内出现疾病进展而需要进入二线化疗。培美曲塞是一种新型的多靶点抗代谢类化疗药物,主要通过干扰细胞复制过程中的叶酸代谢途径发挥抑制肿瘤作用,对包括NSCLC在内的多种肿瘤具有活性。其主要作用机制是抑制胸苷酸合成酶、甘氨酸核糖核苷甲酞基转移酶和二氢叶酸还原酶,导致肿瘤细胞的嘌呤和胸腺嘧啶核苷生物合成障碍,影响肿瘤细胞DNA和RNA的合成,从而抑制肿瘤细胞的生长和增殖[8]。Hanna等[9]的Ⅲ期临床研究表明,培美曲塞对照多西他赛,在晚期NSCLC的二线治疗中,培美曲塞组的中位生存期(OS)为8.3个月,中位PFS为2.9个月,ORR为9.1%,与多西他赛组比较差异无统计学意义,仅不良反应发生率低。但在非鳞癌亚组中,培美曲塞组则优于多西他赛组,OS分别为9.3个月和8.0个月[HR=0.778, 95%CI(0.607,0.997)],且培美曲塞组的不良反应发生率明显低于多西他赛。基于此项研究,2004年美国食品和药物管理局(FDA)批准培美曲塞为晚期NSCLC二线治疗药物供临床选择[10]。Ciuleanu等[11]证实培美曲塞维持治疗较最佳支持治疗明显延长了PFS,尤其在非鳞癌亚组中的作用和地位正逐步得到认可,对NSCLC总生存期及无疾病进展生存期有延长趋势,临床应用逐渐广泛。但因治疗费用等多种原因,很多老年患者初治时未能接受培美曲塞治疗。进入二线治疗的患者多有既往多程放化疗的病史,其骨髓功能及免疫功能低下,在临床工作中,在考虑化疗药物对肿瘤细胞杀伤作用的同时,还应注意这些药物所引起的毒副反应,提高患者的生活质量。
中西医结合治疗肿瘤是我国治疗肿瘤的特色。针对化疗给患者机体带来的免疫功能下降及机体内环境失衡,中药通过“扶正培本”使患者机体达到新的平衡,进而改善生存质量,延长生存期。康莱特注射液是我国自行开发研制的中药抗肿瘤新药,主要成分为薏苡仁油,是抗肿瘤制剂,相关的基础及临床研究证实康莱特注射液能通过作用于肿瘤细胞的G2/M期,阻滞肿瘤细胞有丝分裂,诱导肿瘤细胞凋亡,抑制肿瘤新生血管生成,激活NK细胞和IL-2的活性,促进巨噬细胞吞噬功能及脾淋巴细胞的增殖,显著提高机体免疫力,能影响癌基因的表达,调节细胞因子水平以及逆转多药耐药等,可高效抑杀癌细胞,控制肿瘤生长和抗肿瘤转移,联合放、化疗和介入治疗能明显提高放、化疗的临床疗效,减轻放化疗的不良反应,缓解疼痛,稳定病情,抗癌症恶液质,提高癌症患者的生活质量[12-16]。王业亚等[17]报道康莱特联合化疗可减轻化疗药物不良反应,提高患者免疫功能,增加疗效,延长患者生存期。孙思庆等[18]报道康莱特注射液作为NSCLC化疗辅助用药,能提高患者生存质量,改善临床症状,对化疗有辅助增效作用。
本研究结果显示,观察组近期有效率、疾病控制率有优于对照组的趋势;在改善生存质量和体质量方面优于对照组,化疗不良反应尤其是白细胞抑制、贫血、消化道反应的发生率明显低于对照组,4级严重不良事件的比例很低,患者耐受性好。证实康莱特注射液有减轻化疗不良反应的作用,并能改善晚期NSCLC患者的生存质量和体质量,值得在临床推广应用。
[1] Jemal A,Siegel R,Ward E,et al.Cancer statistics, 2009[J].CA Cancer J Clin,2009,59(4):225-249
[2] Novello S,Milella M,Tiseo M,et al.Maintenance therapy in NSCLC:why to whom which agent?[J].J Exp Clin Cancer Res,2011,30:50
[3] Trotti A,Colevas AD,Setser A,et al.CTCAE v3.0:development of a comprehensive grading system for the adverse effects of cancer treatment[J].Semin Radiat Oncol,2003,13(3):176-181
[4] 中国抗癌协会肺癌专业委员会.2010中国肺癌临床指南[M].北京:人民卫生出版社,2010[5] 郭敬,曹静.肺癌病人生存质量研究进展[J].护理研究,2007,21(11):2842-2844
[6] Schiller JH,Harrington D,Belani CP.Comparison of four chemotherapy regimens for advanced non-small-cell lung cancer[J].N Engl J Med,2002,346(2):92-98
[7] Comella P,Filippelli G,De Cataldis G,et al.Efficacy of the combination of cisplatin with either gemcitabine and vinorelbine or gemcitabine and paclitaxel in the treatment of locally advanced or metastatic non-small-cell lung cancer:a phase Ⅲ randomised trial of the Southern Italy Cooperative Oncology Group( SICOG 0101)[J].Ann Oncol,2007,18:324-330
[8] Molina JR,Adjei AA.The role of pemetrexed (Alimta,LY231514)in lung cancer therapy[J].Clin Lung Cancel,2003,5(1):21-27
[9] Hanna N,Shepherd FA,Fossella FV,et al.Randomized phase Ⅲ trial of pemetrexed versus docetaxel in patients with non small cell lung cancer previously treated with chemotherapy[J].J Clin Oncol,2004,22(9):1589
[10] 李树婷,马飞,孙燕.抗肿瘤代谢新药——培美曲塞[J].癌症进展,2005,3(5):471-476
[11] Ciuleanu T,Brodowicz T,Zielinski C,et al.Maintenance pemetrexed plus best supportive care versus placebo plus best supportive care for non-small-cell lung cancer:a randomised, double-blind, phase 3study[J].Lancet,2009,374(9699):1432-1440
[12] 王云杰,黄立军,张志培,等.康莱特治疗原性肺癌的临床研究[J].现代肿瘤医学,2006,14(1):36-37
[13] Lu X,Liu W,Wu J,et al.A polysaccharide fraction of adlay seed(Coixlachryma-jobi L.) induces apoptosis in human non-small cell lung cancer A549cells[J].Biochem Biophys Res Commun,2013,430(2):846-851
[14] Chung CP,Hsia SM,Lee MY,et al.Gastroprotective activities of adlay (Coixlachryma-jobi L.var.ma-yuen Stapf) on the growth of the stomach cancer AGS cell line and indomethacin-induced gastric ulcers[J].J Agric Food Chem,2011,59(11):6025-6033
[15] Chung CP,Hsu CY,Lin JH,et al.Antiproliferative lactams and spiroenone from adlay bran in human breast cancer cell lines[J].J Agric Food Chem,2011,59(4):1185-1194
[16] 李大鹏.康莱特注射液药效学及临床研究进展[J].中国新药与临床杂志,2007,26(10):778-782
[17] 王业亚,叶琳,刘琨.康莱特注射液联合化疗对中晚期非小细胞肺癌疗效的研究[J].湖北医药学院学报,2013,32(5):387-390
[18] 孙思庆,朱晓莉,黄静.康莱特联合化疗对晚期非小细胞肺癌患者生活质量改善的临床对照研究[J].实用肿瘤杂志,2012,27(5):506-510
Clinical observation of Kanglaite Injection combined with pemetrexed in treatment of advanced non-small-cell lung cancer
DENG Xinna1, ZHAO Shufang1, LI Yang1, WU Haijiang2, TIAN Yiqing1, LIU Shuzhen1
(1.Hebei General Hospital, Shijiazhuang 050061, Hebei, China; 2.Hebei Medical University, Shijiazhuang 050017, Hebei, China)
Objective It is to observe and compare the curative effect and adverse effects of chemotherapy using Kanglaite Injection combined with pemetrexed and using pemetrexed alone on the treatment of advanced non-small-cell lung cancer (NSCLC).Methods Elderly patients with Ⅲ to Ⅳ stage NSCLC of previous treatment failure were randomly divided into the observation group and the control group, 36cases in each groups.The observation group was treated with Kanglaite injection combined with Pemetrexed and control group with Pemetrexed chemotherapy.The clinical efficacy, Karnofsky score, body mass changes and advance effects of the two groups after two cycles of treatment were observed and compared.Results There was no significant difference in curative effect in the near future between both groups (P>0.05).The Karnofsky score and body mass changes in the observation group were significantly improved compared with that in the control group (allP<0.05), and the incidence of adverse reactions was markedly lower than that in the control group (P<0.05).Conclusion Kanglaite Injection combined with pemetrexed in treatment of elderly patients with advanced NSCLC have a synergism and attenuation effect, and can improve the quality of life and the body mass, it is worthy of clinical application.
Kanglaite Injection; non-small-cell lung cancer; pemetrexed; chemotherapy; quality of life
邓新娜,女,主治医师,研究方向为恶性肿瘤的综合治疗。
刘淑贞,E-mail:dengxinna@sina.com
河北省中医药管理局资助项目(2013031)
10.3969/j.issn.1008-8849.2015.18.005
R734.2
A
1008-8849(2015)18-1951-04
2015-01-11

