碳气凝胶的改性探索及在染料废水中的吸附应用研究*
邵 琰,李亦彪,汪红燕,刘运燕
(五邑大学化学与环境工程学院,广东江门529020)
环境·健康·安全
碳气凝胶的改性探索及在染料废水中的吸附应用研究*
邵 琰,李亦彪,汪红燕,刘运燕
(五邑大学化学与环境工程学院,广东江门529020)
采用溶胶凝胶法制备了碳气凝胶和改性碳气凝胶,包括经硝酸钴浸渍改性(Co/RF)的碳气凝胶及加入纳米二氧化硅改性的(SiO2/RF)碳气凝胶。采用TG、XRD、SEM、氮气吸附法对碳气凝胶及改性碳气凝胶进行结构性能分析。分别采用Freundlich模型和Langmuir模型对亚甲基蓝在碳气凝胶及改性碳气凝胶上的吸附等温数据做了拟合分析。结果表明,制备得到的2种凝胶为无定型结构。对于SiO2/RF碳气凝胶,纳米二氧化硅均匀分布在碳气凝胶内部,对于Co/RF碳气凝胶,其表面负载了3.5%(质量分数)左右的含钴氧化物。钴和纳米二氧化硅的加入使得吸附-脱附等温线的吸附回线由H2型变为H1型。从吸附等温曲线及拟合参数可见,添加了Co后,有利于对亚甲基蓝的吸附,当加入纳米SiO2后,反而降低了吸附性能,采用HF将纳米SiO2除去后,由于介孔的增多,吸附能力明显提高。
碳气凝胶;改性;吸附;亚甲基蓝
碳气凝胶作为一种新型多孔碳材料,具有独特的多孔纳米网络结构、较高的比表面积、发达的孔隙率、可控的孔分布,同时作为唯一导电的气凝胶具有较高导电性。但因为碳气凝胶较脆、合成工艺较为复杂、成本较高等问题,在一定程度上抑制了其在商业中的广泛使用。近年来,随着研究深入和技术的发展,使得操作简单、安全系数低的常压干燥法取代超临界干燥成为可能[1]。目前,有关碳气凝胶的制备研究主要是如何通过改变原料配比和工艺参数(如反应温度、催化剂浓度、反应物浓度、固化条件、干燥方法、炭化条件等),进而研究碳气凝胶的结构控制及聚合机理[1-2]。有关碳气凝胶的应用研究大多集中其作为吸附剂[3]、催化剂载体[4]以及作为阳极材料应用在锂电子电池[5-6]、PEM燃料电池及双电层电容器中[7-8]。而碳气凝胶及改性碳气凝胶结构特性,及其作为多孔材料吸附处理染料废水方面的研究则相对较少。研究表明,碳材料中掺杂纳米氧化物粒子,通过“尺寸效应”和“界面效应”可以增加和改善碳材料的扩散通道;向其中引入金属或金属盐,可利用金属粒子对某些特定气体的吸附作用[9-13]。
笔者拟采用常压干燥法制备得到3种材料,即碳气凝胶、经硝酸钴浸渍改性碳气凝胶及加入纳米二氧化硅改性碳气凝胶,并研究亚甲基蓝在3种吸附材料上的吸附性能,为开拓新型吸附材料-碳气凝胶对染料废水吸附的工业应用提供有力参考。
1 实验部分
1.1 实验材料
间苯二酚(R),分析纯,广州化学试剂厂;甲醛(F,质量分数为37%),广州市东红化工厂;无水碳酸钠(Na2CO3),分析纯,汕头市西陇化工厂;纳米二氧化硅(SiO2),山西天一纳米材料科技有限公司;亚甲基蓝,分析纯,天津大茂化学试剂厂;水(H2O),自制。
1.2 碳气凝胶及改性碳气凝胶的制备工艺及表征
1.2.1 湿凝胶的制备
1)RF湿凝胶。将间苯二酚和甲醛(物质的量比为1∶1.85)混合配制成溶液,加入一定量的水(R与H2O物质的量比为1∶16),加入一定量的无水碳酸钠(R与Na2CO3物质的量比为1∶0.002)为催化剂,连续搅拌30 min,油封隔绝空气,置于85℃水浴中凝胶化和老化,3 d后生成暗红色RF湿凝胶。
2)SiO2/RF湿凝胶。混合溶液中间苯二酚、甲醛、水、无水碳酸钠物质的量比为1∶1.85∶16∶0.002,加入一定量的纳米SiO2(R与SiO2物质的量比为1∶0.26)继续搅拌30 min,油封隔绝空气,置于85℃水浴中凝胶化和老化,3 d后生成暗红色的SiO2/RF湿凝胶。
1.2.2 常压干燥
用表面张力系数较小且易挥发的有机溶剂丙酮浸泡RF湿凝胶或者SiO2/RF湿凝胶数天,置换有机凝胶中的水,每24 h更换一次新鲜的丙酮,再将溶剂替换过的RF凝胶或者SiO2/RF凝胶放在100℃烘箱内干燥24 h,即得到具有连续网络结构的RF气凝胶及SiO2/RF气凝胶。
1.2.3 Co/RF碳气凝胶
将得到的RF气凝胶浸渍到0.2 mol/L的硝酸钴溶液中24 h,再放入100℃烘箱内干燥24 h,即得到具有连续网络结构的Co/RF气凝胶。
1.2.4 高温碳化
将得到的3种气凝胶放入碳化炉中,在氮气保护下,以5℃/min的速度升温至150℃,再保温反应1 h。再以5℃/min的速度升温至850℃,保温2 h,得到碳气凝胶、纳米二氧化硅掺杂法改性碳气凝胶(SiO2/RF碳气凝胶)和硝酸钴浸渍法改性碳气凝胶(Co/RF碳气凝胶)。
1.2.5 结构表征
用SDT V3.0F 2960型过热重分析仪测定材料在氮气气氛下25~900℃时的热降解行为;用D8 Advance型X射线衍射仪对碳气凝胶及改性碳气凝胶进行结构测试;用FEI/Nova NanoSEM430型扫描电镜观察碳气凝胶及改性碳气凝胶的表面形貌;用ASAP2020型氮气自动吸附-脱附仪测定碳气凝胶及改性碳气凝胶的比表面积及孔径分布。
1.3 吸附平衡
亚甲基蓝在碳气凝胶及改性碳气凝胶(SiO2/RF碳气凝胶和Co/RF碳气凝胶)上的吸附等温曲线采取“瓶点法”测定。在25℃下,分别将50 mL初始质量浓度为1~1 600 mg/L的亚甲基蓝溶液置于100 mL具塞三角烧瓶中,再加入0.1 g的碳气凝胶,在恒温振荡器中振荡24 h。亚甲基蓝的浓度通过UV-3600型紫外可见分光光度计在665 nm下测试吸光度得到。吸附量Qe(mg/g)按下式计算:

式中,Qe为单位质量碳气凝胶吸附的溶质的量,mg/g;ρ0和ρe分别是碳气凝胶吸附前后溶液的浓度,mg/L;ms是吸附剂碳气凝胶的质量,g;Vs是亚甲基蓝溶液体积,mL。
2 结果与讨论
2.1 结构分析
图1为RF碳气凝胶、SiO2/RF碳气凝胶及Co/ RF碳气凝胶的TGA/DTA谱图。由图1可见,3种材料的质量损失可分为3个部分。第一部分出现在25~150℃阶段,此时3种材料的质量分别减少了4.7%、5.7%及18.1%,其原因一般认为是残留的有机前驱体溶液以及气凝胶中物理吸附残余水的去除所致;第二部分出现在150~850℃阶段,此时3种材料的质量分别减少了52.2%、53.7%及49.7%,这个阶段是有机凝胶碳化的主要阶段,有机凝胶中的C—O、C—H和其他化学键断裂,生成CO、CO2、H2和CH4等小分子气体,直到这些小分子气体全部逸出,最终形成碳骨架;最后一部分发生在850~900℃阶段,相对于前面2个阶段,3种碳气凝胶只有微量质量损失。通过图1的TGA曲线可以看出,3种碳气凝胶的热重损失发生的温度区间一致,因此确定了一致的碳化条件。从图1的DTA曲线可以看出,针对每个质量损失区间,均有对应的峰值。对于第一阶段的蒸发过程,RF碳气凝胶、SiO2/RF碳气凝胶峰为55.2℃,Co/RF碳气凝胶为89.5℃。第二个化学键断裂阶段,峰值处对应的温度也在图1做了标注。
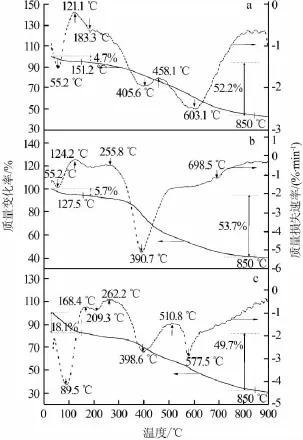
图1 碳气凝胶(a)、SiO2/RF碳气凝胶(b)、Co/RF碳气凝胶(c)的TGA/DTA谱图
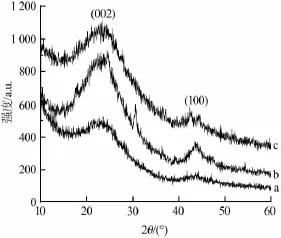
图2 碳气凝胶(a)、SiO2/RF碳气凝胶(b)、Co/RF碳气凝胶(c)的XRD谱图
图2为碳气凝胶、SiO2/RF碳气凝胶、Co/RF碳气凝胶的XRD谱图。由图2可见,强的衍射峰(002)和弱的衍射峰(100)分别在23.5°和43.8°处,所有的XRD衍射峰均为宽峰,这说明碳气凝胶材料是一种无定型材料。相较于碳气凝胶,SiO2/RF碳气凝胶在30.5°处出现了衍射峰,应为纳米SiO2的特征峰。Co/ RF碳气凝胶在42°和45°左右出现了CoO和Co3O4的衍射峰[14],但是衍射峰较低,衍射面积也相当小,说明生成的氧化钴含量较少。
图3为SiO2/RF碳气凝胶的SEM照片。从图3可见,纳米SiO2均匀分散在碳气凝胶内部,在放大5 000倍后,可以看出碳气凝胶表面均布满孔隙并具有独特的三维网络结构,同时明显看到纳米SiO2和多孔纳米网络碳结构的分界面。图4为碳气凝胶和Co/RF碳气凝胶的EDS谱图。从图4可见,加入Co后,碳气凝胶的碳质量分数从97.62%降至90.54%,与此同时钴和氧的质量分数分别增加了3.56%和3.45%,说明在碳气凝胶表面生成了钴的氧化物,这与XRD测试结果也一致。

图3 SiO2/RF碳气凝胶的SEM照片

图4 碳气凝胶(a)、Co/RF碳气凝胶(b)的EDS谱图
为了表征碳气凝胶及改性碳气凝胶孔结构的变化,对样品做N2吸附表征,得到吸附-脱附等温线,孔径分布、比表面积及孔容积等结构参数,结果见图5、图6和表1。由图5可以看出,碳气凝胶、Co/RF碳气凝胶及SiO2/RF碳气凝胶的氮气吸附-脱附等温线均为第Ⅳ类吸附等温线,说明所得的碳气凝胶是典型的介孔材料。但是Co/RF碳气凝胶和SiO2/RF碳气凝胶与碳气凝胶的吸附-脱附等温线的吸附回线的类型明显不同,由H2型变为H1型,即孔的形状由墨水瓶形状变为管状,说明纳米SiO2和Co的加入对孔的结构有一定的影响。从图6、表1可以看出,Co/RF碳气凝胶较碳气凝胶比表面积及微孔体积有所增加,同时Co/RF碳气凝胶介孔体积稍有减小,说明负载3.56%的钴对制备得到的改性碳气凝胶介孔结构有一定的影响。对比SiO2/RF碳气凝胶和碳气凝胶,可以看出SiO2/RF碳气凝胶的比表面积和微孔体积明显减小,可能是由于纳米SiO2堵塞了部分微孔,同时说明本实验制备过程中加入纳米SiO2并未起到改善碳气凝胶的扩散通道的作用。因此,实验又研究了将制备得到的SiO2/RF碳气凝胶在HF溶液(15%)中浸泡24 h,目的是除去纳米SiO2,所得的材料记为SiO2/RF碳气凝胶 (HF浸泡后),其孔结构特性及吸附-脱附等温线见表1和图5d。从表1可见,去除纳米SiO2后,材料比表面积显著增加。相较于碳气凝胶及Co/RF碳气凝胶,该材料的总的比表面积也有所增加,同时孔结构也发生了变化,如介孔比表面积和体积增大,说明SiO2除去后介孔增多。此结果说明添加了纳米SiO2并未起到增大比表面积的作用,而将纳米SiO2去除后才起到造孔作用。

图5 4种碳气凝胶吸附-脱附等温线
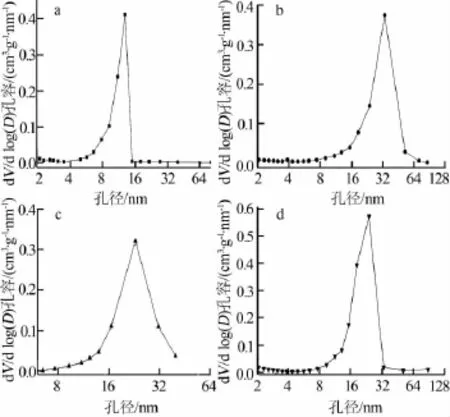
图6 4种碳气凝胶的孔径分布图
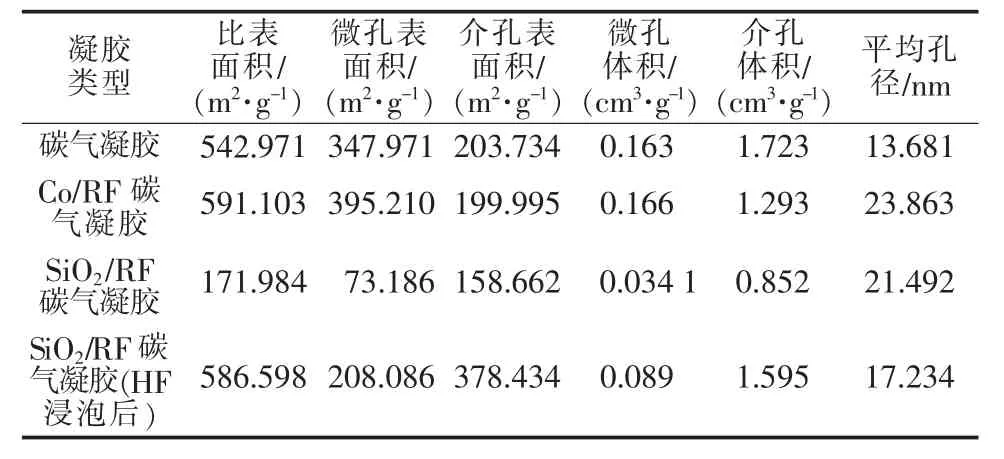
表1 碳气凝胶及改性碳气凝胶孔结构特性
2.2 吸附等温曲线
25℃下,根据平衡前后亚甲基蓝质量浓度的变化,绘制亚甲基蓝在碳气凝胶及改性碳气凝胶上的吸附等温曲线,并分别采用 Freundlich模型、Langmuir模型对吸附等温曲线(如下式)拟合,拟合曲线如图7所示,计算所得平衡常数及相关系数见表1。
Langmuir模型:Qe=QMbρe/(1+bρe) (2)Freundlich模型:Qe=KFρe1/n(3)
式中,b为Langmuir模型参数,mg/g;Qe为单位质量碳气凝胶吸附的溶质的量,mg/g;ρ0为溶液初始浓度,mg/L;QM为Langmuir模型参数;ρe为吸附剂吸附后溶液的平衡浓度,mg/L;KF为Freundlich模型参数,(mg/g)1/n;n为Freundlich模型参数。
由图7、表2可以看出,相对于Freundlich模型,采用Langmuir模型拟合4种碳气凝胶材料吸附等温曲线得到的相关系数较高,说明亚甲基蓝在碳气凝胶及改性碳气凝胶上的吸附符合单分子层吸附。从表2还可以看出,QM(Co/RF碳气凝胶)>QM[SiO2/RF碳气凝胶(HF浸泡后)]>QM(碳气凝胶)>QM(SiO2/RF碳气凝胶),这与图6中高浓度吸附平衡后Qe结果一致。根据Langmuir模型,QM为吸附质在吸附剂上理论最大吸附量,说明当碳气凝胶添加了Co元素后,有利于对亚甲基蓝的吸附;当加入纳米SiO2后,反而降低了吸附性能,这与表1中SiO2/RF碳气凝胶BET比表面积较小结果一致;当HF将纳米SiO2除去后,由于介孔的增多,QM增大说明吸附能力明显提高。

图7 25℃下拟合得到的4种碳气凝胶的吸附等温线

表2 亚甲基蓝在碳气凝胶上吸附等温方程参数
3 结论
为考察碳气凝胶及改性碳气凝胶的结构和吸附性能,制备了碳气凝胶、经硝酸钴浸渍改性碳气凝胶及加入纳米二氧化硅改性碳气凝胶,采用TG、XRD、SEM、氮气吸附法对碳气凝胶及改性碳气凝胶做了结构性能分析,同时对碳气凝胶及改性碳气凝胶吸附亚甲基蓝的吸附平衡数据进行非线性拟合。结果表明,碳气凝胶表面均布满孔隙并具有独特的三维网络结构;对SiO2/RF碳气凝胶,纳米二氧化硅均匀地分布在碳气凝胶内部;对Co/RF碳气凝胶,表面负载了约3.5%(质量分数)左右的含钴氧化物;制得的碳气凝胶和改性碳气凝胶是典型的介孔材料,钴和纳米二氧化硅的加入对孔结构造成一定影响,纳米SiO2的加入减少了比表面积和微孔体积,采用HF除去SiO2后,介孔比表面积和介孔体积增大;从吸附等温曲线及拟合参数可以看出,平衡吸附数据更好地符合Langmuir吸附等温方程,添加了钴元素后,有利于对亚甲基蓝的吸附,当加入纳米SiO2后,堵塞了微孔反而降低了吸附性能,采用HF将纳米SiO2除去后,由于介孔的增多,吸附能力明显提高。
[1] 刘源.常压干燥法制备炭气凝胶及其复合材料的研究[D].北京:北京化工大学,2012.
[2] Plantard G,Goetz V,Py X.A direct method for porous particle density characterization applied to activated carbons[J].Adv.Powder Technol.,2010,21(6):592-598.
[3] 杨海霞.炭气凝胶的制备及表征[D].哈尔滨:哈尔滨工业大学,2010.
[4] Chaichanawong J,Yamamoto T,Ohmori T,et al.Adsorptive desulfurization of bioethanol using activated carbon loaded with zinc oxide[J].Chem.Eng.J.,2010,165(1):218-224.
[5] Xu Yunhua,Guo Junchen,Wang Chunsheng.Sponge-like porous carbon/tin composite anode materials for lithium ion batteries[J].J. Mater.Chem.,2012,22(19):9562-9567.
[6] Hao Fengbin,Zhang Zhiwei,Yin Longwei.Co3O4/carbon aerogel hybrids as anode materials for lithium-ion batteries with enhanced electrochemical properties[J].Appl.Mater.Inter.,2013,5(17):8337-8344.
[7] Lv Guifen,Wu Dingcai,Fu Ruowen,et al.Electrochemical properties of conductive filler/carbon aerogel composites as electrodes of supercapacitors[J].J.Non-Cryst.Solids,2008,354(40/41):4567-4571.
[8] Lee Y J,Kim G P,Bang Y J,et al.Activated carbon aerogel containing graphene as electrode material for supercapacitor[J].Mater.Res. Bull.,2014,50:240-245.
[9] Aluigi A,Rombaldoni F,Tonetti C,et al.Study of methylene blue adsorption on keratin nanofibrous membranes[J].J.Hazard Mater.,2014,268:156-165.
[10] Wu Xinbo,Wu Dingcai,Fu Ruowen,et al.Preparation of carbon aerogels with different pore structures and their fixed bed adsorption properties for dye removal[J].Dyes and Pigments,2012,95(3):689-694.
[11] Chen Zhonghui,Fu Jianwei,Wang Mminghuan,et al.Adsorption of cationic dye(methylene blue)from aqueous solution using poly(cyclotriphosphazene-co-4,4′-sulfonyldiphenol)nanospheres[J]. Appl.Surf.Sci.,2014,289:495-501.
[12] 王婵,俞健,胡小娟,等.多孔材料负载型炭复合膜的制备研究进展[J].新型炭材料,2014,29(6):409-418.
[13] Yasnessya Hardjono,Sun,Hongqi,Tian Huyong,et al.Synthesis of Co oxide doped carbon aerogel catalyst and catalytic performance in heterogeneous oxidation of phenol in water[J].Chem.Eng.J.,2011,174(1):376-382.
Study on modification and adsorption application of carbon aerogels in dye wastewater
Shao Yan,Li Yibiao,Wang Hongyan,Liu Yunyan
(School of Chemical and Environment Engineering,Wuyi University,Jiangmen 529020,China)
The carbon aerogel and modified carbon aerogels,such as Co/RF aerogel and SiO2/RF aerogel were prepared by sol-gel method.Structure and thermal stability of carbon aerogel and modified carbon aerogels were characterized by TG,XRD,SEM,and nitrogen adsorption,respectively.The adsorption equilibrium data of methylene blue on carbon aerogels were fitted by using the Freundlich and the Langmuir models.Results showed that the carbon aerogels owned amorphous structure,the nano-silica evenly distribute inside the SiO2/RF aerogel,and Co/RF aerogel surface loaded with about 3.5%(mass fraction)cobalt oxide.The adsorption-desorption isotherms of adsorption loop change from H2 to H1 type due to the addition of Co and nano-silica.The fitting equilibrium isotherms and the equilibrium parameters of methylene blue on carbon aerogels both showed that Co elements were conducive to the adsorption of methylene blue.The adsorption performance decreased with addition of nano-silica.And the mesoporous pore and adsorption performance increased with the removal of nano-silica by HF.
carbon aerogel;modification;adsorption;methylene blue
TQ127.2
A
1006-4990(2015)08-0060-05
2015-03-24
邵琰(1986— ),女,讲师,博士,主要从事吸附、催化研究。
广东自然科学基金(2014A030310164);广东省青年创新人才类项目(自然科学类)(2014KQNCX158);五邑大学青年科研基金资助(NO 2013zk11);江门市基础理论与科学研究专项资助项目(20140080091212);五邑大学教学改革项目(JG2014023)。
联系方式:wyuchemsy@126.com

