硝酸法制备工业净化磷酸
贾旭宏,李 军
(中国民用航空飞行学院航空安全保卫学院,四川广汉618307;2.四川大学化学工程学院)
硝酸法制备工业净化磷酸
贾旭宏1,李 军2
(中国民用航空飞行学院航空安全保卫学院,四川广汉618307;2.四川大学化学工程学院)
考察了采用硝酸分解磷矿,以经过前处理所得的粗磷酸为原料制备工业级净化磷酸的工艺路线,并研究了粗磷酸中SO42-和NO3-的含量对净化磷酸品质的影响。以磷酸三丁酯为萃取剂净化粗磷酸,制备出了SO42-含量符合GB 2091—1992《工业磷酸》三等品、Fe含量符合GB 2091—1992一等品要求的净化磷酸。粗磷酸中SO42-质量分数≤0.4%时可制得符合GB 2091—1992二等品的工业净化磷酸,SO42-质量分数为0.4%~1.0%时可制得符合GB 2091—1992三等品的净化磷酸;粗磷酸中质量分数低于2.0%的NO3-对产品磷酸品质基本不产生影响。
硝酸;净化磷酸;萃取;铁离子;硫酸
传统的硫酸法湿法磷酸制备工艺会产生大量的磷石膏,然而由于种种原因磷石膏的利用率很低,目前主要采取简单的堆积方式处理[1]。这不仅会占用大片宝贵的土地资源,而且会对环境造成严重破坏。硝酸分解磷矿不产生磷石膏,而且具有分解速率快、浸取率高、生成物具有可溶性从而可避免包裹现象等优势。因此,利用硝酸代替硫酸分解磷矿,进一步纯化分离,得到精制磷酸盐产品,是行业亟需解决的课题。
采用硝酸分解磷矿,经过冷冻结晶、硫酸除钙、萃取除硝酸以及蒸发浓缩等工艺,可以制备出P2O5质量分数达43.90%且基本不含硝酸的粗磷酸[2-3]。然而,湿法磷酸中的杂质众多,想要得到纯度更高的磷酸需采用其他净化手段做进一步处理。逐一除净粗磷酸中的所有杂质需要的工序十分繁琐,在工业上难以实现。溶剂萃取法具有可将目标产物从混合物中一次性分离出来的优势,因此笔者研究采用溶剂萃取法制备净化磷酸[4]。食品级或工业级湿法磷酸中的铁和硫酸根很难除去,但这2个指标却又极为重要。本研究与传统的湿法磷酸净化工艺最大的区别就是采用硝酸代替硫酸来分解磷矿,酸解液中不存在硫酸根,仅在后续工艺中除钙时引入了少量的硫酸。因此,研究粗磷酸中铁和硫酸根的含量对净化磷酸品质的影响就显得十分必要。
1 实验部分
1.1 原料、试剂与仪器
原料:实验所用原料为采用硝酸分解湖北某磷矿,经冷冻结晶、硫酸除钙、萃取除硝酸以及蒸发浓缩等工艺制得的粗磷酸,其主要成分如表1所示。

表1 粗磷酸的化学组成 %
试剂:硝酸(分析纯)、磷酸(85%,工业级)、硫酸(98%,工业级)、磷酸三丁酯(TBP,工业级)。
仪器:UC-1100型紫外可见分光光度计、HZSH型水浴振荡器、HZ85-2型磁力搅拌器、PHSJ-4A型pH计、PNO3-1型硝酸根离子电极、锥形瓶、分液漏斗等。
1.2 分析方法
实验过程中,五氧化二磷含量采用磷钼酸喹啉重量法[5]测定;硝酸根含量采用离子选择性电极法[6]测定;硫酸根采用吸光光度比浊法[7-8]测定;铁离子含量采用邻菲罗啉比色法测量[9]。
1.3 实验方法
准确量取50 mL水相料液,称量后加入500 mL的磨口锥形瓶;量取200 mL配制好的有机相加入锥形瓶中,盖好瓶盖后置于加热至预先设定温度的恒温水浴锅内振荡萃取。待萃取达到平衡后将混合液移至250 mL的分液漏斗分相,分相完成后分别收集负载有机相和萃余液。萃余液称量后作为样品测量各成分的含量,有机相则留待后续洗涤工艺使用。
2 结果与讨论
2.1 萃取实验结果
以TBP为萃取剂采用溶剂萃取法制备净化磷酸的方法已十分成熟,且已实现工业化生产[10-12],因此本实验采用溶剂萃取法净化湿法磷酸。溶剂萃取法净化湿法磷酸的工艺流程主要分为萃取、洗涤、反萃3个部分。
2.1.1 萃取部分
以TBP为萃取剂,无味煤油为稀释剂,有机相中TBP的体积分数为75%。根据本课题组之前的研究成果[13],确定萃取条件:相比(O/A)为4∶1、温度为50℃、振荡速率为300 r/min、萃取时间为30 min。
以粗磷酸为原料,根据上述条件进行萃取实验,并分析萃余液中各成分的含量,如表2所示。
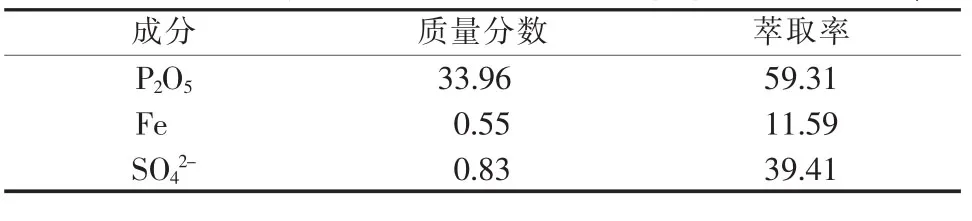
表2 萃余液组成及萃取率 %
由表2可知,TBP对P2O5的萃取率达到59.31%,该数值略低于文献报道值[13]。究其原因,主要是因为本实验所采用的粗磷酸中P2O5的含量较低,且基本不含H2SO4,无同离子效应。另外,TBP对Fe和SO42-均有一定的萃取率,这就需要洗涤负载有机相以除去大部分杂质。
2.1.2 洗涤部分
由于TBP对Mg2+、Al3+、Fe3+、F-、SO42-等杂质均有一定的萃取能力[14],如果直接对负载有机相进行反萃取,则会有大量杂质进入反萃液,导致产品质量下降。因此,在反萃取之前必须对负载有机相进行洗涤。
根据前人的研究结果[13],洗涤剂采用分析纯磷酸配制而成的稀磷酸溶液,其中P2O5含量应与萃取有机相平衡的萃余液中P2O5含量相当。实验中萃余液P2O5的质量分数为33.96%,因此配制的洗涤剂中P2O5的质量分数约为34%。在相比为10∶1、温度为50℃的条件下振荡洗涤3次,然后进行反萃取,根据反萃液中杂质的含量来评价洗涤效果。反萃酸、浓缩产品及国家标准 GB 2091—1992《工业磷酸》[8]中的部分杂质含量如表3~5所示。
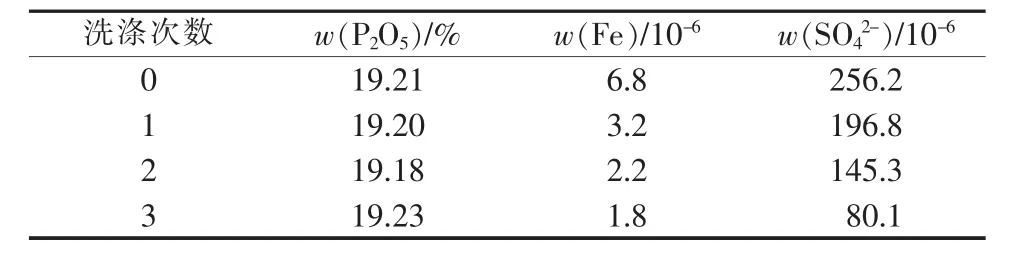
表3 洗涤次数对反萃液品质的影响

表4 洗涤次数对磷酸产品品质的影响 %
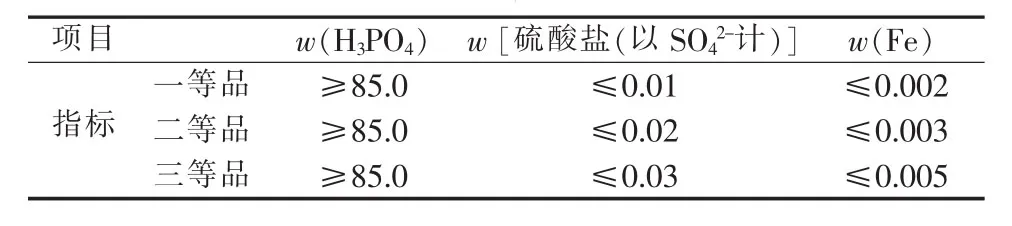
表5 GB 2091—1992《工业磷酸》指标要求 %
由表3~5可以看出,负载有机相不经洗涤直接进行反萃取,则反萃酸中的硫酸盐含量超标,而铁含量可以达到GB 2091—1992二等品要求。经1次以上洗涤,产品中铁含量即可达到GB 2091—1992一等品标准,而硫酸盐在经过3次洗涤的反萃酸中含量才能达到GB 2091—1992三等品标准。由此可见,洗涤工艺十分必要。
2.1.3 反萃部分
将负载有机相在上述条件下洗涤3次,再用蒸馏水反萃取。反萃条件:相比为5∶1、温度为50℃、反萃时间为30 min。经过单次反萃取,反萃液中P2O5的质量分数为20.12%,反萃取率达63.54%。反萃液经蒸发浓缩后P2O5质量分数达到61.83%(以H3PO4计为85.34%),其中铁的质量分数为0.000 6%,优于GB 2091—1992一等品(≤0.002%)的要求;硫酸盐的质量分数为0.026%,达到GB 2091—1992三等品(≤0.03%)的要求。采用硝酸分解磷矿制备工业级净化磷酸,无需除硫工艺即可制得满足工业三等品标准的磷酸产品。
2.2 粗磷酸中的杂质对净化磷酸品质的影响
相较于传统的硫酸法湿法磷酸净化工艺,笔者提出的工艺流程与之最大的区别在于用于制备净化磷酸的粗磷酸中几乎不含硫酸。然而,由于除钙工艺引入了硫酸,所以有必要考察粗磷酸中硫酸含量对产品品质的影响。另外,考虑到反萃酸需要经过蒸发浓缩才能得到产品酸,而硝酸具有易挥发的性质,因此粗磷酸中存在少量的硝酸将不会进入产品酸,这样便无需将粗磷酸中的硝酸除净。然而,鉴于氯离子可与铁离子形成络合物,从而大大提高TBP对铁离子的萃取率[15],硝酸根的存在亦有可能提高TBP对铁离子的萃取能力,进而影响产品酸中的铁含量。所以,研究粗磷酸中硝酸含量对产品磷酸品质的影响十分必要。
2.2.1 硫酸根含量对磷酸产品品质的影响
由于TBP对硫酸根有一定的萃取能力,粗磷酸中硫酸根含量的高低直接影响着产品酸中硫酸盐的含量。掌握硫酸根含量对产品酸中硫酸盐及铁含量的影响规律,即可通过调整粗磷酸的品质来控制产品酸的品质。根据本文前述所得研究结果,粗磷酸中的硫酸根质量分数约为0.83%,因此本实验研究了硫酸根质量分数分别为 0.2%、0.4%、0.6%、0.8%、1.0%、1.2%、1.4%、1.6%时对磷酸产品品质的影响。
以前述工艺条件进行萃取,再对负载有机相洗涤3次,反萃取后将反萃液浓缩至H3PO4的质量分数≥85%,分别测定反萃液和产品酸中Fe3+和SO42-的含量,结果见图1及表6。
由图1和表6可知,随着粗磷酸中硫酸根含量的增大,反萃液中硫酸根含量呈线性增长,而铁含量基本保持不变。这说明SO42-不能与Fe3+形成易被TBP萃取的络合物,粗磷酸中的SO42-含量仅影响产品酸中的硫酸盐含量。另外,粗磷酸中SO42-质量分数≤0.4%时可制得符合GB 2091—1992二等品的工业净化磷酸,SO42-质量分数为0.4%~1.0%时可制得符合GB 2091—1992三等品要求的产品。在整个研究范围内,产品酸中Fe3+含量均达到工业净化磷酸国家标准一等品的要求。

图1 硫酸根含量对反萃液中SO42-和Fe3+含量的影响
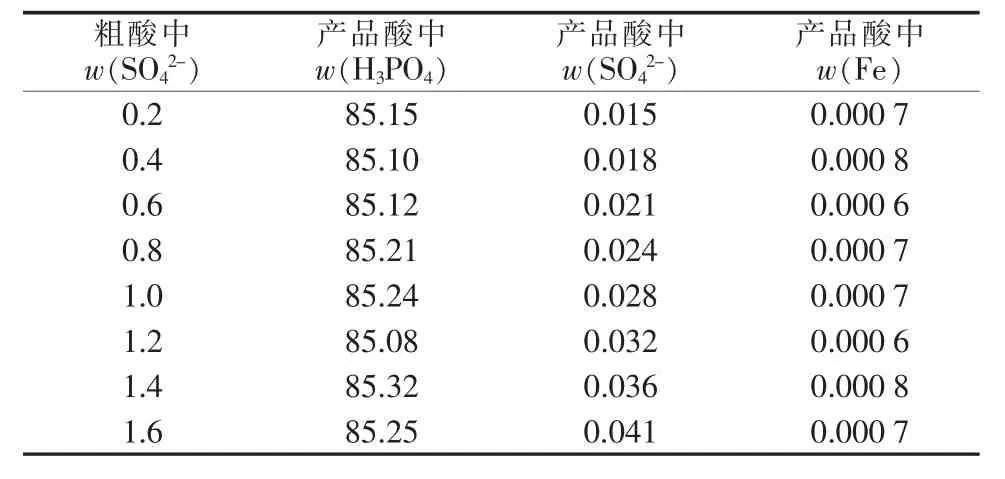
表6 硫酸根含量对磷酸产品品质的影响 %
2.2.2 硝酸根含量对磷酸产品品质的影响
三辛胺(TOA)几乎可以将硝酸分解磷矿所得酸解液中全部的硝酸萃取除去,粗磷酸中硝酸根质量分数仅为0.04%。由于粗磷酸中硝酸含量过高会导致产品酸中含有一定量的硝酸,从而影响产品酸的质量,因此本实验仅对粗磷酸中硝酸质量分数≤2.0%时其对净化磷酸品质的影响做了研究。
依照前述工艺条件对料液进行萃取,将负载有机相洗涤3次后反萃取,取一小部分反萃液留待分析,将剩余反萃液浓缩至w(H3PO4)≥85%以制成产品酸,分别测定反萃液和产品酸中Fe3+和SO42-的含量,结果如图2及表7所示。
由图2和表7可知,随着粗磷酸中硝酸根含量的增大,萃余液中硫酸根含量及铁含量均基本保持不变。这说明NO3-也未与Fe3+形成易被TBP萃取的络合物,粗磷酸中的NO3-含量对产品磷酸品质基本不产生影响。
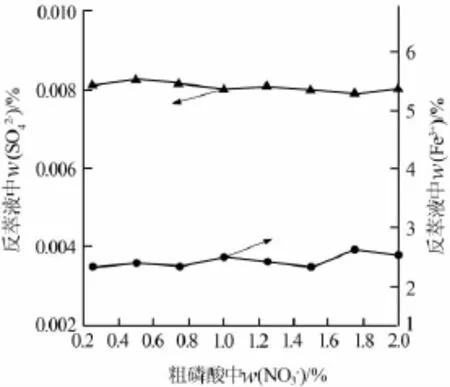
图2 硝酸根含量对反萃液中SO42-和Fe3+含量的影响
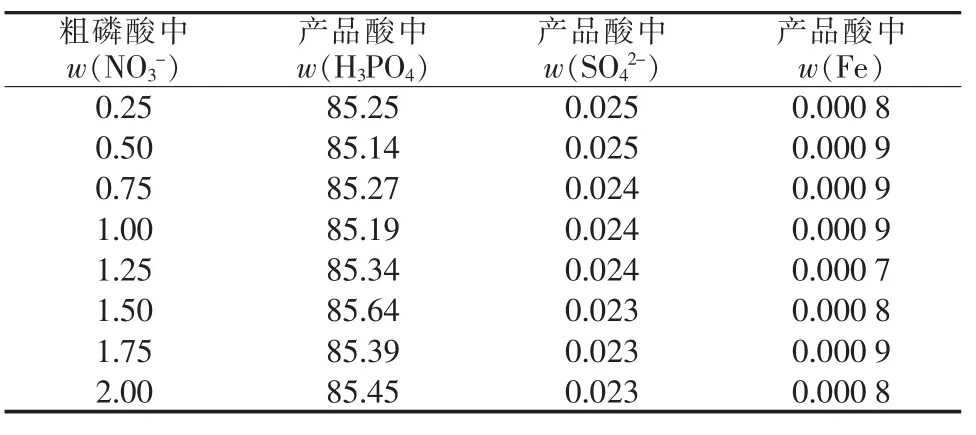
表7 硝酸根含量对磷酸产品品质的影响 %
3 结论
实验考察了以硝酸分解磷矿,经前处理后所得粗磷酸为原料萃取制备工业净化磷酸的工艺路线,并对粗磷酸中SO42-与NO3-含量对产品磷酸品质的影响做了研究。得到结论:
1)以TBP为萃取剂,采用溶剂萃取法净化粗磷酸,经过萃取、3次洗涤、反萃取等工艺,制备出了SO42-含量符合GB 2091—1992三等品要求、Fe3+含量符合GB 2091—1992一等品要求的净化磷酸。2)随着粗磷酸中硫酸根含量的增大,反萃液中硫酸根含量呈线性增长,而铁含量基本保持不变。粗磷酸中w(SO42-)≤0.4%时可制得符合GB 2091—1992二等品标准的工业净化磷酸,w(SO42-)=0.4%~1.0%时可制得符合GB 2091—1992三等品标准的磷酸。产品酸中Fe含量达到GB 2091—1992一等品的要求。3)随着粗磷酸中硝酸根含量的增大,反萃液中硫酸根含量及铁含量均基本保持不变,粗磷酸中的NO3-含量对产品磷酸品质基本不产生影响。
[1] Li Xibing,Zhou Zilong,Zhao Guoyan,et al.Utilization of phosphogypsum for backfilling,way to relieve its environmental impact[J]. Gospod.Surowcami.Min.,2008,24:225-231.
[2] 李军,贾旭宏,姜振胜,等.硝酸分解中低品位磷矿制备工业级磷酸的方法:中国,102718200A[P].2012-10-10.
[3] Jia X H,Li J,Jin Y,et al.Extraction of the nitric acid from wet-pro
cess phosphoric acid[J].Sol.Extr.Res.Dev.,JP.,2013,20:183-195.[4] 江善襄,方天翰,戴元法,等.磷酸、磷肥和复混肥料[M].北京:
化学工业出版社,1999.
[5] ISO 3706—1976 Phosphoric acid for industrial use(including foodstuffs)-Determination of total phosphorus(V)oxide content-quinoline phosphomolybdate gravimetric method[S].
[6] 黄丽.离子选择性电极法直接测定水质中硝酸盐氮[J].中国公共卫生,1999,15(3):220.
[7] 赵声兰,陈朝银.湿法磷酸中硫酸根含量的测定[J].理化检验:化学分册,1999,35(3):22-123.
[8] GB 2091—1992工业磷酸[S].
[9] 林乐,魏文彦,陈玉如,等.磷铵生产分析[M].成都:成都科技大学出版社,1991.
[10] 钟本和,陈亮,李军,等.溶剂萃取法净化湿法磷酸的新进展[J].化工进展,2005,24(6):596-602.
[11] Moussa A.Extraction of phosphoric acid from various aqueous solutions using tributyl phosphate(TBP)[J].Per.Pol.Chem.Eng.,2007,51(1):39-42.
[12] 钟本和,李军,郭孝东,等.湿法磷酸净化技术研究现状及发展方向[J].无机盐工业,2008,40(2):9-12.
[13] 黄美英.溶剂萃取法净化湿法磷酸工艺研究[D].成都:四川大学,2004.
[14] 龚海燕.杂质对磷酸萃取过程的影响研究[D].成都:四川大学,2006.
[15] 金央.盐酸法湿法磷酸的净化研究[D].成都:四川大学,2012.
联系方式:lijun@scu.edu.cn
Preparation of industrial purified phosphoric acid by nitric acid route
Jia Xuhong1,Li Jun2
(1.School of Aviation Security,Civil Aviation Flight University of China,Guanghan 618307,China;2.College of Chemical Engineering,Sichuan University)
The process for preparing industrial purified phosphoric acid by crude phosphoric acid obtained from decomposing of phosphate rock with nitric acid was investigated,and the effects of SO42-and NO3-concentrations existed in the crude phosphoric acid on the quality of product were also studied.The purified phosphoric acid,in which the SO42-and Fe contents accorded with the third grade and first grade of the national standard for Industrial Phosphoric Acid,GB 2091—1992,respectively,was prepared by using TBP as extracting agent.The purified phosphoric acid according with the second grade and third grade of GB 2091—1992 could be prepared when the SO42-mass fraction in the crude phosphoric acid was less than 0.4% and of 0.4%~1.0%,respectively.It had almost no negative effect on the product when the NO3-mass fraction in the crude phosphoric acid was less than 2.0%.
nitric acid;purified phosphoric acid;extraction;ferric ion;sulfuric acid
TQ126.35
A
1006-4990(2015)08-0056-04
2015-02-17
贾旭宏(1985— ),男,工学博士,讲师,主要从事萃取分离技术的研究,已在国内外知名期刊发表论文20余篇,其中SCI 5篇。
李军

