神经成像数据的元分析*
胡传鹏 邸 新 李佳蔚 隋 洁 彭凯平
(1清华大学心理学系,北京 100084)(2Department of Biomedical Engineering,New Jersey Institute of Technology,Newark,NJ,USA 07102)
1 引言
认知神经科学的基本问题之一是寻找认知活动与大脑活动之间的关系。在过去的20年里,借助高空间分辨率的无创性神经成像技术,如功能性核磁共振成像(functional magnetic resonance imaging,fMRI)和正电子发射计算机断层扫描成像(position emission computerized tomography,PET),认知神经科学得到迅猛发展。fMRI技术的普及,带来fMRI研究报告数量的激增。如果使用带双引号的关键字“functional magnetic resonance imaging”在PubMed中搜索,会发现文章的数量从上世纪90年代初的个位数,增至到了近年来每年2000多篇(见图1)。文献数量的激增固然大大推进对人脑功能的认识,为理解人脑结构与功能提供大量的实证数据,同时也增加了在大量文献中提取有用信息的难度——因为研究相似问题的多篇文献并不一定报告相同的结果。从大量已发表的研究中推断出可靠的结论不仅需要研究者的经验,也需要适当的统计方法。元分析(meta-analysis)方法正是研究者常用来对文献进行客观量化分析的方法之一。
在神经成像领域,使用元分析方法的一个迫切的原因在于,单个神经成像研究可能存在假阳性和假阴性的问题(Yarkoni,Poldrack,van Essen,&Wager,2010)。假阳性指的是零假设为真时但却被拒绝的情况,这种没有效应但却在统计上发现显著结果的现象,也称为假设检验中的第一类错误(type I error)。假阴性指零假设为假却被接受的情况,即错误地接受零假设,也称为假设检验中的第二类错误(type II error)。神经成像研究中,假阳性率过高很大程度上是由于数据分析中多重比较的校正不足(Wager,Lindquist,&Kaplan,2007)。此外,在神经成像实验中,从数据收集到数据分析的全过程均存在多种可能的做法,且没有公认的标准。例如,样本量是否基于统计检验力(statisitical power)进行选择,数据预处理中是否使用空间平滑(spatial smoothing),甚至是否呈现基于体素的大脑图。这些方法上的灵活性也可能导致假阳性出现的可能性增加(Carp,2012)。神经成像研究中假阴性率高的主要原因则是样本量过少而导致统计检验力偏低,无法检测出真正存在的效应(Button et al.,2013)。因此,需要适当的手段来解决神经成像研究中的假阳性和假阴性问题,而元分析正是其中一种有效的方法。
在心理学研究中,传统的元分析方法主要是基于效应量(effect size)的统计分析。在神经成像的元分析中,也有部分研究者沿用这种思路(Davidson&Heinrichs,2003)。认知神经科学的主要研究问题是寻找认知加工过程与大脑空间位置的对应关系,且神经成像研究通常报告的是几种条件对比(contrast)下激活脑区的峰值坐标(即激活峰值点,foci)。从这个角度来讲,寻找多个研究中激活位置的一致性更加符合当前神经成像研究的特点。因此,基于文献报告的坐标数据而进行的元分析(coordinates-based meta-analysis,CBMA)逐渐成为神经成像数据元分析的主流。
基于坐标的元分析方法主要是通过对文章中报告的坐标值进行统计来寻找空间位置的一致性。这种分析方法不仅可以对功能成像结果和结构成像结果(如Voxel-based morphometry,VBM)进行元分析,还能比较结构像与功能像结果(Di,Rypma,&Biswal,2014)。本文将以最常用的元分析方法——激活可能性估计法(Activation Likelihood Estimation,ALE)为例,介绍功能成像数据元分析的原理、分析思路及其新发展——脑连通性元分析模型(MACM),对结构数据元分析感兴趣的读者可以参考Laird等(2009)。
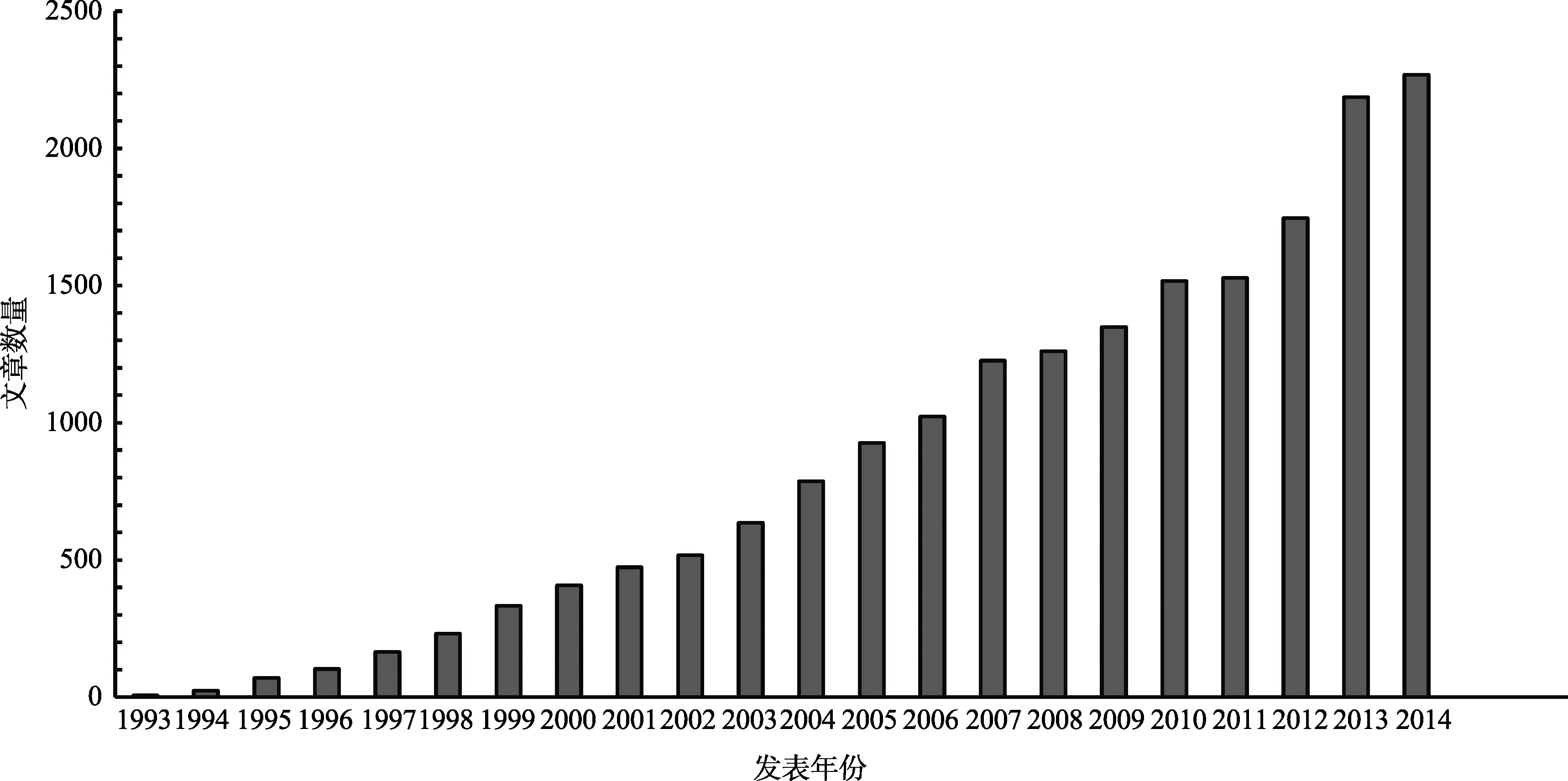
图1 Pubmed中以 “functional magnetic resonance imaging”为关键词检索到的文章数量与发表年份的关系(搜索日期2014.10.30)
2 ALE元分析方法的原理
ALE的基本原理是计算每个实验中每个体素在某种条件下被激活的可能性并对此进行统计(Chein,Fissell,Jacobs,&Fiez,2002;Turkeltaub,Eden,Jones,&Zeffiro,2002)。具体而言,ALE方法首先分别计算每个实验中某种条件下全脑范围内每个体素的激活可能性(Activation Likelihood),然后检验体素跨实验激活的稳定性。神经成像文献中通常报告激活脑区中激活值最大的点坐标,但实际的激活脑区是由数十数百体素组成。因此在进行元分析时,需要将点坐标还原为一定体积的3D空间,以更好地模拟激活的脑区。为了达到这一目的,ALE方法对全脑的体素被包含在某个激活峰值点所代表脑区的可能性进行如下假设:这种可能性是以激活峰值点为中心,呈3D高斯分布。在这个分布中,靠近激活峰值点位置的体素的激活可能性高,而距离激活峰值点较远的体素的激活可能性低。基于这一思路,ALE方法可以计算出全脑范围每个体素的激活可能性。以激活可能性为指标,ALE方法可以计算每个体素跨实验激活的可能性,并对这种可能性进行假设检验,从而得到多个实验中大脑激活的一致性。
神经成像数据元分析主要目的在于探索多个实验之间的一致性,所以元分析需要回答的核心问题是:研究相似问题的实验所报告的激活脑区是否有重合?在早期的ALE算法中,以激活峰值点为单位,将全部以激活峰值点为中心的全脑激活概率进行逐体素的联合。这种以激活峰值点为单位而不是以实验为单位的元分析方法,忽略了实验之间的变异,因而从统计角度来讲是固定效应的统计推断(fixed-effects inference),即元分析的结论不能推广到该元分析未包括的实验。在随机效应推断(random-effect inference)的ALE算法中,以每个实验为单位来计算该元分析的激活分布图(Eickhoff et al.,2009)。随机效应推断使得元分析结果不仅可以适用于元分析中涉及到的实验,还可以推广到未被包括到元分析中的实验结果。
为估计每个体素在某种条件下跨实验激活的可能性,ALE方法首先分别计算每个实验的“模型化激活图”(modeled activation map,MA)。具体而言,ALE方法通过如下两步来计算单个实验的MA图。首先,通过3D高斯模拟计算每个体素被包括在每个激活峰值点所代表脑区的概率。假设Xi表示的是某个体素被包含在第i个激活峰值点所代表的脑区之中,那么Xi发生的概率为(Turkeltaub et al.,2002):

其中di是指从体素的中心位置到第i个激活峰值点的几何距离;σ为高斯分布的标准差,这个值的大小与fMRI数据平滑处理中FWHM有关,可以根据被试样本量和所使用的大脑模板之间的差异进行调整(Eickhoff et al.,2009)。这样得到的Pr(Xi)的取值范围为[0,1]。为了更好地适应神经成像数据的特点,Laird,Fox等(2005)将ALE值扩展到整个体素而不仅是其中央点,将Turkeltaub等(2002)的概率值乘以DV=8 mm3(与体素的大小2 mm×2 mm×2 mm相应)。然后,以体素为单位,联合单个体素被包含在该实验中每个激活峰值点的概率其中Pr(Xi)为该体素被包含在第i个激活峰值点的概率),得到该实验的MA图。
计算出每个实验的MA图之后,ALE方法对每个实验的MA图以体素为单位进行联合,从而得到每个体素跨实验的激活可能性。随后对每个体素跨实验的激活可能性进行显著性检验。ALE方法的零假设(null hypothesis)是:元分析中各实验的MA图之间没有重合,所有的重合均是随机因素导致。在最新的算法中,将每个实验MA图按照每个体素的MA值进行排列后转化为直方图,从而得到包含每个体素有效MA值但不包括该体素空间位置信息的直方图(Eickhoff,Bzdok,Laird,Kurth,&Fox,2012)。随后,将每个实验MA图的直方图进行相继联合得到零假设分布。具体而言,先将两个实验MA图的直方图整合起来得到联合的直方图。然后,将此联合直方图与第三个实验MA图的直方图整合,直到将所有实验的MA图的直方图均整合起来,得到零假设的分布。
计算出跨实验的MA图和相应的零假设分布图之后,即可进行显著性检验,即检验每个体素实际的跨实验激活可能性与零假设分布中相应的激活可能性是否有显著差异。显著性检验后,每个体素均会得到统计检验的p值。如果p值小于一个特定的阈值,则可拒绝零假设,认为此体素确实出现在至少一个激活峰值点所代表的脑区内。为克服多重比较带来的假阳性问题,研究者们使用严格的多重比较校正方法,如错误发现率法(false discovery rate,FDR)(Laird,Fox,et al.,2005)和族错误率法(familywise error rate,FWE)(Eickhoff et al.,2012)。对于经过严格的FDR或者FWE方法检验后得到显著结果的体素,其意义就是:在元分析的多个实验中,此体素稳定地被激活。
为了得到显著激活的脑区,ALE方法根据每个体素的p值,找出显著且空间上相连的体素,即体素簇(cluster)。ALE方法会记录下这些簇的统计指标,包括体积、界限、中心坐标和该区域内峰值ALE值。显著激活的簇可以通过现有的大脑图谱工具包(如SPM Anatomy Toolbox,(Eickhoff et al.,2005))进行标记,从而得到显著激活的脑区解剖位置。
早期的ALE元分析方法只能从多个文献中寻找到一致的激活结果,但在元分析过程中,研究者可能需要比较多个元分析的结果来寻找不同条件下激活脑区的异同(见本文第3节)。因此,Laird,Fox等(2005)对ALE元分析方法进行了扩展,发展出可以比较两个ALE元分析结果的算法。其原理与上述的过程类似,区别在于比较两个元分析结果时,统计的指标不是每个体素的ALE值,而是两种条件下每个体素ALE值的差值。与此相应,零假设分布是在两种条件的激活峰值点位置随机的情况下,每个体素ALE值的差值。比较两种条件下ALE值差异图与随机产生ALE值差异图,可以得到一种条件下比另一条件下更加激活的脑区。对元分析结果的差异分析,为研究者更深入的分析提供了有效的工具。
其他基于坐标的元分析方法,如多水平核密度分析法(Multi-level Kernel Density Analysis,MKDA)(Wager,Lindquist,Nichols,Kober,&van Snellenberg,2009)和差异图标记分析法(Signed Difference Map analysis,SDM)(Radua,van den Heuvel,Surguladze,&Mataix-Cols,2010),与ALE方法的原理基本类似。MKDA主要是统计以激活脑区峰值坐标为中心,以r为半径的球(核)内,激活的密度分布值。通过已有研究中报告的坐标,MKDA根据高斯分布来计算出每个体素的激活密度分布后,将每个体素上的密度值与随机产生的零假设分布进行比较来进行显著性检验,并使用多重比较校正来控制假阳性。而SDM方法本质上是对ALE方法的改进,仍然采用3D的高斯分布来对每个体素上可能出现激活峰值点的可能性进行计算并联合。但SDM的一个新特点是可以保留正性和负性的激活结果,这样可以避免两种不同的激活在位置上重叠而被误当作是激活的重叠。
自2002年ALE方法首次提出(Chein et al.,2002;Turkeltaub et al.,2002)后,研究者们迅速将其与脑结构和功能成像数据库Brainmap(Fox&Lancaster,2002;Laird,Lancaster,&Fox,2005)进行整合,形成一套非常成熟、便利的元分析系统(Laird et al.,2011;Laird et al.,2009)。这套元分析系统的三个桌面软件让研究者可以非常便利地与Brainmap数据库进行交互:Sleuth可以在Brainmap数据库内搜索文献信息及其元数据(metadata,包括实验中各条件下对比的激活峰值点坐标);Scribe可以向数据库提交新的文献元数据;GingerALE软件则基于文献的元数据使用ALE方法进行元分析。目前,Brainmap数据库中收录的每个研究均经过数据库维护人员的筛选,通过多种线索进行编码以方便检索。元分析软件GingerALE使用ALE算法,并且增加了簇分析程序,从而能够更好地将功能空间与生理解剖进行对应(Laird et al.,2009)。随着ALE方法的不断改进,GingerALE也不断地更新其算法,将最新的ALE元分析方法整合进来(Turkeltaub et al.,2012)。GingerALE软件可以结合Brainmap数据库使用,也可以单独使用来进行元分析。由于统计方法的合理性和使用的便利性,ALE元分析方法成为最广泛使用元分析方法。
3 神经成像数据元分析的研究思路
神经成像数据元分析基于大量神经成像数据,不仅可用来总结已有的研究成果,还可以通过挖掘已有文献的数据,来解决实验或者理论中的争论(Buhle et al.,2014)、帮助形成新的研究假设(Roy,Shohamy,&Wager,2012)等。作为一种基于数据的研究方法,其研究思路已经超越了传统的元分析,应用于多种研究目的(Fox,Lancaster,Laird,&Eickhoff,2014)。然而,在元分析的应用中,有两种最基本的研究思路:寻找相同或相似研究任务所得到大脑激活结果的一致性,以及寻找影响大脑激活的调节变量。前一种研究思路使用常规的元分析方法即可达到,而后一种则需要使用差异分析和联合分析(conjunction analysis)的方法。
神经成像研究结果不仅受到实验自变量的影响,而且还可能受到许多其他因素的干扰,即使采用相同的实验设计,其结果也可能会存在一些差异,因此十分有必要去区分自变量的影响与随机变量的混淆。例如,研究者很早就发现,人们在记忆任务中存在着自我参照效应(self-reference effect),即当被试以自我为参照时,其记忆结果好于深度加工条件下的记忆结果(Rogers,Kuiper,&Kirker,1977)。神经成像技术出现后,研究者们采用自我参照的范式,探索了自我参照加工的神经基础(Kelley et al.,2002;Ochsner et al.,2005;Pauly, Kircher, Schneider, & Habel, 2014;Vanderwal,Hunyadi,Grupe,Connors,&Schultz,2008;Wang et al.,2012;Zhu,Zhang,Fan,&Han,2007)。由于不同实验之间的差异,大脑中是否存在一个专门用来加工“自我”的网络结构仍然非常受到争议(Gillihan&Farah,2005;Legrand&Ruby,2009)。为解决这种争议,寻找自我参照加工范式下激活脑区的一致性,研究者们对采用自我参照范式的神经成像研究进行元分析。Northoff等(2006)首先通过半量化的元分析方法,发现皮质中线结构(cortical midline structures,CMS)在自我参照加工中一致地激活。后续研究采用ALE方法(Araujo,Kaplan,&Damasio,2013)或者 MKDA方法(Qin&Northoff,2011)对自我参照加工的神经成像研究进行了元分析,均发现皮质中线结构在自我参照加工中被激活,肯定了这些大脑结构在自我参照加工中的作用。
当研究者了解关于某一认知过程所激活的脑区后,还希望进一步探索该过程所激活脑区与其他认知过程激活脑区的差异,以寻找调节某些脑区激活的变量。这种情况下,研究者需要比较两个或以上元分析的结果。仍然以自我参照加工为例,由于人们通常对与自己相关的信息更熟悉,有研究者认为,对自我相关信息加工的特异性是由熟悉性所导致(Tong&Nakayama,1999)。为了分离自我特异性与熟悉性的差异,研究者直接比较自我相关信息与熟悉的他人相关信息加工的异同,发现即使对非常熟悉的他人,自我相关信息仍表现出优势(Platek et al.,2006;Sui,He,&Humphreys,2012)。Qin等(2012)结合神经成像和MKDA元分析方法,发现自我特异性加工的脑区主要在大脑前部,如前扣带回(anterior cingulate cortex,ACC)、前岛叶(anterior insula cortex,AIC),而熟悉性相关的脑区则主要在后部如后扣带回(posterior cingulate cortex,PCC),从而从神经层次上区分了自我特异性与熟悉性之间的差异。其他元分析也得到了相似的结果(Araujo et al.,2013;Murray,Schaer,&Debbané,2012)。
在比较不同任务或心理活动所激活的脑区时,研究者不仅关心不同任务下脑区激活的差异,也会关心这些任务共同激活的脑区。在神经成像研究中,获得几种任务下共同激活脑区的分析方法被称为联合分析(conjunction analysis)(Price&Friston,1997)。例如,在奖赏相关的研究范式中,通常包括奖赏线索呈现阶段和奖赏结果呈现阶段,这两个阶段中激活的脑区是否完全相同?Diekhof,Kaps,Falkai和Gruber(2012)在元分析中使用联合分析方法探索了这个问题,发现两个阶段中,腹侧纹状区(ventral striatum)均有激活。在奖赏研究中,另一个有趣的问题是初级奖赏(如食物、性相关的刺激)与次级奖赏刺激(如金钱)所激活的脑区有何异同?Sescousse,Caldú,Segura和Dreher(2013)使用元分析对这两种奖赏刺激进行了比较,发现初级奖赏刺激与次级奖赏刺激共同激活了腹内侧前额叶(ventromedial prefrontal cortex,vmPFC)、腹侧纹状区、杏仁核(amygdala)、前岛叶等脑区。但不同的奖赏刺激之间也有显著的差异:金钱这种次级奖赏刺激更多地激活了眶额皮层(orbitofrontal cortex,OFC)前部,而食物和色情刺激等初级奖赏刺激分别更多地激活了前岛叶和杏仁核,表明初级奖赏刺激与次级奖赏刺激之间存在着差异。此外,还可以在结构像与功能像结果之间进行联合分析,探索结构与功能之间的关系。例如,Di等(2014)对功能成像数据和结构成像数据进行了联合分析,发现在老化过程中执行功能引起的背外侧前额叶(dorsolateral prefrontal cortex,DLPFC)激活增加与该区域灰质的减少相关。
4 脑连通性元分析模型(MACM)
近年来脑成像数据元分析研究的一个热门趋势是进行功能连通性分析。这类方法最早于2005年提出(Lancaster,Laird,Fox,Glahn,&Fox,2005;Neumann,Lohmann,Derrfuss,& von Cramon,2005),神经成像领域两方面的进展促成了脑连通性元分析模型(Meta-analytic connectivity modeling,MACM)的流行:一方面是大量结构成像和功能成像数据库的出现,例如Brainmap(Fox&Lancaster,2002;Laird,Lancaster,et al.,2005)数据库;另一方面是大脑连通性研究特别是静息态(resting-state)连通性研究的流行(Biswal,Yetkin,Haughton,&Hyde,1995;Stern,2013;van Essen,2013)。通过这些数据库,研究者可以相对容易地对某个脑区在任务状态下的激活情况进行分析。
MACM的基本逻辑是,如果两个脑区在功能上是相关的,那么它们也更可能被同一个任务激活。因此,通过计算不同脑区在神经成像实验报告中共同出现 (co-occurrence)的概率就能反映脑区间的功能连通性情况。目前大部分MACM分析都是使用ALE的分析框架。研究思路通常是先定义一个感兴趣区域,然后在Brainmap数据库中搜索得到所有报告在感兴趣区域内激活的研究。接下来对所有搜索到的研究进行ALE元分析,得到一致的与感兴趣区域共同“激活”的区域。这些区域就代表了与感兴趣区域具有一定的功能连通性。
基于这个思路,Toro,Fox和Paus(2008)最早进行了基于大样本的连通性元分析。Toro等(2008)将元分析连接模型运用于全脑,根据共同激活的数据来检验全脑的功能联系。他们运用BrainMap数据库的3402个实验(选自于825篇已发表的文章),区分出了不同的种子区域在全脑共同激活的网络。该研究的结果可以非常直观地定位某个感兴趣区以及共同激活脑区的图像。他们还进一步比较了MACM结果与静息态成像(resting state fMRI,rs-fMRI)结果之间的异同,发现了一些公认的大脑功能网络,包括皮层-脑干-小脑运动网络(the cortico-diencephalo-cerebellar motor network)、默认网络(the default mode network)和额顶注意网络(fronto-parietal attention network)。此外,该研究还提示了大脑内功能连接的一些基本原则,如种子区域的相邻区域有着更高层次的关联度,以及两半脑间的功能联结具有对称性等。Smith等(2009)使用纯数据驱动的独立成分分析方法对使用文献中激活区域所生成的激活概率图进行分析,结果发现一些与静息态功能网络相似的网络,如视觉网络、默认网络、额顶网络、注意网络和突显网络 (salience network)等。Di,Gohel,Kim和Biswal(2013)进一步对比了MACM共同激活网络与静息状态下的大脑网络,发现虽然两区域间共同激活的概率与静息态功能连通性强度存在很强的相关,但在网络结构上共同激活网络有着更有效的连接模式。这些研究表明,通过大样本数据,可以对人脑神经网络进行深入的探索。
除了对全脑进行网络分析,MACM还可以应用于寻找某个脑区共同激活的区域。例如,Robinson,Laird,Glahn,Lovallo和 Fox(2010)通过MACM方法找到与杏仁核共同激活的脑区。首先,作者分别以左右杏仁核的为感兴趣区,分别在BrainMap数据库中筛选出激活了这些两个脑区的实验。然后对这些实验所报告的数据进行ALE元分析,寻找与双侧杏仁核共同激活的脑区。他们发现,两侧杏仁核均与左侧后扣带回(BA23)、前扣带回(BA32)、额下回(inferior frontal gyrus,BA47)、额中回(medial frontal gyrus,BA9)和丘脑具有较强的连通性,与动物模型中杏仁核的功能联结结果相一致。除了杏仁核之外,MACM还被研究者用来探索岛叶(Cauda et al.,2012)、扣带回(Torta&Cauda,2011)和尾状核(Robinson et al.,2012)等重要脑区的功能连接。
还有研究者将此方法进一步应用于对某些脑区进行功能上的细分。例如,Bzdok等(2013)使用元分析方法研究了内侧前额叶(medial prefrontal cortex,mPFC)不同部分的共同激活状况。根据先前的研究结果,他们将mPFC区分为腹侧和背侧两部分并分别确定了种子区域(seed area)。对搜索到的研究进行元分析后,他们发现,腹侧mPFC与伏隔核(nucleus accumbens)、海马、后扣带回、后压部皮层(retrosplenial cortex)共同激活更多,而背侧mPFC则与额下回(inferior frontal gyrus)、颞顶联合区(temporo-parietal junction)和颞中回(middle temporal gyrus)共同激活更多;腹侧mPFC在奖赏任务中激活,而背侧的mPFC在观点采择(perspective-taking,即从他人角度出发推测他人心理状态和观点)和语义记忆任务中激活。因此,作者们推断,腹侧mPFC可能代表的是自下而上驱动的加工,而背侧mPFC则是自上而下驱动的加工。此外,还有研究者使用MACM研究背侧和腹侧眶额皮层在功能上的分离(Zald et al.,2014)。
最近MACM也应用于对功能连通性与结构连通性关系的研究之中(Balsters,Laird,Fox,&Eickhoff,2014)。值得注意的是,MACM方法本身也处于不断地发展之中(Langner,Rottschy,Laird,Fox,&Eickhoff,2014),例如新发展出来的基于连接的功能分割(connectivity-based functional parcellation)分析方法也开始用来探索各个脑区结构与功能之间的关系(Kahnt,Chang,Park,Heinzle,&Haynes,2012)。
5 展望
对大量神经成像研究进行元分析,是克服单个研究局限性行之有效的方法(Yarkoni et al.,2010)。元分析不仅可以寻找跨研究的一致性,还可以利用已有的研究结果数据,来进行假设的检验和提出。正是由于这个原因,神经成像数据的元分析方法得到广泛运用,形成了对实验研究的有益补充。同时,研究者不断地改进元分析方法(Caspers,Zilles,Beierle,Rottschy,& Eickhoff,2013;Costafreda,2012),拓展其研究思路,使之成为认知神经科学的重要研究手段之一(Fox et al.,2014)。
不可否认的是,当前基于坐标的元分析方法也存在一些不足。首先,要警惕发表偏倚(publication bias)的影响(Jennings&Horn,2012)。发表偏倚指的是报告阳性结果的实验比报告阴性结果的实验更加有可能被发表出来。正是由于发表偏倚的存在,神经成像研究中假阳性结果比假阴性结果更突出。元分析使用已发表文献的数据作为输入数据,因此其结果可能仍然受到发表偏倚的影响。其次,目前基于坐标的元分析只利用了神经成像结果中少量的激活峰值点数据,损失了大量原始数据中的有用信息,结果可能会有所偏颇。再次,功能神经成像研究中,通常采用认知减法的逻辑,结果中的激活(activation)是实验条件与静息状态或控制条件进行比较所得到的相对结果。实际的研究中,研究同一心理过程的不同fMRI实验可能采用了不同的控制条件。如果已有的研究数量较少,且采用诸多不同的控制条件,则会给元分析结果带来额外变异;但如果研究数量较多,可以将不同控制条件作为因素,考察不同控制条件对激活结果的影响。此外,目前的元分析手段主要依靠研究者手动地整理数据,耗时耗力。以Brainmap数据库为例,为保证每个研究的编码完整性,Brainmap依靠人工手动地整理数据,这样导致数据库的文献数量有限,且难以保持数据库的及时更新。
作为一种对大量神经成像数据进行分析的方法,神经成像数据的元分析不断地发展,表现出一些新的趋势,这些趋势可能进一步推进对神经成像数据的分析和挖掘。第一,元回归(meta-regression)模型的出现。目前的元分析方法虽然支持减法分析,但是这种方法一次只能比较两种条件,能够分析的变量数目受到限制。在常规元分析技术中,元回归的方法被广泛应用于寻找调节变量以及控制无关变量上。随着研究的深入,使用复杂的元回归模型区分各个可能变量变得十分必要。比如,在研究慢性精神分裂症患者和首发精神分裂症患者脑结构损伤的差异时,一个常见的潜在混淆变量是慢性和首发患者的年龄差异。如果采用元回归模型将年龄变量作为协变量,就可以区分疾病类型和年龄两者的差异。当前脑成像数据的元分析中,元回归模型并没有被广泛应用。其中一个原因是当前版本的元分析软件GingerALE不支持元回归。但实际上Behrens,Fox,Laird和Smith(2013)已经开始应用元回归方法研究大样本神经成像数据。在这个有趣的研究中,Behrens等(2013)使用回归模型分析了从1985到2008年发表文章中的7342个功能成像对比结果。回归模型包含了研究者感兴趣的变量——期刊影响因子,并控制了潜在的混淆变量——发表年份。结果发现,文献中报告脑区激活的位置与文献所发表期刊的影响因子有显著相关。也就是说,如果一篇文章报告了某些脑区的激活,如面孔梭状回、情绪及奖赏相关脑区,则该文章更有可能发表在影响因子较高的杂志上。
第二,使用大量数据部分解决心理-脑交互映射、逆向推理的问题(Yarkoni,Poldrack,Nichols,van Essen,&Wager,2011)。从某种程度上讲,结合大量的神经成像数据,元分析方法可以部分解决神经成像研究中逆向推理的问题(Poldrack,2006),即根据激活的脑区来推断被试的心理过程。例如,腹内侧前额叶(vmPFC)在自我参照加工中激活,但观察到vmPFC的激活不一定意味着被试进行了自我参照加工,因为vmPFC在其他任务如道德判断、情绪调节等任务中也有激活(Hu&Jiang,2014)。要推断vmPFC与自我参照加工的特异对应关系,不仅需要知道自我参照加工激活了vmPFC,还需要排除vmPFC在其他非自我任务中激活的可能性(Wager et al.,2009)。仅依靠单个神经成像研究,难以保证逆向推理的可靠性。综合大量神经成像的研究结果,元分析可以从统计上分析,在当前数据库的全部数据中,vmPFC激活时被试有多大可能在进行自我参照的加工(Yarkoni et al.,2011)。根据对大量神经成像结果的元分析,研究者可以进而在理论上探讨关于某个脑区的整合功能。例如,Carter和Huettel(2013)利用元分析的结果,提出了关于颞顶联合区(temporal-parietal junction,TPJ)的功能分区。
第三,自动化。自动化的趋势主要是为解决手动整理文献信息这一局限。传统的一个解决方法是在发表文献时采用统一标准来报告研究结果(包括激活峰值点坐标)(Poldrack et al.,2008)。但更加有效的方法是使用人工智能自动识别文献中的语义标签,如自然语言处理和文本挖掘的方法。这样可以更快更准地进行文献搜索,甚至最终能够进行自动的大规模元分析。目前已经有研究尝试建立这样的在线数据库和工具包,如Neurosynth.org(Yarkoni et al.,2011)。这种方法可能会在今后的研究得到更多的应用(Poldrack,2011)。
第四,基于图像的元分析(Image-based metaanalysis)而非基于坐标点的元分析,即基于神经成像结果的全脑统计参数图进行元分析。当前绝大部分针对神经成像研究的元分析都使用离散的激活峰值点而不是全脑统计参数图。从统计分析来看,基于图像的分析无疑比基于坐标点的分析更优。因为前者包括了整个数据中的全部效应量,可以进行统计检验力的计算,同时让研究者主观选择的偏误减到最小(Salimi-Khorshidi,Smith,Keltner,Wager,&Nichols,2009;Wager et al.,2007)。使用基于坐标的元分析和基于图像的元分析两种方法对共情结果进行分析表明,两种方法均能得到比较一致的结果,但基于图像的元分析方法可以得到更加详细的信息(Lamm,Decety,&Singer,2011)。但是,要进行大规模基于图像的元分析,还存在着两个主要的障碍:技术方面,需要有存储量足够大、搜索能力足够强的数据库来存储图像数据,以便完整存储图像数据并能够在复杂的数据中进行灵活的搜索;现实层面,要说服研究者们共享原始图像数据,让研究者相信分享数据的利益大于损失(Visscher&Weissman,2011;Yarkoni et al.,2010)。这两个问题已经开始得到初步的解决:技术的进步已经让存储大量数据成为可能;而原始数据的共享,正是目前神经成像元分析领域的另一个大趋势:开放数据。
在认知神经科学领域,开源模式已经是一种为研究者所接受和遵循的模式,从数据到分析软件(主要的数据分析软件均是开源)均免费开放。这种开源模式不仅可以促进数据的共享,还有助于研究者对数据进行中央化的管理、分析和使用,从而推动研究更快地发展(Poldrack&Gorgolewski,2014)。例如,1000大脑功能连接计划(1000 Functional Connectomes Project)就非常有力地推动了各种新的研究方法的探索与使用(http://fcon_1000.projects.nitrc.org/)。伴随着人工智能的发展,对文本的自动挖掘和可视化,结合新的元分析数据标准以及基于图像数据的元分析,开放数据使得研究者可以更加便利地获得、整合和利用来自全球各个实验室的数据。这种开源模式将大大降低科研的成本,减少违背科研伦理规范的行为,正是基础研究所力图达到的目标。从长期的角度来讲,利用开放的平台来存储、管理和提取数据作为下一代工具,将为认知神经科学家进行研究带来一场革命。这种开放式的平台已经开始在研究中崭露头脚,得到研究者的广泛认可,除了进行元分析的Brainmap数据库外,还有利用文本挖掘进行自动在线元分析的Neurosynth(https://www.neurosynth.org)、基于皮质表面分析的数据库SumsDB(http://sumsdb.wustl.edu/),以及共享神经成像统计结果图的平台NeuroVault(http://neurovault.org/),共享统计图一方面保留了更加丰富的信息,同时也减轻了研究者共享数据的负担。还有更多的开放平台正在开发之中,这些平台将成为大数据时代神经成像研究的关键。
致谢:感谢审稿专家对本文提出的宝贵意见;感谢北京师范大学孔祥祯和清华大学袁杰、王非等在本文写作中提供的帮助。
Araujo,H.F.,Kaplan,J.,&Damasio,A.(2013).Cortical midline structures and autobiographical-self processes:An activation-likelihood estimation (ALE) meta-analysis.FrontiersinHumanNeuroscience,7,548. doi:10.3389/fnhum.2013.00548
Balsters,J.H.,Laird,A.R.,Fox,P.T.,&Eickhoff,S.B.(2014).Bridging the gap between functional and anatomical features of cortico-cerebellar circuits using meta-analytic connectivity modeling.HumanBrainMapping,35(7),3152–3169.doi:10.1002/hbm.22392
Behrens,T.E.J.,Fox,P.,Laird,A.,&Smith,S.M.(2013).What is the most interesting part of the brain?Trends in CognitiveSciences,17(1), 2–4.doi:10.1016/j.tics.2012.10.010
Biswal,B.,Yetkin,F.Z.,Haughton,V.M.,&Hyde,J.S.(1995).Functional connectivity in the motor cortex of resting human brain using echo-planar MRI.Magnetic Resonance in Medicine:Official Journal of the Society of Magnetic Resonance in Medicine/Society of Magnetic ResonanceinMedicine,34(4), 537–541.doi:10.1002/mrm.1910340409
Buhle,J.T.,Silvers,J.A.,Wager,T.D.,Lopez,R.,Onyemekwu,C.,Kober,H.,…Ochsner,K.N.(2014).Cognitivereappraisalofemotion:A meta-analysisof human neuroimaging studies.Cerebral Cortex,24(11),2981–2990.doi:10.1093/cercor/bht154
Button,K.S.,Ioannidis,J.P.A.,Mokrysz,C.,Nosek,B.A.,Flint,J.,Robinson,E.S.J.,&Munafò,M.R.(2013).Power failure:Why small sample size undermines the reliability of neuroscience.Nature Reviews Neuroscience,14(5),365–376.doi:10.1038/nrn3475
Bzdok,D.,Langner,R.,Schilbach,L.,Engemann,D.A.,Laird,A.R.,Fox,P.T.,&Eickhoff,S.F.(2013).Segregation of the human medial prefrontal cortex in social cognition.Frontiers in Human Neuroscience,7.doi:10.3389/fnhum.2013.00232
Carp,J.(2012).The secret lives of experiments:Methods reporting in the fMRIliterature.NeuroImage,63(1),289–300.doi:10.1016/j.neuroimage.2012.07.004
Carter,R.M.,&Huettel,S.A.(2013).A nexus model of the temporal-parietal junction.Trends in Cognitive Sciences,17(7),328–336.doi:10.1016/j.tics.2013.05.007
Caspers,J.,Zilles,K.,Beierle,C.,Rottschy,C.,&Eickhoff,S.B.(2013).A novel meta-analytic approach:Mining frequent co-activation patterns in neuroimaging databases.NeuroImage,90, 390–402.doi:10.1016/j.neuroimage.2013.12.024
Cauda,F.,Costa,T.,Torta,D.M.E.,Sacco,K.,D'Agata,F.,Duca,S.,….Vercelli,A.(2012).Meta-analytic clustering of the insular cortex:Characterizing the meta-analytic connectivity of the insula when involved in active tasks.NeuroImage,62(1),343–355.doi:10.1016/j.neuroimage.2012.04.012
Chein,J.M.,Fissell,K.,Jacobs,S.,&Fiez,J.A.(2002).Functional heterogeneity within Broca's area during verbal working memory.Physiology&Behavior,77(4–5),635–639.doi:10.1016/S0031-9384(02)00899-5
Costafreda,S.G.(2012).Meta-analysis,mega-analysis,and task analysis in fMRI Research.Philosophy,Psychiatry,and Psychology,18(4),275–277.doi:10.1353/ppp.2011.0049
Davidson,L.L.,&Heinrichs,R.W.(2003).Quantification of frontal and temporal lobe brain-imaging findings in schizophrenia:A meta-analysis.PsychiatryResearch:Neuroimaging,122(2),69–87.doi:10.1016/S0925-4927(02)00118-X
Di,X.,Gohel,S.,Kim,E.H.,&Biswal,B.B.(2013).Task vs.rest-differentnetwork configurations between the coactivation and the resting-state brain networks.Frontiers in HumanNeuroscience,7,493.doi:10.3389/fnhum.2013.00493
Di,X.,Rypma,B.,&Biswal,B.B.(2014).Correspondence of executive function related functional and anatomical alterations in aging brain.ProgressinNeuro-Psychopharmacology and Biological Psychiatry,48,41–50.doi:10.1016/j.pnpbp.2013.09.001
Diekhof,E.K.,Kaps,L.,Falkai,P.,&Gruber,O.(2012).The role of the human ventral striatum and the medial orbitofrontal cortex in the representation of reward magnitude–An activation likelihood estimation metaanalysis of neuroimaging studies of passive reward expectancy and outcome processing.Neuropsychologia,50(7),1252–1266.doi:10.1016/j.neuropsychologia.2012.02.007
Eickhoff,S.B.,Bzdok,D.,Laird,A.R.,Kurth,F.,&Fox,P.T.(2012).Activation likelihood estimation meta-analysis revisited.NeuroImage,59(3),2349–2361.doi:10.1016/j.neuroimage.2011.09.017
Eickhoff,S.B.,Laird,A.R.,Grefkes,C.,Wang,L.E.,Zilles,K.,& Fox,P.T.(2009).Coordinate-based activation likelihood estimation meta-analysis of neuroimaging data:A random-effects approach based on empirical estimates ofspatialuncertainty.HumanBrainMapping,30(9),2907–2926.doi:10.1002/hbm.20718
Eickhoff,S.B.,Stephan,K.E.,Mohlberg,H.,Grefkes,C.,Fink,G.R.,Amunts,K.,&Zilles,K.(2005).A new SPM toolbox for combining probabilistic cytoarchitectonic maps and functional imaging data.NeuroImage,25(4),1325–1335.doi:10.1016/j.neuroimage.2004.12.034
Fox,P.T.,&Lancaster,J.L.(2002).Mapping context and content: The BrainMap model.NatureReviews Neuroscience,3(4),319–321.doi:10.1038/nrn789
Fox,P.T.,Lancaster,J.L.,Laird,A.R.,&Eickhoff,S.B.(2014).Meta-analysis in human neuroimaging:Computational modeling oflarge-scale databases.AnnualReviewof Neuroscience,37(1),409–434.doi:10.1146/annurev-neuro-062012-170320
Gillihan,S.J.,&Farah,M.J.(2005).Is self special?A critical review of evidence from experimental psychology and cognitive neuroscience.Psychological Bulletin,131(1),76–97.doi:10.1037/0033-2909.131.1.76
Hu,C.P.,&Jiang,X.M.(2014).An emotion regulation role ofventromedialprefrontalcortex in moraljudgment.Frontiers in Human Neuroscience,8.doi:10.3389/fnhum.2014.00873
Jennings,R.,&Horn,J.(2012).Publication bias in neuroimaging research:Implications for meta-analyses.Neuroinformatics,10(1),67–80.doi:10.1007/s12021-011-9125-y
Kahnt,T.,Chang,L.J.,Park,S.Q.,Heinzle,J.,&Haynes,J.-D.(2012).Connectivity-based parcellation of the human orbitofrontal cortex.The Journal of Neuroscience,32(18),6240–6250.doi:10.1523/JNEUROSCI.0257-12.2012
Kelley,W.M.,Macrae,C.N.,Wyland,C.L.,Caglar,S.,Inati,S.,&Heatherton,T.F.(2002).Finding the self?An event-related fMRI study.Journal of Cognitive Neuroscience,14(5),785–794.doi:10.1162/08989290260138672
Laird,A.R.,Eickhoff,S.,Fox,P.M.,Uecker,A.,Ray,K.,Saenz,J.,…Fox,P.T.(2011).The BrainMap strategy for standardization,sharing,and meta-analysis of neuroimaging data.BMC Research Notes,4(1),349.doi:10.1186/1756-0500-4-349
Laird,A.R.,Eickhoff,S.B.,Kurth,F.,Fox,P.M.,Uecker,A.M.,Turner,J.A.,…Fox,P.T.(2009).ALE metaanalysis workflows via the BrainMap database:progress towards a probabilistic functional brain atlas.Frontiers in Neuroinformatics,3,23.doi:10.3389/neuro.11.023.2009
Laird,A.R.,Fox,P.M.,Price,C.J.,Glahn,D.C.,Uecker,A.M.,Lancaster,J.L.,…Fox,P.T.(2005).ALE metaanalysis:Controlling the false discovery rate and performing statistical contrasts.Human Brain Mapping,25(1),155–164.doi:10.1002/hbm.20136
Laird,A.R.,Lancaster,J.L.,&Fox,P.T.(2005).BrainMap:The social evolution of a human brain mapping database.Neuroinformatics,3(1),65–77.doi:10.1385/NI:3:1:065
Lamm,C.,Decety,J.,&Singer,T.(2011).Meta-analytic evidence for common and distinct neural networks associated with directly experienced pain and empathy for pain.NeuroImage,54(3), 2492–2502.doi: 10.1016/j.neuroimage.2010.10.014
Lancaster,J.L.,Laird,A.R.,Fox,P.M.,Glahn,D.E.,&Fox,P.T.(2005).Automated analysis of meta-analysis networks.HumanBrain Mapping,25(1),174–184.doi:10.1002/hbm.20135
Langner,R.,Rottschy,C.,Laird,A.R.,Fox,P.T.,&Eickhoff,S.B.(2014).Meta-analytic connectivity modeling revisited:Controlling foractivation base rates.NeuroImage,99,559–570.doi:10.1016/j.neuroimage.2014.06.007
Legrand,D.,& Ruby,P.(2009).What is self-specific?Theoretical investigation and critical review of neuroimaging results.Psychological Review,116(1),252–282.doi:10.1037/a0014172
Murray,R.J.,Schaer,M.,&Debbané,M.(2012).Degrees of separation:A quantitative neuroimaging meta-analysis investigating self-specificity and shared neural activation between self- and other-reflection.Neuroscience&Biobehavioral Reviews,36(3),1043–1059.doi:10.1016/j.neubiorev.2011.12.013
Neumann,J.,Lohmann,G.,Derrfuss,J.,&von Cramon,D.Y.(2005).Meta-analysis of functional imaging data using replicator dynamics.Human Brain Mapping,25(1),165–173.doi:10.1002/hbm.20133
Northoff,G.,Heinzel,A.,de Greck,M.,Bermpohl,F.,Dobrowolny,H.,&Panksepp,J.(2006).Self-referential processing in ourbrain—A meta-analysisofimaging studies on the self.NeuroImage,31(1),440–457.doi:10.1016/j.neuroimage.2005.12.002
Ochsner,K.N.,Beer,J.S.,Robertson,E.R.,Cooper,J.C.,Gabrieli,J.D.E.,Kihsltrom,J.F.,&D'Esposito,M..(2005).The neural correlates of direct and reflected self-knowledge.NeuroImage,28(4),797–814.doi:10.1016/j.neuroimage.2005.06.069
Pauly,K.D.,Kircher,T.T.J.,Schneider,F.,&Habel,U.(2014).Me,myself and I:temporal dysfunctions during self-evaluation in patients with schizophrenia.Social Cognitive and Affective Neuroscience,9(11),1779–1788.doi:10.1093/scan/nst174
Platek,S.M.,Loughead,J.W.,Gur,R.C.,Busch,S.,Ruparel,K.,Phend,N.,… D.D.Langleben.(2006).Neural substrates for functionally discriminating self-face from personally familiar faces.Human Brain Mapping,27(2),91–98.doi:10.1002/hbm.20168
Poldrack,R.A.(2006).Can cognitive processes be inferred from neuroimaging data?Trends in Cognitive Sciences,10(2),59–63.doi:10.1016/j.tics.2005.12.004
Poldrack,R.A.(2011).The future of fMRI in cognitive neuroscience.NeuroImage,62(2),1216–1220.doi:10.1016/j.neuroimage.2011.08.007
Poldrack,R.A.,Fletcher,P.C.,Henson,R.N.,Worsley,K.J.,Brett,M.,& Nichols,T.E.(2008).Guidelines for reporting an fMRI study.NeuroImage,40(2),409–414.doi:10.1016/j.neuroimage.2007.11.048
Poldrack,R.A.,&Gorgolewski,K.J.(2014).Making big data open: Data sharing in neuroimaging.Nature Neuroscience,17(11),1510–1517.doi:10.1038/nn.3818
Price,C.J.,&Friston,K.J.(1997).Cognitive conjunction:A new approach to brain activation experiments.NeuroImage,5(4),261–270.doi:10.1006/nimg.1997.0269
Qin,P.M.,Liu,Y.J.,Shi,J.F.,Wang,Y.Z.,Duncan,N.,Gong,Q.Y.,…Northoff,G.(2012).Dissociation between anterior and posterior cortical regions during self-specificity and familiarity:A combined fMRI–meta-analytic study.Human Brain Mapping,33(1),154–164.doi:10.1002/hbm.21201
Qin,P.M.,&Northoff,G.(2011).How is our self related to midline regions and the default-mode network?NeuroImage,57(3),1221–1233.doi:10.1016/j.neuroimage.2011.05.028
Radua,J.,van den Heuvel,O.A.,Surguladze,S.,&Mataix-Cols,D.(2010).Meta-analytical comparison of voxel-based morphometry studies in obsessive-compulsive disorder vs other anxiety disorders.ArchivesofGeneralPsychiatry,67(7), 701–711.doi:10.1001/archgenpsychiatry.2010.70
Robinson,J.L.,Laird,A.R.,Glahn,D.C.,Blangero,J.,Sanghera,M.K.,Pessoa,L.,…Fox,P.T..(2012).The functional connectivity of the human caudate:An application of meta-analytic connectivity modeling with behavioral filtering.NeuroImage,60(1),117–129.doi: 10.1016/j.neuroimage.2011.12.010
Robinson,J.L.,Laird,A.R.,Glahn,D.C.,Lovallo,W.R.,&Fox,P.T.(2010).Metaanalytic connectivity modeling:Delineating the functionalconnectivity ofthe human amygdala.Human Brain Mapping,31(2),173–184.doi:10.1002/hbm.20854
Rogers,T.B.,Kuiper,N.A.,& Kirker,W.S.(1977).Self-reference and the encoding of personal information.Journalof PersonalityandSocialPsychology,35(9),677–688.doi:10.1037/0022-3514.35.9.677
Roy, M., Shohamy, D., & Wager, T. D. (2012).Ventromedial prefrontal-subcortical systems and the generation ofaffective meaning.TrendsinCognitive Sciences,16(3),147–156.doi:10.1016/j.tics.2012.01.005
Salimi-Khorshidi,G.,Smith,S.M.,Keltner,J.R.,Wager,T.D., & Nichols, T. E. (2009). Meta-analysis of neuroimaging data:A comparison of image-based and coordinate-based pooling of studies.NeuroImage,45(3),810–823.doi:10.1016/j.neuroimage.2008.12.039
Sescousse,G.,Caldú,X.,Segura,B.,&Dreher,J.-C.(2013).Processing of primary and secondary rewards: A quantitative meta-analysis and review of human functional neuroimaging studies.Neuroscience&Biobehavioral Reviews,37(4),681–696.doi:10.1016/j.neubiorev.2013.02.002
Smith,S.M.,Fox,P.T.,Miller,K.L.,Glahn,D.C.,Fox,P.M., Mackay, C. E., …Beckmann, C. F. (2009).Correspondence ofthe brain's functionalarchitecture during activation and rest.Proceedings of the National Academyof Sciencesof the United Statesof America,106(31),13040–13045.doi:10.1073/pnas.0905267106
Stern,P.(2013).Connection,connection,connection….Science,342(6158),577.doi:10.1126/science.342.6158.577
Sui,J.,He,X.,&Humphreys,G.W.(2012).Perceptual effects of social salience:Evidence from self-prioritization effects on perceptual matching.Journal of Experimental Psychology:Human Perception and Performance,38(5),1105–1117.doi:10.1037/a0029792
Tong,F.,&Nakayama,K.(1999).Robust representations for faces:Evidence from visual search.Journal of Experimental Psychology:Human Perception and Performance,25(4),1016–1035.doi:10.1037/0096-1523.25.4.1016
Toro,R.,Fox,P.T.,& Paus,T.(2008).Functional coactivation map of the human brain.Cerebral Cortex,18(11),2553–2559.doi:10.1093/cercor/bhn014
Torta,D.M.,&Cauda,F.(2011).Different functions in the cingulate cortex,a meta-analytic connectivity modeling study.NeuroImage,56(4), 2157–2172.doi: 10.1016/j.neuroimage.2011.03.066
Turkeltaub,P.E.,Eden,G.F.,Jones,K.M.,&Zeffiro,T.A.(2002).Meta-analysis of the functional neuroanatomy of single-word reading:Method and validation.NeuroImage,16(3),765–780.doi:10.1006/nimg.2002.1131
Turkeltaub,P.E.,Eickhoff,S.B.,Laird,A.R.,Fox,M.,Wiener,M.,& Fox,P.(2012).Minimizing withinexperiment and within-group effects in activation likelihood estimation meta-analyses.Human Brain Mapping,33(1),1–13.doi:10.1002/hbm.21186
van Essen,D.C.(2013).Cartography and connectomes.Neuron,80(3),775–790.doi:10.1016/j.neuron.2013.10.027
Vanderwal,T.,Hunyadi,E.,Grupe,D.W.,Connors,C.M.,&Schultz,R.T.(2008).Self,mother and abstract other:An fMRI study of reflective social processing.NeuroImage,41(4),1437–1446.doi:10.1016/j.neuroimage.2008.03.058
Visscher,K.M.,&Weissman,D.H.(2011).Would the field of cognitive neuroscience be advanced by sharing functionalMRI data?BMCMedicine,9(1),34.doi:10.1186/1741-7015-9-34
Wager,T.D.,Lindquist,M.,& Kaplan,L.(2007).Meta-analysis of functional neuroimaging data:Current and future directions.SocialCognitiveandAffective Neuroscience,2(2),150–158.doi:10.1093/scan/nsm015
Wager,T.D.,Lindquist,M.A.,Nichols,T.E.,Kober,H.,&van Snellenberg, J. X. (2009). Evaluating the consistency and specificity of neuroimaging data using meta-analysis.NeuroImage,45(1, Supplement 1),S210–S221.doi:10.1016/j.neuroimage.2008.10.061
Wang,G.,Mao,L.H.,Ma,Y.N.,Yang,X.D.,Cao,J.Q.,Liu,X.,…Han,S.H.(2012).Neural representations of close others in collectivistic brains.Social Cognitive and Affective Neuroscience,7(2),222–229.doi:10.1093/scan/nsr002
Yarkoni,T.,Poldrack,R.A.,Nichols,T.E.,van Essen,D.C.,& Wager,T.D.(2011).Large-scale automated synthesis of human functional neuroimaging data.Nature Methods,8(8),665–670.doi:10.1038/nmeth.1635
Yarkoni,T.,Poldrack,R.A.,van Essen,D.C.,&Wager,T.D.(2010).Cognitive neuroscience 2.0:Building a cumulative science of human brain function.Trends inCognitive Sciences,14(11),489–496.doi:10.1016/j.tics.2010.08.004
Zald,D.H.,McHugo,M.,Ray,K.L.,Glahn,D.C.,Eickhoff,S.B.,&Laird,A.R.(2014).Meta-analytic connectivity modeling reveals differential functional connectivity of the medialand lateralorbitofrontalcortex.Cerebral Cortex,24(1),232–248.doi:10.1093/cercor/bhs308
Zhu,Y.,Zhang,L.,Fan,J.,&Han,S.(2007).Neural basis of cultural influence on self-representation.NeuroImage,34(3),1310–1316.doi:10.1016/j.neuroimage.2006.08.047

