低氧血症对轻型颅脑损伤大鼠海马结构二次脑损伤的实验研究
王洪财 王波定 陈海 陈茂送 孙成丰 沈罡 马延斌
低氧血症对轻型颅脑损伤大鼠海马结构二次脑损伤的实验研究
王洪财 王波定 陈海 陈茂送 孙成丰 沈罡 马延斌
目的应用低氧血症二次脑损伤大鼠模型,探讨低氧血症对轻型颅脑损伤(m TBI)后海马神经元及轴索组织结构的二次损伤作用。方法采用随机数字表法将大鼠分为正常对照组(8只)、单纯m TBI组(10只)、单纯低氧血症组(10只)及低氧血症二次脑损伤组(10只)。在自制旋转装置致大鼠m TBI基础上,利用动物呼吸机获得控制性低氧血症,从而构建低氧血症二次脑损伤模型。脑损伤后1周,应用HE染色、免疫组化β-APP染色及电镜观察大鼠海马组织结构病理学变化。结果HE染色发现单纯低氧血症组大鼠海马神经元结构完整、排列有序、神经组织结构致密、未见明显神经元丢失及神经组织结构疏松等病理变化,单纯m TBI组及低氧血症二次脑损伤组大鼠均出现海马神经元肿胀、胞质淡染、密度降低、排列不规则及神经组织结构疏松等损伤表现,但低氧血症二次脑损伤组较单纯m TBI组明显。免疫组化β-APP染色及电镜观察到低氧血症二次脑损伤组大鼠海马存在轴索肿胀扭曲变形、髓鞘板层分离及轴索球形成等轴索损伤表现。 结论 低氧血症二次脑损伤可明显加重m TBI后海马神经元及轴索组织结构的损伤,及早预防、发现和治疗低氧血症对改善m TBI患者预后具有积极意义。
低氧血症 轻型颅脑损伤 二次脑损伤
随着交通物流业及建筑业的发展,颅脑损伤(TBI)发病率呈不断上升趋势,其增长速度已超过全球人口的增长速度,被学者称之为“静息性流行病”,现已成为全球关注的社会公共卫生问题[1]。轻型TBI(mTBI)是TBI中最为常见的损伤类型,由于临床表现各异且症状轻微,一直未受临床医生所重视,其相应的基础研究更为薄弱[2]。近年来国内外研究表明,部分mTBI患者即使头颅CT及常规MR检查表现正常,事实上也存在神经组织病理学改变,尤其是海马区域神经组织结构的损伤[3]。此外,部分mTBI患者在疾病过程中尤其是创伤急性期,可因胸腹部多发伤伴发低氧血症等二次脑损伤因素而导致病情恶化及后遗症发生[4]。为此,本研究建立了低氧血症二次脑损伤大鼠模型,以进一步探讨低氧血症对mTBI后海马组织结构的二次损伤作用。
1 材料和方法
1.1 实验动物及主要试剂 健康成年雄性SD大鼠38只,体重300~350g,购于上海斯莱克实验动物有限责任公司,饲养于上海交通大学医学院附属第三人民医院动物实验室。免疫组化β-APP抗体购于英国Abcam公司,Olympus IX51型倒置荧光显微镜为日本Olympus公司产品,Philips CM-120透射电镜为荷兰Philips公司产品。
1.2 实验动物分组及模型建立 将大鼠单笼依次标签,采用随机数字表法分为正常对照组(8只)和损伤组(30只),其中损伤组分为单纯mTBI组(10只)、单纯低氧血症组(10只)及低氧血症二次脑损伤组(10只)。低氧血症二次脑损伤组大鼠腹腔注射3%戊巴比妥钠麻醉,待角膜反射消失后,行气管插管、小型动物呼吸机(Harvard Apparatus 683,美国)辅助呼吸,右侧股动脉插管监测平均动脉压、输液及取样;应用自制颅脑致伤装置(专利号:ZL200810201615.5)使大鼠发生90°整体瞬间加速旋转运动而产生mTBI[5],伤后即刻予11%氧气通气30 min造成低氧血症,血气分析提示PaO2为(38±3)mmHg,动脉血血氧饱和度(SpO2)为(56±3)%[6]。二次脑损伤后置于正常室内空气中。单纯mTBI组大鼠接受旋转运动无后续低氧血症建立过程,而单纯低氧血症组大鼠无旋转运动而直接行11%氧气通气30min,血气分析PaO2为(39±3)mmHg,SpO2为(57±2)%。正常对照组大鼠除无旋转运动和低氧血症建立过程外,其他操作同损伤组。大鼠伤后不进行抢救及其他特殊治疗,观察大鼠呼吸变化、肢体抽搐、苏醒后肢体活动及反应能力等情况。等大鼠恢复自主活动后,回笼继续原有饲料饲养。模型建立后1周,记录大鼠死亡数目,计算死亡率并行组织病理学检测。
1.3 组织病理学检测
1.3.1 光镜标本制备 各组大鼠麻醉满意后,快速开胸行升主动脉插管,剪开右心房,先后以0.9%氯化钠注射液100ml快速冲洗、4%多聚甲醛350ml先快后慢行脑灌注固定。快速开颅大体标本观察后,行脑冠状面3~4 mm连续切片,4%多聚甲醛4℃固定24h,常规脱水、石蜡包埋,HE常规染色及免疫组化β-APP染色(抗体1∶300稀释,LSAB法染色)。光镜标本在Olympus IX51型倒置荧光显微镜下观察并拍照。
1.3.2 透射电镜标本制备 各组中随机抽取2只大鼠标本行电镜检查,以2%戊二醛350ml灌注固定后,快速开颅取海马CA3处大小1mm×1mm×3mm脑组织,再以2%戊二醛4℃固定24h,锇酸染色后固定,环氧树脂包埋,超薄切片后Philips CM-120透射电镜观察。
1.3.3 组织病理学检测 在HE染色结果基础上对海马CA3区域进行神经元计数,然后取平均数。神经元计数方法如下:每只动物取2张切片,切片定位于前囟后3.8mm,在400倍镜下计数连续4个视野,计数有完整胞体和细胞核的神经元。应用免疫组化β-APP染色来评估各损伤组大鼠海马区域轴索损伤情况。所有神经元计数及阳性轴索染色判读均由同1位经验丰富的神经病理学医师执行。
1.4 统计学处理 应用SPSS 11.0统计软件,计量资料均采用表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析和SNK检验。
2 结果
2.1 各组大鼠死亡情况及行为学观察 正常对照组、单纯mTBI组及单纯低氧血症组大鼠伤后1周无死亡现象。低氧血症二次脑损伤组大鼠死亡2只,死亡率为20.0%。死亡大鼠在低氧血症建立后即出现呼吸持续浅促,间歇性肢体抽搐呈去脑强直状,90min内出现死亡。其余大鼠伤后多数出现10余秒张口急促呼吸,后呼吸浅促夹杂数次深幅呼吸、肢体抽搐及大小便失禁,置室内空气30min后呼吸渐平稳、SpO2和PaO2基本恢复受伤前水平。苏醒后大鼠精神差,蜷伏不动,反应下降,觅食活动减少,上述行为学抑制持续时间约4h。单纯mTBI组大鼠亦出现短暂呼吸暂停及行为学抑制等表现,但上述变化在2h内恢复。单纯低氧血症组和正常对照组大鼠无上述现象,呼吸保持平稳、麻醉苏醒后活动基本同麻醉前。
2.2 各组大鼠海马区神经元组织病理学观察
2.2.1 光镜观察 光镜下HE染色发现低氧血症二次脑损伤组海马区域神经元密度降低,排列不规则,神经元肿胀,胞质淡染,神经元周边呈空泡状,神经组织结构疏松,并可见神经元变性坏死(见图1A)。单纯mTBI组亦见神经元减少及神经组织结构絮乱疏松等组织学改变,但较低氧血症二次脑损伤组轻(见图1B)。单纯低氧血症组和正常对照组镜下可见神经元及轴索排列有序,神经组织结构致密,未见神经元丢失及神经组织结构疏松等病理变化(见图1C-D)。
2.2.2 电镜观察 电镜下可见低氧血症二次脑损伤组大鼠神经元内线粒体肿胀、尼氏小体消失及胞质空泡化等超微病理学变化,并见神经轴索肿胀迂曲,轴索内微管消失、微丝聚集,线粒体肿胀,髓鞘板层分离与轴索膜形成低电子密度区,轴索膜破裂、轴浆外溢形成断端轴索球等轴索损伤征象(见图2A)。单纯mTBI组除可见类似的神经元损伤病理改变外,未见明显轴索损伤征象(见图2B)。单纯低氧血症组和正常对照组则无明显神 经元及轴索损伤的征象(见图2C-D)。

图1 各组大鼠海马区神经元组织病理学观察(A:低氧血症二次脑损伤组;B:单纯mTBI组;C:单纯低氧血症组;D:正常对照组;HE染色,×200)
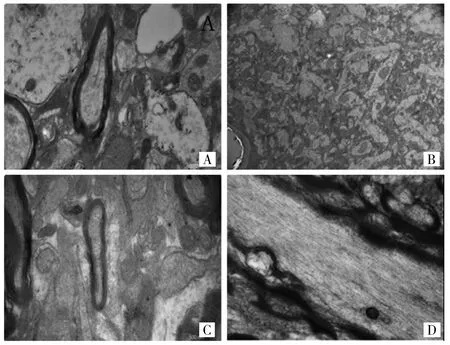
图2 各组大鼠海马区神经元电镜观察(A:低氧血症二次脑损伤组;B:单纯mTBI组;C:单纯低氧血症组;D:正常对照组;锇酸染色,×13 500)
2.2.3 免疫组化检测 免疫组化β-APP染色观察到低氧血症二次脑损伤组大鼠海马区域神经元呈强阳性染色,并见神经轴索迂曲肿胀、串珠样改变及轴索断裂形成轴索球等轴索损伤表现(见图3A)。单纯mTBI组神经元呈弱阳性染色,且未现轴索阳性染色(见图3B);单纯低氧血症组和正常对照组神经元及轴索均未出现阳性染色(见图3C-D)。

图3 各组大鼠海马区神经元免疫组化β-APP染色(A:低氧血症二次脑损伤组;B:单纯mTBI组;C:单纯低氧血症组;D:正常对照组;免疫组化LSAB法染色,×100)
2.3 各组大鼠海马区域神经元计数 模型建立后1周,低氧血症二次脑损伤组大鼠海马CA3区域内神经元计数分别为(127±11)个,单纯mTBI组为(159±15)个、单纯低氧血症组(181±19)个,正常对照组(191±23)个。低氧血症二次脑损伤组及单纯mTBI组神经元计数与其他两组比较均有统计学差异(F=9.47、3.75,均P<0.05),且低氧血症二次脑损伤组比单纯mTBI组神经元数目减少更为明显(t=5.035,P<0.05)。单纯低氧血症组神经元数目减少,但与正常对照组比较无统计学差异(t=1.060,P>0.05)。
3 讨论
TBI是造成当今世界青壮年重度残疾和死亡的首要病因,且治疗难、预后差,长期持续存在的神经功能缺失给家庭和社会增加了巨大的医疗负担,现已成为全球关注的严重社会公共卫生问题[1]。mTBI是临床最常见的TBI类型,约占TBI发病率的70.0%~80.0%。由于其临床表现各异且症状轻微,一直不被临床医生所重视,因此目前mTBI诊断及治疗仍不完善,相应的基础研究更未广泛开展。随着功能MR技术的发展及相关研究的进展,国内外研究发现mTBI可引起患者认知功能障碍、神经行为絮乱、记忆力减退及注意力不集中等神经精神症状,甚至可导致躯体运动感觉功能障碍;部分患者即使头颅CT及常规MR表现正常,也可能存在神经组织病理改变[3,7]。此外,mTBI患者在其疾病过程中尤其是创伤急性期,可因误吸、创伤性湿肺和胸腹部损伤而伴发低氧血症、低血压等二次脑损伤因素导致患者病情恶化及后遗症发生[4,6]。
二次脑损伤是指在原发性脑损伤后,由于低氧血症、低血压及高热等因素造成的颅内压、脑灌注压及脑代谢率等的异常改变,进而加重原发性脑损伤并延长其病理生理损伤过程。国外临床研究表明,在TBI中二次脑损伤的发生率为44.5%,TBI患者合并二次脑损伤时致残率和病死率均显著提高[8-9]。本研究结果同样提示,在单纯mTBI或低氧血症情况下,大鼠行为学抑制能较快恢复且未出现死亡情况,而低氧血症二次脑损伤组大鼠死亡率高达20.0%,且行为学抑制时间明显延长。众多临床研究表明在TBI中低氧血症较其他二次脑损伤因素更常见。一项关于TBI患者直升机转运的研究发现,55.0%的TBI患者在气管插管前曾发生过低氧血症,而这些低氧血症患者中,46.0%未合并低血压[10]。脑组织耗氧量大、对缺氧极其敏感,故低氧血症的发生可严重影响患者神经功能康复及预后。国内外学者对于TBI患者合并低氧血症进行了大量的临床统计工作,但相对统一标准的TBI合并低氧血症的二次脑损伤模型至今在国内尚未建立,相关基础研究甚少[11]。国外部分学者构建了低氧血症二次脑损伤模型,但主要限于中重型TBI而鲜有mTBI,并且低氧血症建立的条件和方式差异较大[12-13]。为此,在稳定可靠的低氧血症二次脑损伤模型基础上,探讨低氧血症对mTBI后神经组织结构的损伤,有利于进一步认识低氧血症二次脑损伤,也为其临床诊治提供更多的线索和依据。
国外多项研究报道低氧血症可加重局灶性中重型TBI实验动物模型的皮层神经元损伤、加剧神经炎症反应、加重脑水肿、扰乱细胞代谢、延长组织病理损伤过程并导致感觉、运动和认知功能恶化[12-14]。海马作为大脑边缘系统的重要组成部分,该区域神经元及轴索连接与学习记忆功能密切相关,TBI后海马区域神经组织结构的损伤是伤后认知、记忆功能障碍的主要原因。既往研究表明海马CA3区域神经元对损伤有着特殊敏感性,在伤后此区域神经元容易发生变性、坏死及凋亡[6]。本研究在自制mTBI联合低氧血症动物模型基础上,利用HE染色、免疫组化和电镜技术来观察低氧血症对mTBI后海马组织结构的损伤作用。组织病理学检测表明单纯mTBI后海马CA3区域神经元出现密度降低、排列不规则、神经组织结构疏松及神经元变性坏死等损伤征象,但无明显轴索结构损伤。单纯限时性低氧血症后海马区域神经元数目减少,但与正常对照组比较无统计学差异,且不存在神经轴索损伤。这与Dolinak等[15]研究结果一致,即单纯限时性低氧血症并不易造成神经轴索损伤。mTBI合并低氧血症后,海马CA3区域神经元损伤征象更为明显,神经元数目减少,与单纯mTBI组比较存在统计学差异。此外,神经轴索出现肿胀迂曲、髓鞘板层分离及轴索断裂形成轴索球等损伤表现。mTBI合并低氧血症后出现明显的海马组织结构损伤,这可能与mTBI后脑血管自动调节功能受损,导致脑组织对于后继脑损伤因素易损性增加相关,而正常脑组织存在着良好的脑血管自动调节功能、在单纯低氧血症情况下脑组织可通过扩张脑血管来代偿缺氧[16]。此外,也可能与mTBI后神经元代谢增加、兴奋性氨基酸增多及线粒体功能障碍等因素相关[17]。
综上所述,本研究发现单纯限时性低氧血症对海马神经元及轴索结构损伤作用不明显,然而在mTBI后发生低氧血症即可出现明显的神经组织结构损伤。这提示mTBI后脑组织易损性增加,积极预防及纠正低氧血症对改善mTBI患者预后具有积极意义。
[1]Kenney K,Diaz-Arrastia R.Review of traumatic b rain and sp ina l cord injury:challenges and deve lopments[J].JAMA Neuro l,2013, 70(10):1333.
[2]Vos PE,Alekseenko Y,Battistin L,eta l.Mild traumatic b rain injury [J].Eur JNeurol,2012,19(2):191-198.
[3]Mayer AR,Ling J,Manne llM V,etal.A p rospective d iffusion tensor imaging study in m ild traum atic b rain in jury[J].Neurology, 2010,74(8):643-650.
[4]McHugh G S,EngelD C,Butcher I,eta l.Prognostic va lue ofsecondary insults in traumatic b rain injury:results from the IMPACT study[J].JNeurotrauma,2007,24(2):287-293.
[5]Wang H C,Duan ZX,Wu FF,etal.A new ratm odel for d iffuse axonalinjury with linear acceleration and angular acceleration combined[J].JNeurotraum a,2010,27(4):707-719.
[6]朱坤灿,王洪财,陈海,等.大鼠低氧血症性二次脑损伤模型的建立[J].中华实验外科杂志,2014,31(10):2332-2334.
[7]Max J E,Schachar R J,Land is J,et al.Psychiatric d isorders in child ren and ado lescents in the first six m onths afterm ild traumatic b rain in jury[J].JNeuropsychiatry Clin Neurosci,2013,25(3): 187-197.
[8]Maas A I,Marm arou A,Murray G D,etal.Prognosis and c linicaltria l design in traumatic b rain injury:the IMPACT study[J].J Neurotraum a,2007,24(2):232-238.
[9]Kochanek P M,Robert S B C,Larry W J.Pathobiology of Secondary Brain Injury[M]//Nathan D Z,Doug las IK,Ross D Z.2nd ed ition.Brain Injury Med icine:Princip les and Practice.New York:Demos Med icalPub lishing,2012:148.
[10]StochettiN,Furlan A,Volta F.Hypoxem ia and arteria lhypotension at the accident scene in head injury[J].J Traum a,1996,40 (5):764-767.
[11]王波定,王洪财,朱坤灿,等.创伤性脑损伤模型的延续与完善:二次脑损伤模型[J].中华神经医学杂志,2013,12(4):426-429.
[12]Feng JF,Zhao X,Gurko ffG G,etal.Post-traum atic hypoxia exacerbates neuronalcelldeath in the hippocampus[J].JNeurotraum a,2012,29(6):1167-1179.
[13]Yan EB,He llewellSC,Bellander BM,etal.Post-traumatic hypoxia exacerbates neurolog ical de ficit,neuroinflammation and cereb ralm etabolism in rats with d iffuse traumatic b rain in jury[J].JNeuroinflammation,2011,28(8):147-163.
[14]Baum an R A,Widholm J,Long JB.Secondary hypoxia exacerbates acute d isrup tions of energy m etabolism in rats resulting from fluid percussion injury[J].Behav Brain Res,2005,160(1): 25-33.
[15]Do linak D,Sm ith C,Graham D I.G lobalhypoxia per se is an unusualcause of axonal injury[J].Acta Neuropathol,2000,100(5): 553-560.
[16]Metting Z,Ro d iger L A,Stewart R E,et al.Perfusion computed tomog raphy in the acute phase of m ild head injury:regiona l dysfunction and p rognostic value[J].Ann Neuro l,2009,66(6): 809-816.
[17]Prins M L,Alexander D,Giza C C,etal.Repeated m ild traum atic b rain injury:mechanisms of cereb ral vulnerab ility[J].J Neurotrauma,2013,30(1):30-38.
ObjectiveTo investigate the effec ts of post-traumatic hypoxem ia on m ild traumatic brain injury(m TBI)in rats.MethodsThe experimentalmodelwas estab lished by instantly rotating 90 degree followed by hypoxem ic insult in rats.Animals in g roup 1 were sub jected to p rimarym TBIand subsequenthypoxem ia(n=10);animals in g roup 2 were sub jec ts tom TBI only(n=10);animals in group 3 underwenthypoxem ia only(n=10)and animals in group 4 served as the controls(n=8).Pathological and behavioralexam inations were conducted 1 week after injury.ResultsAll rats in group 2 and 3 survived afterm TBIor hypoxem ia,whereas 2 animals d ied in g roup 1 w ith amortality rate of20.0%.Histologicalexam ination ofHE-stained sections,electronm ic roscope,andβ-APP immunohistochem istry revealed the p resence ofneuronaland axonalinjury in CA3 ofhippocam pus in rats of group 1.Pathological changes of neuronal injury in g roup 2 were exhibited,but no add itional axonal damage was demonstrated.The above changes were not found in g roups 3 and 4.ConclusionThe combination of p rimary m TBIand secondary hypoxem ia can cause synergistic effects to p roduce significantly pathologicalchanges in CA3 ofhippocam pus in rats.
Hypoxem ia Mild traumatic b rain injury Secondary b rain injury

2015-01-04)
(本文编辑:胥昀)
宁波市自然科学基金项目(2011A610041);宁波市科学技术基金项目(2013A05)
315040 宁波市医疗中心李惠利医院神经外科(王洪财、王波定、陈海、陈茂送、孙成丰、沈罡);上海交通大学医学院附属第三人民医院神经外科(马延斌)
王波定,E-mail:Roger0412@126.com

