电催化还原DMF制备三甲胺的新方法*
贾瑞龙,梁 栋,宋秀丽,梁镇海(太原理工大学化学化工学院,山西太原 030024)
电催化还原DMF制备三甲胺的新方法*
贾瑞龙,梁栋,宋秀丽,梁镇海
(太原理工大学化学化工学院,山西太原030024)
摘要:报道了一种新的电催化还原DMF制备三甲胺的方法。以Cu电极为工作电极,Pt电极为对电极,饱和甘汞为参比电极,0.1 mol·L-1四丙基四氟硼酸铵为支持电解质,于室温以扫描速率50 mV·s-1实现了DMF电催化还原为三甲胺的反应,转化率90%,三甲胺纯度99%,其结构经GC-MS确证。
关键词:DMF;三甲胺;电还原;循环伏安;电化学合成
三甲胺(1)是一种重要的化工产品[1-2],主要用于农药、染料、医药及有机合成等领域[3-4]。目前工业上生产1的主要方法是以甲醇和氨为原料,活性氧化铝、硅铝等作为固体催化剂,在高温(420 ℃)和高压(4 900 kPa)条件下实现的,主要产物是甲胺、二甲胺和1的混合物。由于1与氨、甲胺、二甲胺形成复杂的共沸体系,纯化1需要非常复杂的蒸馏操作以及大型装置[5-6],耗能大,成本高。
小量生产1时可以用甲醛作为原料[7]。该方法在实验过程中需要不断蒸出甲醛蒸汽,容易逸散到空气中,污染环境。
本文报道一种新的电催化还原DMF制备1的方法。以Cu电极为工作电极,Pt电极为对电极,饱和甘汞为参比电极,0.1 mol·L-1四丙基四氟硼酸铵[(C3H7)4NBF4]为支持电解质,于室温以扫描速率50 mV·s-1实现了DMF电催化还原为1的反应(Scheme 1),转化率90%,纯度99%,其结构经GC-MS确证。并用循环伏安法考察了温度、扫描速率、水用量对还原反应的影响。
相对传统的化学方法,该方法具有一定的新颖性,且方便、安全、节能,为DMF还原反应的研究提供了理论依据。
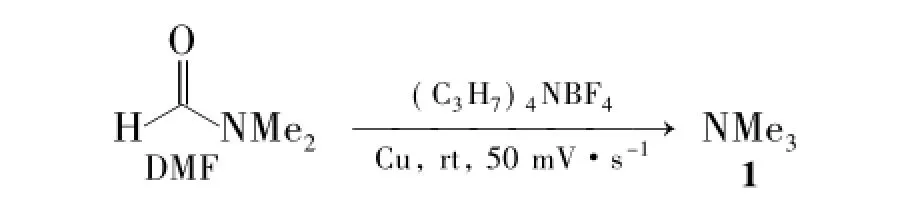
Scheme 1
1 实验部分
1.1仪器与试剂
VMP33型Multi Potentiostat电化学工作站; 7890A-5975C型气质联用仪[配备安捷伦19091S-433HP-5MS 5% Phenyl Methyl Silox(30 m×250 μm×0.25 μm)的色谱柱,FID检测器,分流比为20∶1,进样口和检测器的温度分别为150℃和200℃,采用程序升温法,柱温40℃运行5 min,然后以10℃·min-1加热至120℃运行2 min,离子源温度230℃]。
DMF,天津市科密欧化学试剂有限公司,用前用无水Na2CO3干燥,经两次减压蒸馏纯化,并储存于棕色瓶内待用;四丙基四氟硼酸铵,林州市科能材料科技有限公司,用前用乙醇重结晶两次,真空干燥后储存于棕色瓶内待用;其余所用试剂均为分析纯。
1.2 1的制备
按文献[8]方法进行电极的制备和处理。采用三电极体系(Cu电极为工作电极,Pt电极为对电极,饱和甘汞为参比电极),电解液由DMF 22 mL,H2O 3 mL和0.1 mol·L-1(C3H7)4BF4组成,采用恒电位电解技术,用密闭的电解池,通过气体采样袋,收集的1纯度99%,计算其转化率为90%。
2 结果与讨论
2.1表征
从1的GC-MC谱图(略)可见,其特征离子m/z是15.1,42.1和58.1,与标准1的质谱特征离子m/z基本吻合[9],可以确认DMF在Cu电极上催化还原的产物为1。
2.2反应条件考察
(1)电极
以Cu为电极,其余条件同1.2,以扫描速率为50 mV·s-1的循环伏安曲线见图1。从图1可见,-0.625 V(vs SCE)左右出现还原峰是由于Cu电极上DMF被还原为1所致。正相扫描时,图中没有相对应的氧化峰,说明Cu电极上DMF的还原是完全不可逆过程[10]。
(2)温度
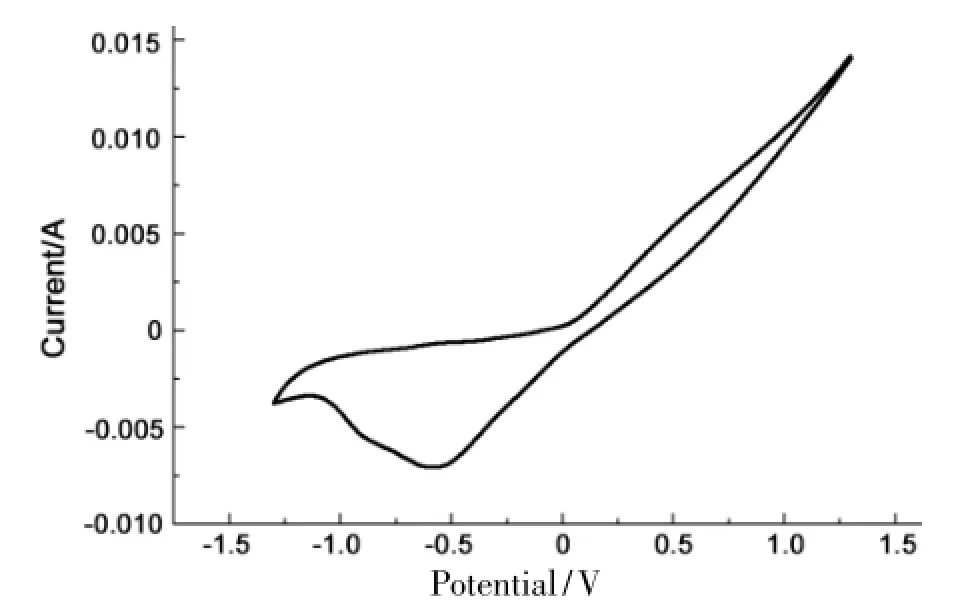
图1 Cu电极的循环伏安曲线*Figure 1 Cyclic voltammograms of Cu electrode
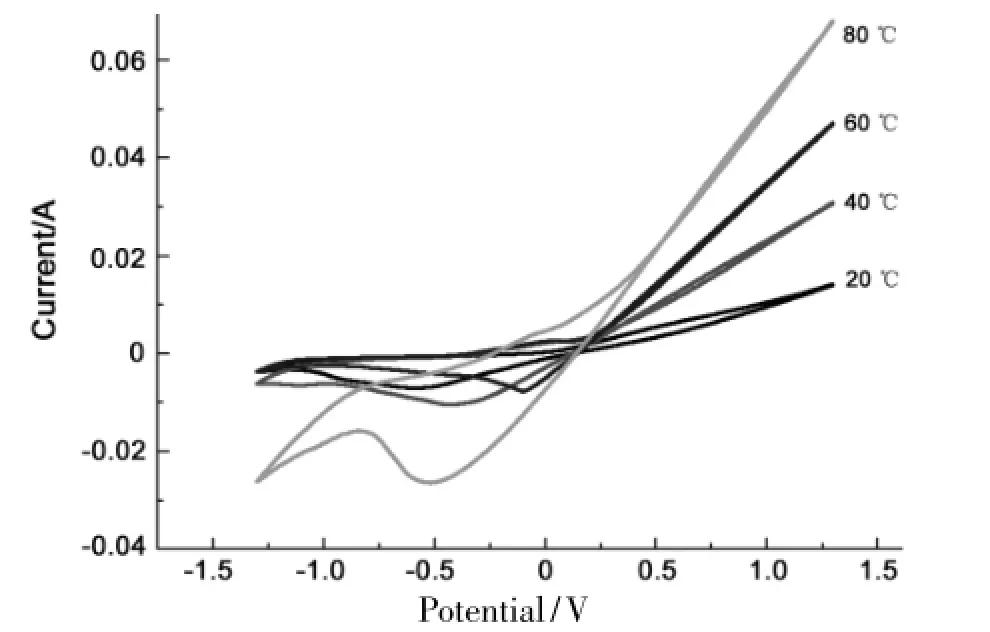
图2 Cu电极在不同温度下的循环伏安曲线* Figure 2 Cyclic voltammograms of Cu electrodeat different temperature
反应条件同1.2,Cu电极在不同温度[(20, 40,60,80)℃]下的循环伏安曲线见图2。由图2可知,随着温度的升高,电流密度逐渐升高,反应速率逐渐加快。这是由于电解液DMF的导电能力差,与水溶液相比较,DMF的粘度高,限制了离子的自由移动,导致溶液的导电能力降低,反应速率缓慢。随着温度的逐渐升高,电解液的粘度逐渐降低,单位时间内单位体积的液体中导电离子的密度逐渐增加,自由离子的移动速率逐渐加快,增强溶液的导电能力,加快反应速率[11]。升高温度,1在溶液中的溶解度降低。这是因为温度升高时,溶剂的饱和蒸汽压随着增大,在总压不变的条件下,降低了1在气相中的分压,因而温度升高时,1的溶解度降低;另外一方面,温度升高时,1分子运动加剧,其从溶剂中逃逸趋势增强,这也使得1的溶解度降低,有利于反应向正反应方向移动。总之,升高温度有利于DMF还原反应发生。
(3)扫描速率
反应条件同1.2,Cu在20℃时在不同的扫描速率[(30,50,70,90) mV·s-1]下的循环伏安曲线见图3。从图3可见,随着扫描速率的增加,还原峰的电势向负方向移动,进一步说明DMF还原反应是不可逆反应[12]。将峰电流与相对应的扫描速率的平方根(v1/2)作图,可以得到峰电流与v1/2呈良好的线性关系(插图,R2= 0.998)。由此可见,在20℃时阴极的还原过程受扩散步骤控制[13-14]。这是由于温度在20℃时溶液的粘度大,离子的自由移动较慢,导电能力差,离子的自由扩散速率比较慢,所以扩散步骤成了反应的控制步骤。
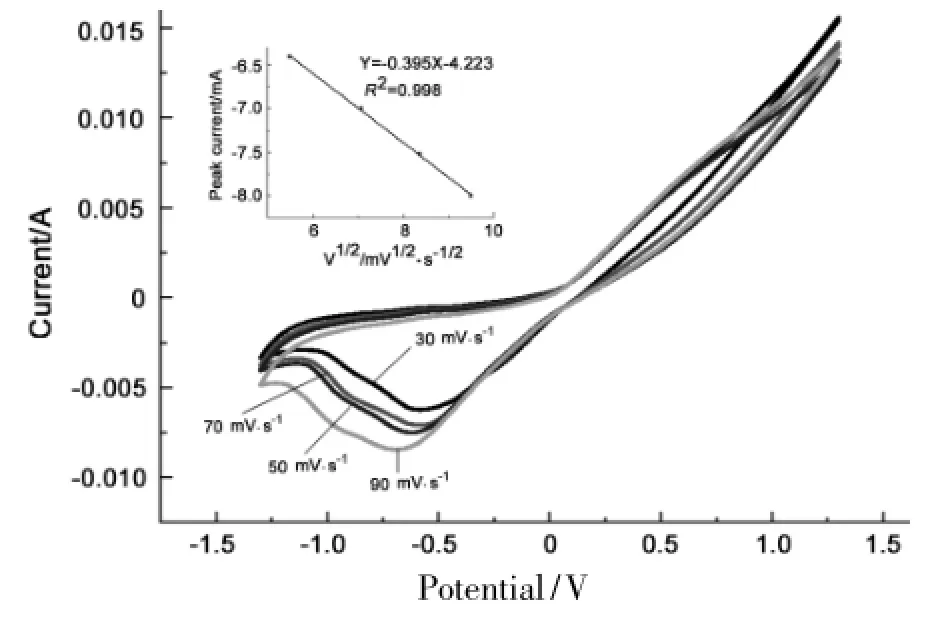
图3 Cu电极在不同扫描速率下的循环伏安曲线*Figure 3 Cyclic voltammograms of Cu electrode at different scanning rates
Cu电极在40℃时在不同扫描速率下的循环伏安曲线与图3类似。虽然温度提高了,但溶液的粘度依然很大,离子的自由扩散速率比较慢。用相同的方法得出R2= 0.994。由此可知,40℃时阴极的还原过程受扩散步骤控制[13-14]。
Cu电极在60℃时在不同扫描速率下的循环伏安曲线见图4。由图4可见,随着扫描速度的增加,还原峰的位置逐渐向负电位方向移动,说明反应是不可逆过程。用相同的方式得R2=0.991,可知60℃时,还原过程受吸附步骤控制[15-16]。这是由于温度升高,溶液的粘度逐渐减小,相应的离子自由移动速率增加,离子的自由扩散速率逐渐提高,离子扩散不再是反应的决定步骤,温度升高至60℃时吸附步骤是阴极的还原过程控制步骤。Cu电极于80℃在不同扫描速率下的循环伏安曲线与图4类似,结论也相似,R2=0.991,可得在80℃时出阴极的还原过程受吸附步骤控制[15-16]。
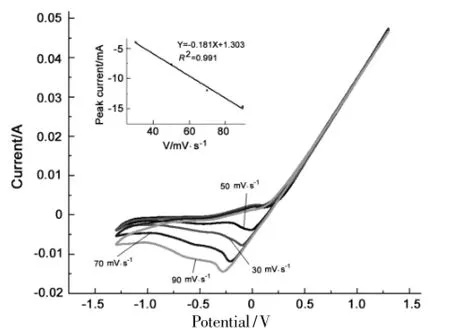
图4 Cu电极在不同扫描速率下的循环伏安曲线*Figure 4 Cyclic voltammograms of Cuelectrodeat different scanning rates
(4)水的用量
反应条件同1.2,Cu电极在不同用水量(0 mL,1 mL,2 mL,3 mL,4 mL)时的循环伏安曲线见图5。
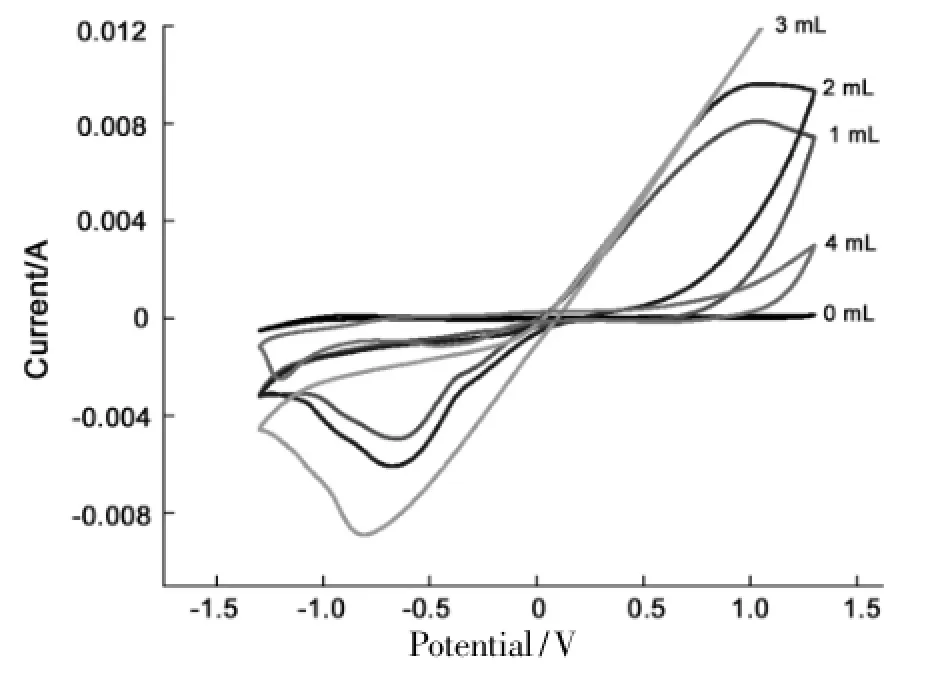
图5 Cu电极在不同用量水的循环伏安曲线*Figure 5 Cyclic voltammograms of Cu electrode with different amount of water
由图5可见,当水用量由0 mL增至3 mL时,电流密度逐渐增加,相应的反应速率逐渐加快。但由3 mL增至4 mL时电流密度减小,反应速率减小。这是由于DMF的粘度较大,水可以作为共溶剂,提高自由离子的扩散速率,通过降低离子的配对和聚合作用,导致自由电荷数量和溶液的流动性的增加[17-18],相应的反应速率加快,但当加入的水体积较大时,会降低Cu电极单位面积上吸附的c (DMF),电流密度反而会减小,相应的反应速率减小,并且水的体积较大时,副反应电解水的反应也会加快。同时可以得到,当水的用量为0 mL时,没有相应的还原峰出现,即没有还原反应的发生,这是由于水在还原DMF反应中还提供反应所需的质子。
3 结论
以Cu电极为工作电极,电还原DMF,在常温常压下,Cu电极对DMF具有较好的电催化还原作用,反应的转化率为90%,并且可以得到纯度99%的三甲胺气体;升高温度,可以提高电解液的导电能力,加快反应速率,有利于三甲胺的合成; DMF还原的动力学行为表明:当温度低于40℃时,该过程受扩散步骤控制;当温度高于60℃时,该过程受吸附步骤控制,反应是一个不可逆的过程。该结论为电化学还原DMF的过程提供了基本的理论依据;水可以作为反应的共溶剂,提高溶液的导电能力,并且提供合成三甲胺所需的质子。相对传统的合成三甲胺的方法,该方法是一种新颖、方便、安全、节能的合成方法。
参考文献
[1]Corbin D R,Schwarz S,Sonnichsen G C.Methylamines synthesis: A review[J].Catalysis Today,1997,37(2) : 71-102.
[2]Jacquet O,Frogneux X,Cantat T.CO2as a C1-building block for the catalytic methylation of amines[J].Chemical Science,2013,4(5) : 2127-2131.
[3]Billinghurst B E,Gough K M,Low G R,et al.CH stretching overtone spectra of trimethyl amine and dimethyl sulfide[J].Journal of Molecular Structure,2004,687(1) : 87-99.
[4]Mei H,Han W J,Hu J L,et al.Palladium-catalyzed unstrained C(sp3) -bond activation: The synthesis of N,N-dimethylacetamide by carbonylation of trimethylamine[J].Applied Organometallic Chemistry,2013,27(3) : 177-183.
[5]Brown A B,Reid E E.The catalytic alkylation of ammonia[J].The Journal of Physical Chemistry,1924,28 (10) : 1067-1081.
[6]Tijsebaert B,Yilmaz B,Mueller U,et al.Shape-selective synthesis of methylamines over the RRO zeolite Al-RUB-41 [J].Journal of Catalysis,2011,278(2) :246-252.
[7]Staelens N,Reyniers M F,Marin G B.Transalkylation of methylamines: Kinetics and industrial simulation[J].Industrial and Engineering Chemistry Research,2004,43(17) : 5123-5132.
[8]Gennaro A,Sanchez-Sanchez C M,Isse A A,et al.Electrocatalytic synthesis of 6-aminonicotinic acid at silver cathodes under mild conditions[J].Electrochemistry Communications,2004,6(7) : 627-631.
[9]Schreiner S,Yu J Y,Vaska L.Carbon dioxide reduction via homogeneous catalytic synthesis and hydrogenation of N,N-dimethylformamide[J].Inorganica Chimica Acta,1988,147(2) : 139-141.
[10]Behbahani M,Mofakham H,Ahmar H,et al.A novel electrochemical method for the synthesis of 2,4-diamino-6-hydroxybenzofuro[2,3-b]pyridine-3-carbonitrile derivatives[J].Journal of Electroanalytical Chemistry,2012,676: 48-52.
[11]Jones A,Kronenwetter H,Manchanayakage R.Electrochemical reductive coupling of 2-cyclohexen-1-one in a mixture of ionic liquid and water[J].Electrochemistry Communications,2012,25: 8-10.
[12]Asghari A,Ameri M,Radmannia S,et al.None-catalyst and clean synthesis of symmetric and asymmetric indoles from electrochemical oxidation of 4-aminophenol and p-phenylenediamine in the presence of malononitrile in green media[J].Journal of Electroanalytical Chemistry,2014,733: 47-52.
[13]Duan X Y,Tian L F,Liu W,et al.Study on electrochemical oxidation of 4-chlorophenol on a vitreous carbon electrode using cyclic voltammetry[J].Electrochimica Acta,2013,94: 192-197.
[14]Masek A,Zaborski M,Chrzescijanska E.Electrooxidation of flavonoids at platinum electrode studied by cyclic voltammetry[J].Food Chemistry,2011,127 (2) : 699-704.
[15]Bieniasz L K,Gonzalez J,Molina A,et al.Theory of linear sweep/cyclic voltammetry for the electrochemical reaction mechanism involving a redox catalyst couple attached to a spherical electrode[J].Electrochimica Acta,2010,56(1) : 543-522.
[16]Go J,Pyun S,Hahn Y J.A study on ionic diffusion towards self-affine fractal electrode by cyclic voltammetry and atomic force microscopy[J].Journal of E-lectroanalytical Chemistry,2003,549: 49-59.
[17]Sun N,Rodriguez H,Rahman M,et al.Where are ionic liquid strategies most suited in the pursuit of chemicals and energy from lignocellulosic biomass[J].Chemical Communications,2011,47(5) :1405-1421.
[18]Feder K J,Tomczuk K.The effect of the cationic structures of chiral ionic liquids on their antimicrobial activities[J].Tetrahedron,2013,69(21) :4190-4198.
·研究简报·
A New Method for Preparation of Trimethylamine by Electrocatalytic Reduction DMF
JIA Rui-long,LIANG Dong,SONG Xiu-li,LIANG Zhen-hai
(College of Chemistry and Chemical Engineering,Taiyuan University of Technology,Taiyuan 030024,China)
Abstract:A new method for preparation of trimethylamine by electrocatalytic reduction DMF was reported.Trimethylamine with 90% conversion and purity of 99% was prepared by reduction of DMF,using Cu electrode as the working electrode,Pt electrode as the pair electrode,saturated calomel electrode as the reference electrode,0.1 mol·L-1(C3H7)4NBF4as the supporting electrolyte,at room temperature and scanning rate of 50 mV·s-1.The structure was confirmed by GC-MS.
Keywords:DMF; trimethylamine; electro-reduction; cyclic voltammetry; electrochemical synthesis
作者简介:贾瑞龙(1988-),男,汉族,山西太原人,硕士研究生,主要从事有机电合成的研究。
基金项目:国家自然科学基金和神华集团有限公司联合资助项目(U1261103)
*收稿日期:2014-12-12;
修订日期:2015-05-06
中图分类号:O621.3
文献标识码:A
DOI:10.15952/j.cnki.cjsc.1005-1511.2015.07.0626
通信联系人:梁镇海,教授,博士生导师,Tel.0351-6018193,E-mail: liangzhenhai@ tyut.edu.cn

